クリニックからのお知らせ
2025.05.05
脂肪性肝疾患における新しい知見 中馬誠先生
2025年3月25日
演題「脂肪性肝疾患における新しい知見:脂質異常症の関与」
演者:横浜保土ケ谷中央病院 副院長 横浜市立大学客員教授
場所:
内容及び補足「
1980年メイヨークリニックの病理医ルードウィッヒ先生が、アルコールを摂取していない脂肪肝患者が肝硬変に進行したことを報告し、非アルコール性脂肪肝炎(Non-alcoholic Steatohepatitis:NASH)と命名した。
その後NASHを含む非アルコール性脂肪性肝疾患(Non-alcoholic Fatty Liver Disease:NAFLD)が定義され、飲酒習慣の少ない(男性30g/日未満、女性20g/日未満)患者の脂肪肝を対象とし、他の肝疾患を除外した慢性肝疾患として認識されるようになった。
NAFLDの多くは無症状で進行しないが、約20%はNASH(Non-Slcoholic Steatohepatitis)に進行し、肝硬変や肝がんに伸展する可能性がある。
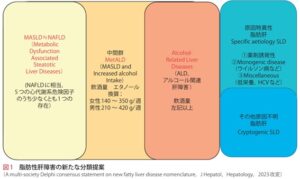
しかし、NAFLDは「非アルコール性」に焦点が当てられており、他の代謝異常などの他の要因を見落とす危険性があるためMASLD(Metabolic Dysfunction-Associated Steatotic Liver Disease)が新たに提唱された。
アメリカ肝臓病学会やヨーロッパ肝臓学会は、2023年6月に従来「脂肪肝(Fatty Liver)」と呼ばれていた疾患を、「脂肪性肝疾患(Steatotic Liver Disease:SLD)」と解消した。NAFLDやNASHはメタボチック症候群の基準の一部を満たす場合に限定して、新たに「代謝機能障害関連脂肪性肝疾患(Metabolic Dysfunction-Associated Steatotic Liver Disease:MASLD)および「代謝機能障害関連脂肪性肝炎(Metabolic Dysfunction-Associated Steatohepatitis:MASH)」へ名称変更することが決定された。
日本の消化器病学会及び肝臓学会も、NAFLDをMASLDに変更する旨の声明を正式に発表した。
MAFLDは、代謝異常を組み入れ基準としている点や、勘組織所見が診断基準に含まれていないため、診断に際して肝生検の必要はなく、健診や日常診療において診断可能であるし、飲酒量やウイルス性肝疾患などの除外診断を必要としておらず、他の肝疾患とは独立した疾患概念である。そのためMAFLDがアルコール性肝障害やウイルス性肝疾患に及ぼす影響の検討も可能である。また、非肥満MAFLDの基準が策定されており、非肥満者の病態解明やイベント発祥の影響も検討しうる。BMI・腹囲や血液生化学検査から算出されるIndexを用いた脂肪肝の評価を行っており、超音波検査などの画像検査を行わない医療機関においてもMAFLDの診断が可能である。

MAFLDとNAFLDの違い
NAFLDは代謝異常と中等量以上の飲酒のどちらも認めない脂肪肝(Group 1)と代謝異常を併発し中等量以上の飲酒を認めない脂肪肝(Group 2)に分類される。他方、MAFLDは代謝異常を併発しているNAFLD(Group 2)と代謝異常と中等量以上の飲酒のどちらも認める脂肪肝(Group 3)に分類される。
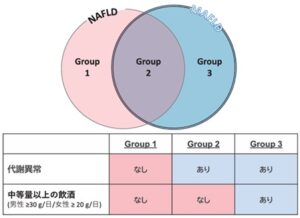
健診受診者で脂肪肝と診断された765名を対象として、上記3群に分類したところGroup 1が117名15.3%、Group 2が424名55.4%、Group 3が185名24.2%であった。(上記3Group以外の代謝異常の併発なく中等量以上の飲酒を認める例は39名5.1%)
NAFLD→MAFLDに診断を変更した際にNAFLDの約80%(424/117+424名)はMAFLDと診断される。一方NAFLDでは除外されていたGroup 3の185名24.2%がMAFLDに組み入れられる。この組み入れられる集団は脂肪肝患者の中の様々なイベントのハイリスク集団であるので、これらの症例がMAFLDとして健診などで同定できる効果は大きいと考える。
肝臓のこわばりをFIB-4 Index≧1.3およびShear wave elastorgraphyを用いたLive Stiffness≧6.6 kPaで定義した際に、MAFLDでは、NAFLDと比較しLiver Stiffnessが高かった(7.7 vs 6.8 kPa)。肝線維化進展の感度はMAFLD(93.9%)が、NAFLD(73.0%)よりも高値であった。
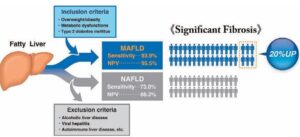
Live Int 2020 40 3018-3030(https://pubmed.ncbi.nlm.nih.gov/32997882/)
https://www.jstage.jst.go.jp/article/kanzo/64/2/64_33/_pdf
診断基準:
飲酒量を換算し、飲酒量が少量(男性210g/週未満、女性140g/週未満)の脂肪肝では、以下の5項目の代謝異常のうち少なくとも1項目を満たす場合にMASLDと診断される。
肥満: BMI≧23kg/m2、または腹囲 男性>94cm、女性>80cm
糖尿病: 空腹時血糖≧100mg/dlまたは食後2時間値≧140mg/dl
またはHbA1c ≧5.7%または2型糖尿病または2型糖尿病治療
高血圧: 血圧≧130/85mmHgまたは降圧薬治療
高中性脂肪: 血清中性脂肪値≧150mg/dlまたは脂質異常治療
低HDL血症: 血清HDLコレステロール値 男性≦40mg/dl、女性≦50mg/dl、または脂質異常治療
分類:
SLD(脂肪性肝疾患):肝臓に過剰な脂肪が蓄積する疾患。
MASLD(代謝障害関連脂肪性肝疾患):以前NAFLDとして知られていた病態。
MASH(代謝機能障害関連脂肪肝炎):MASLDが進行し、肝臓に炎症が起こる状態。
MetALD(代謝機能障害アルコール関連肝疾患):アルコール摂取に加え代謝機能の障害が重なることで起こる肝疾患。1日アルコール摂取量:男性30~60g、女性20~50g
ALD(アルコール関連肝疾患):アルコールの過剰摂取が原因で起こる肝疾患。1日アルコール摂取量:男性60g以上、女性50g以上。
長期間にわたるアルコール摂取のため脂肪の蓄積や炎症、さらには肝硬変を引き起こす。
Specific Aetiology SLD(特定成因脂肪性肝疾患):特定の原因が明確に判明している脂肪性肝疾患で、特定の薬剤や遺伝的要因が関与する場合が該当する。
Cryptogenic SLD(成因不明脂肪性肝疾患):はっきりした原因が特定されない脂肪性肝疾患
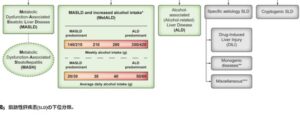
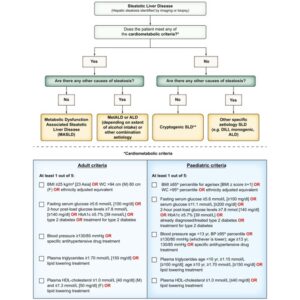
J Hepatol 2023 79 1542-1556
https://www.journal-of-hepatology.eu/article/S0168-8278(23)00418-X/fulltext
J hepatology 82 2025
https://www.journal-of-hepatology.eu/action/showPdf?pii=S0168-8278%2823%2900418-X
参:脂肪肝について
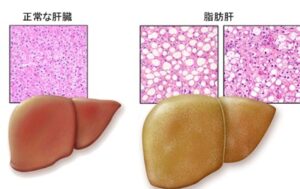
正常肝臓と脂肪肝の病理組織は数のように異なり、肝細胞の5%以上が脂肪化すると脂肪肝と診断される。
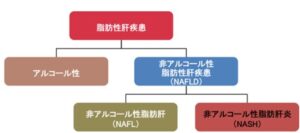
脂肪肝は、アルコール性と非アルコール性脂肪性肝疾患(Non-alcoholic fatty liver disease:NAFLD)に分類され、NAFLDは幹細胞の障害や炎症を伴う非アルコール性脂肪肝炎(Non-alcoholic steatohepatitis)と伴わない単純性脂肪肝(NAFL)に分類されていた。
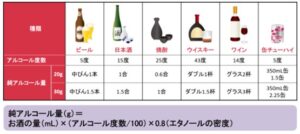
エタノール換算で男性30g/日、女性20g/日以上の飲酒量でアルコール性肝障害を発症しうるので、NAFLDの飲酒量はそれ未満であると定義されている。
NAFLDの10~20%がNASHであり、治療しない場合5~10年でおよそ5~20%の患者が肝硬変になり、さらに年間約2%の患者が肝硬変から肝がんになると言われている。
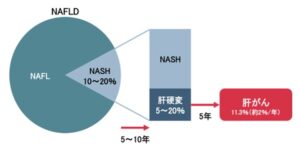
(日本肝臓学会編 NAFLDの予後 NASH/NAFLDの診療ガイド2015)
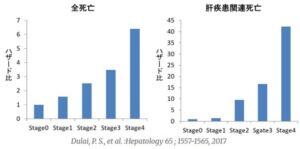
NAFLDでは、肝臓の線維化が進むほど死亡率が高くなる。
脂肪肝の治療は食事療法や運動療法などの生活習慣の改善が中心で、NASHで肥満のある症例は、食事・運動療法により-7%の減量を目指す。糖尿病、脂質異常症、高血圧を合併している場合はそれぞれの疾患の薬物療法を行う。これらの合併症がない場合は、ビタミンE製剤(ユベラ)が用いられる。
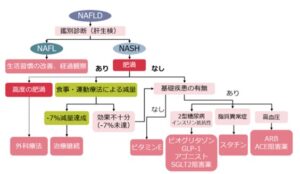
NAFLDの治療 日本消化器病学会編 NAFLD/NASH診療ガイドライン2020
https://shoukakikanzou.com/nafld/
2014年から2018年にかけて日本国内の13の保健センターに登録されたメタボリックシンドローム、CKD、脂肪肝症例410061例の成人の健診登録から1日あたり20g以上のアルコール摂取例、慢性肝疾患症例を除外した71254例の検討がある。
NAFLDは25.8%で、男性37.4%、女性18.1%と男性に2倍の有意差があった。NAFLD症例の14%が糖尿病、31%が高血圧、48%が脂質異常症症例であった。
NAFLDのFib-4での線維化症例は1.7%、NFSは1.0%であった。
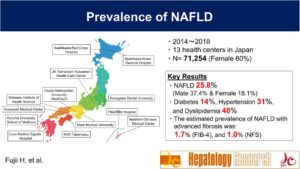
https://onlinelibrary.wiley.com/doi/10.1111/hepr.13947
参:Prognostic and predictive effects of new steatotic liver disease nomenclatures: a large population-base study
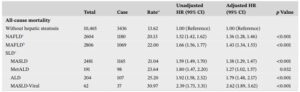
UK Biobank(UKB)の464556例、National Health and Nutrition Examination Survey(NHANES)の13526例、Beijing FH Health Cohort Study(FHCS)の2554例のデータでMAFLD、Masld、ALD、MetALDおよびMasld-Viralとの関連を肝硬変、肝がん、及び死亡リスクを検討した。
非SLDと比較して、肝がんのリスクは、UKB集団で、MetALD 1.70、MASLD 1.91、MAFLD 2.01、ALD 3.16、MASLD-Viral 22.0と増加した。
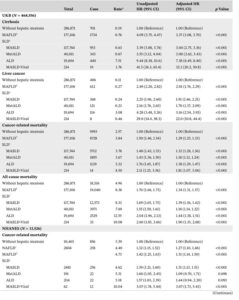
全死因死亡リスクは、非SLDと比較して、MetALD 1.27、MASLD 1.38、MAFLD 1.43、ALD 1.79、MASLD-Viral 2.62と増加した。
https://onlinelibrary.wiley.com/doi/10.1002/mco2.70087
https://onlinelibrary.wiley.com/doi/pdf/10.1002/mco2.70087
参:
NAFLDの有病率は、欧米諸国では20~40%、アジア諸国では12~30%、日本では10~30%、進行性NASHの有病率は、世界的には3~5%と報告されている。
2023年度内科学会生涯教育講演
https://www.jstage.jst.go.jp/article/naika/113/3/113_404/_pdf/-char/ja
参:
Fib-4インデックス= 年齢×AST(U/L)
血小板(109/L)×ALT(U/L)1/2
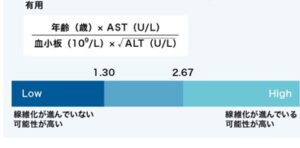
Fib-4 Index の計算式(肝臓検査.com)
https://kanzo-kensa.com/examination/calc/
肝臓線維化程度と血小板数の関係
肝炎や肝硬変などで肝臓の線維化が進行すると、血小板の産生量が減少したり、肝血流障害から門脈圧亢進・脾臓の腫大により血小板の破壊が更新し、血小板数が減少する。その関係をみてみると数のように報告されている。

https://www.niigatah.johas.go.jp/course/a02_10.html
HCV単独感染者に対して実施された一連の847回の肝生検の結果とFib-4値を検討した結果では、Fib-4<1.45では、74.3%の感度で重度の肝線維症を除外するための94.7%の陰性的中率であり、Fib-4≧3.25では、82.1%の有意な線維症(F3-F4)の陽性的中率の特異度は98.2%であった。
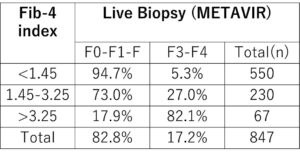
Hepatology. 2007 Jul;46(1):32-6.
https://pubmed.ncbi.nlm.nih.gov/17567829/
https://onlinelibrary.wiley.com/doi/10.1002/hep.21669?msockid=347a22da622067a4382936e8635a66fc
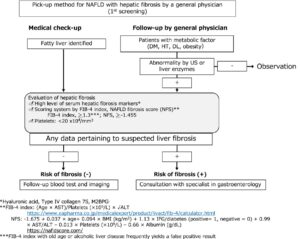
肝線維症、肝細胞癌、または心血管疾患のスクリーニングとフォローアップの全体的なフローチャートを作成する最初のステップは、一般医によるNFLDのスクリーニングである。
進行性線維症を除外するための高い陰性的中率を持つFib-4インデックスやNAFLD線維症スコア(NFS)でリスク評価を行う。
低リスク:Fib-4<1.3またはNFS<-1.455、中リスク:Fib-4 1.3-3.25またはNFS -1.455-0.672、高リスク:Fib-4>3.25またはNFS>0.672でふるい分けし、中リスク以上の患者では、振動制御一過性エラストグラフィ(VCTE)で肝臓のこわばりを測定する必要がある。
肝線維症を伴うNAFLDの第1回スクリーニングフローチャート
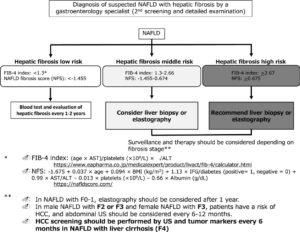
消化器病専門医が実施する第2回のスクリーニングフローチャートは、まずFib-4インデックスまたはNFSを計算し、低リスク群の患者(Fib-4<1.3またはNFS<-1.455)では、1年ごとに評価を繰り返す。
中等度の肝線維症(Fib-4インデックス1.3-2.66またはNFSが-1.455-0.674)が疑われる場合は、肝生検またはVCTEまたは磁気共鳴エラストグラフィー(MRE)を検討する必要がある。
重度の肝線維症(Fib-4インデックス≧2.67またはNFS≧0.675)が疑われる場合には、肝生検またはエラストグラフィーが推奨され、線維化の病期または観光直に応じて、サーベイランスと治療を検討する。
肝線維症を伴うNAFLDの第2回スクリーニングとHCCスクリーニングフローチャート
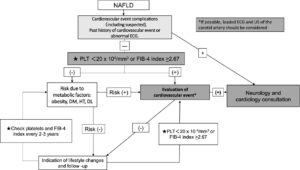
NAFLD患者の最も一般的な死亡病因はCVDであり、NAFLD患者においては心血管イベントスクリーンイングをするべきであり、以下にフローチャートを示す。
まず、CVDの合併やCVDの既往歴を確認し、心電図検査を行い、異常所見があれば循環器内科や神経内科の専門医に相談する。血小板数の減少、またはFib-4インデックスの増加を伴うNAFLDでは、負荷心電図や頸動脈の超音波検査などの心欠陥検査を行う必要がある。
NAFLD患者における心血管イベントスクリーニングフローチャート
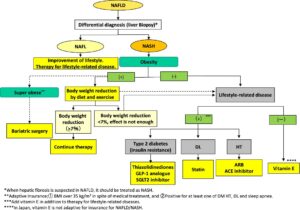
NAFLD患者は通常、内臓肥満、インスリン抵抗性、2型糖尿病、脂質異常症などの代謝障害と関連しており、肝疾患自体だけでなく、これらの関連する代謝疾患の治療も必要である。
2型糖尿病があれば、ピオグリタゾン、GLP-1アナログ、SGLT2阻害薬が、脂質異常症があれば、スタチン、PPARαモデュレーターが、高血圧があれば、ARBやACEIが、それらがない場合にはビタミンEが推奨される。
従来容量のウルソやビグアナイドは肝臓の組織系型の改善のエビベンスがないので推奨しない。
NAFLD/NASHの治療のフローチャート
J Gastroenterol. 2021 Nov;56(11):951-963
https://link.springer.com/article/10.1007/s00535-021-01796-x
file:///C:/Users/jeffb/Downloads/s00535-021-01796-x.pdf
耐糖能障害または2型糖尿病患者で肝生検を行いNASHが確認された患者55例を6ヶ月間、低カロリー食+ピオグリダゾン45mg/日の投与群と、低カロリー食+プラセボ群で比較検討したところ、ピオグリダゾン群では、AST、ALTの低下及び死亡変性、バルーニング壊死、炎症波改善した(線維化の軽減には有意差はみられなかった)。
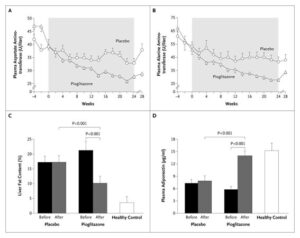
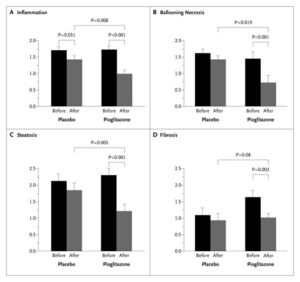
N Engl J Med 2006;355:2297-2307
https://www.nejm.org/doi/full/10.1056/NEJMoa060326
肝生検でNASHの診断が確定し、肝線維化ステージがF1、F2、F3のいずれかの患者を対象に、セマグルチド0.1mg、0.2mg、0.4mgを1日1回皮下投与する群と対応するプラセボを投与する群に3:3:3:1:1:1の割合で無作為に割り付け肝線維化の変化を検討した。
NASHが消散した患者の割合は、0.1mg群40%、0.2mg群36%、0.4mg群59%、プラセボ群17%であり有意な差を認めた。肝線維化ステージの改善は、0.4mg群の43%とブラセボグンの33%に認められ、有意差は認めなかった。体重減少率の平均は、0.14mg群で13%、プラセボ群で1%であった。
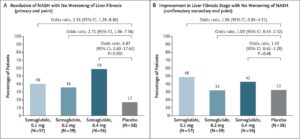
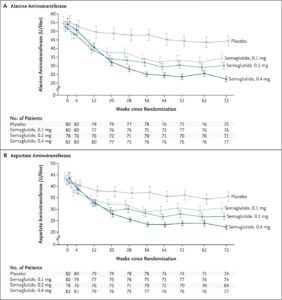
N Engl J Med 2021;384:1113-1124
https://www.nejm.org/doi/full/10.1056/NEJMoa2028395
NAFLDの2型糖尿病患者7名におけるSGLT2阻害薬投与における肝臓の病理学的変化は、治療開始前、24週間後、1年後のサイン会の肝生検を行った。治療前と比較し3回目の肝生検では、脂肪症、小葉性炎症、バルーニング、線維化のスコアがそれぞれ57%、43%、14%、29%で改善していた。
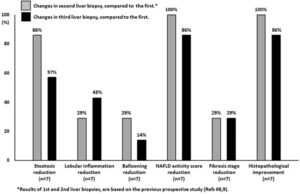

Intern Med. 2020 May 23;59(16):1931–1937.
https://pmc.ncbi.nlm.nih.gov/articles/PMC7492114/
https://www.jstage.jst.go.jp/article/internalmedicine/59/16/59_4398-19/_pdf/-char/ja
SGLT2阻害薬はDPP-4阻害薬二比較し、1年後の肝機能、肝線維化マーカーの改善はよかったが、両者併用でより改善していた。
参:SGLT2阻害薬(6547例)とDPP-4阻害薬(6547例)のMAFLD及び糖尿病患者に対する治療効果を大規模な行政請求データベースから分析した結果では、SGLT2阻害薬の使用は、DPP-4そがいやっくの使用よりもFatty Liver Indexの大幅な減少と関連していた。
J Endocrinol Invest. 2024 May;47(5):1261-1270.
https://pubmed.ncbi.nlm.nih.gov/38114769/
SGLT2阻害薬投与による肝線維化の改善機序として、血糖値の低下、インスリン抵抗性の改善、肝内トリグリセリドの酸性低下、脂肪毒性の減少、抗炎症作用、アポトーシスの抑制などが考えられる。
NAFLD肝臓関連及び心血管疾患に由来する全死亡率が増加(OR 1.57)し、糖尿病のリスクが二倍になる。
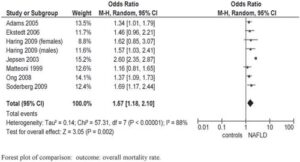
Ann Med. 2011 Dec;43(8):617-49.
https://www.tandfonline.com/doi/full/10.3109/07853890.2010.518623#d1e402
スタチンの投与により、NAFLD患者において、肝臓における炎症、線維化、門脈圧の上昇、発がんを抑制する可能性が示されている。
Atherosclerosis. 2019 May:284:66-74
https://www.atherosclerosis-journal.com/article/S0021-9150(19)30116-9/abstract
スタチンの投与により脂肪肝、NASH、線維化は改善した。
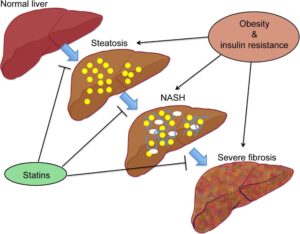
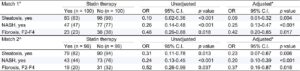
J Hepatol. 2015 Sep;63(3):705-12.
https://www.journal-of-hepatology.eu/article/S0168-8278(15)00328-1/abstract
参:
NAFLDは、先進国における肝疾患の主な原因の一つであり、2020年のNAFLD疫学調査の結果によると世界中で約17億人が推計されている。
一般集団におけるNAFLDの発生率は6.3~33%で、肥満分の発生率は24~98%、糖尿病は43~60%、脂質異常症は91%である。
発症率は年齢とともに増加し、60歳以上で40%以上と言われている。高齢のNAFLD症例では、肝線維症や肝硬変を発症しやすくなっており、男性は女性よりもNASH及び肝硬変を発症しやすい。
NAFLDの初期段階は、単純な脂肪肝として現れ、脂肪含有量が肝臓重量の5~10%を声、NAFLD患者の47%がNASHを発症する。
これらのNASH患者のうち、25~30%の患者が不可逆的な肝線維症を発症し、その後、肝硬変や肝細胞癌に進展し、死亡率も徐々に増加する。NAFLD誘発性心血管疾患は主要な死因の一つになっており、肝臓超音波検査、CT、MRI等を用いてNAFLDを診断する必要がある。
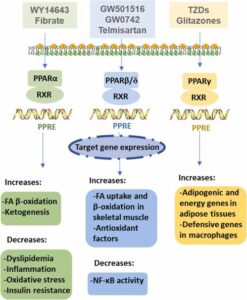
ペルオキシソーム増力因子活性化受容体PPARは、脂質代謝、グルコース恒常性、エネルギーバランス、炎症、アテローム性動脈硬化症の転写調節に関する核内受容体スーパーファミリーのリガンド活性化転写因子である。PPARはα、β/δ、γの3つのアイソフォームがあり、これらは様々な組織で発言が異なる。
PPARαは肝臓に偏在しており、肝臓の脂質と体のエネルギーバランスを制御するペルオキシソームβ酸化、ミトコンドリアβ酸化、ミクロソームω酸化の3つの肝臓の脂肪酸酸化代謝経路の調節に関与している。
齧歯類においては、リポタンパク質合成、炎症反応、肝がんの発症にも重要な役割を果たしている。
PPARβ/δは、主に骨格筋に発現し、脂肪組織や皮膚にはそれほど発現していない。骨格筋や脂肪組織における脂肪酸酸化代謝とエネルギー脱共役プロセスを強化し、飢餓に対する肝臓のストレス反応に関与している。また、循環器系における炎症反応のシグナル伝達を減少させ、肝障害を回避している。
PPARγにはPPARγ1、PPARγ2,PPARγ3の3つのサブタイプがあり、1と3は同じタンパク質をコードしている。PPARγは脂肪組織で高発現しており、脂肪細胞の分化と脂肪細胞のエネルギー貯蔵を調節している。肝臓、腎臓、肺、直腸でも発現しており、過剰発現によりこれらの組織に脂肪が蓄積する可能性がある。
リガンドが結合すると、PPARは核内に移動し、レチノイドX受容体(RXR)とヘテロ二量体化し、ペルオキシソーム増力因子応答要素(PPRE)に結合して標的遺伝子の転写を調節する。
PPARは、脂肪酸とエイコサノイド、およびPPARαモデュレーター、フィブラート、PPARβ/δはベザフィブラートおよびテルミサルタン、PPARγはグリタゾンなどによって活性化される。
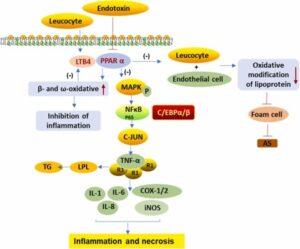
炎症に対するPPARαの生物学的役割
LTB4はPPARαの内因性リガンドとして、ベタ酸化的及びω酸化的代謝経路を誘導し、自己分解を促進し、炎症を抑制する。また、ROS産生とヒドロラーゼのリソソーム放出を誘導する。PPARαの活性化は。白血球の内皮細胞への結合を阻害し、それによりリポタンパク質酸化修飾を減少させることにより、マクロファージ由来の泡沫細胞の形成とアテローム性動脈硬化性プラークの形成を阻害する。
エンドトキシンは、PPARαの発現を阻害し、探求マクロファージシステムを活性化し、NF-κBシステムを活性化し、TNFα、IL-1、IL-6、IL-8、PG、COX-1/2等の発現、合成、分泌を促進する。TNFα
はLPLを阻害し、幹細胞におけるTGの合成と凝集を促進する。
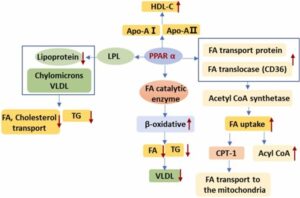
PPARα合成リガンドと脂質低下薬フィブラートの投与では、PPARαアゴニストがLDLレベルを変えることなくTGを減少させ、HDLを増加させ、冠状動脈精神疾患の発生を減らすことが示されており、また、ASプラークの進行を遅らせることも示された。
作用機序
- PPARα脂肪酸輸送タンパク質と脂肪酸トランスロカーゼ(CD36)をアップレギュレーションし、アセチルCoA合成酵素の発現を増加させ、FAの摂取とアシルCoAへの変換を刺激する。FA取り込み後、PPARαは筋肉及び肝臓特異的なCPT1の発現を誘導し、ミトコンドリアへの脂肪酸の輸送を調節する。PPARαは、ミトコンドリアにおける脂肪酸トランスポーターや脂肪酸触媒酵素の発現を調節し、ミトコンドリアにおける脂質の代謝を調節している。肝臓やミトコンドリアにおける脂肪酸のβ酸化を促進し、FAやTGの合成を減少させ、その結果、VLDLが減少する。
- PPARαは脂質代謝に関与する酵素に誘導されるだけでなく、多くのアポリポタンパク質の調節にも関与している。フィブラートなどのPPARα活性化因子は、apoA-1およびapoA-2 mRNAの発現増加を誘導し、この因子が肝細胞に侵入して循環中のHDLを増加させる。それにより抗AS効果がみられる。
- PPARαはアポAE遺伝子発現を減少させ、LPL活性の増加につながり、LPL遺伝子発現を促進し、カイロミクロンやVLDL等のTGリッチリポタンパク質の異化作用を加速させ、血中TGレベルを低下させ、TGF-β立地LDLレベルが低下する。
- PPARαはリポタンパク質の代謝を妨害することにより、血中のFAとコレステロールの輸送に影響する。また、PPARαは、ミクロソーム及びペルオキシソームのβ酸化の律速酵素転写を増加させることにより、FA加水分解を促進する。
- PPARαはヒト肝臓のリポタンパク質エステラーゼの活性を高める。
- 末梢組織から肝臓へのFAの輸送のPPARαを介した増加は、骨格筋のグルコース代謝に対するFA阻害の減弱を引き起こし、インスリン感受性を増加させる。
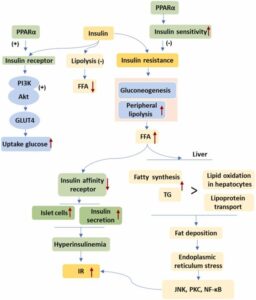
生理学的条件下では、インスリンはインスリン受容体に結合し、インスリン受容体基質(IRS)をリン酸化し、インスリンシグナルを伝達する。ホスホイノシトール3キナーゼ(PI3K)-Akt経路の活性化後、グルコーストランスポーター4(GLUT4)は細胞膜に移行し、グルコースを取り込む。インスリン抵抗性(IR)とは、様々な組織のインスリン感受性の低下を指し、その正常レベルは血糖値の安定性や体の他の機能を低下させるため、インスリン分泌は増加し、体は高インスリン血症となる。
IRSが発生すると、脂肪合成が損なわれ、グルコース利用が減少し、糖新生が促進され、脂肪分解が増加し、FFAレベルが増加する。肝臓に摂取された後、高インスリン血症は、肝細胞の脂肪蓄積によって脂肪肝が形成される。一方、インスリンはSREBP-1cをアップレギュレーションして脂質合成をさらに促進する。
肝臓での脂質沈着は、インスリンに対する肝臓の感受性に影響を与える。肝臓の脂肪酸は小胞体ストレスを引き起こし、c-Jun N末端キナーゼ(JNK)、IκBキナーゼ2(IκK2)、およびプロテインキナーゼC(PKC)を活性化する。JNKはIRS1及びIRS2のセリンリン酸化部位をリン酸化し、インスリンシグナルの伝達を妨げるチロシンでのリン酸化を減少させる。次に、IκK2はNFκBを活性化して、炎症性ストレス応答とIRを引き起こす。脂肪沈着とIRは相互作用して悪循環を形成する。
Pharmacological Research 192 2023 106786
https://www.sciencedirect.com/science/article/pii/S1043661823001421
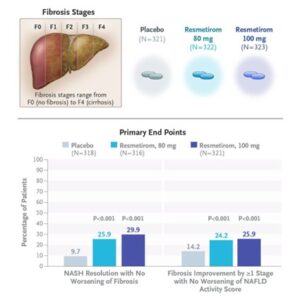
Resmetirom:甲状腺ホルモン受容体βの選択的アゴニスト
肝生検によって確認された線維化ステージF1B、F2、F3のNASH患者を対象とした第3相試験。1日1回80mg322例、100mg323例のResmetirom、またはプラセボ321例を1:1:1の割合でランダムに割り当てられ投与された。主要評価項目は、52週時点での肝線維化の悪化を伴わずNASHが解消(NAFLD activity scoreの2点以上の減少を含む)すること、およびNAFLD activity scoreの悪化を伴わずに肝線維化が少なくとも一段階改善することである。
NASHの解消は80mg群の患者の25.9%、100mg群の29.9%、プラセボ群では9.7%であり有意な差を認めた。1段居合い以上の肝線維化改善は80mg群で24.2%、100mg群で25.9%、プラセボ群で14.2%で有意な差を認めた。
N Engl J Med 2024; 390:497-509
https://www.nejm.org/doi/full/10.1056/NEJMoa2309000
参:
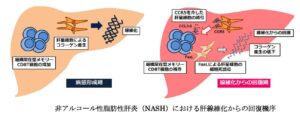
NASHモデルマウスにおいて、NASHの病態回復において、組織常在型メモリーCD8T細胞が関与していることを慶應義塾大学と田辺三菱製薬株式会社の共同研究グループが発見した。
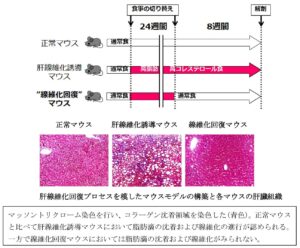
マウスに高脂肪高コレステロール食を24週間摂取させMASH病態及び肝線維化を誘導した後、通常食に切り替えてNASH病態及び肝線維化からの回復を検討した。
通常食に切り替えてからマウスの体重やALT等の肝臓の炎症マーカーは急激に減少し、肝臓の線維化からの回復が顕著に認められた。8週間後には体重やALT、肝臓の線維化は通常マウスと同程度にまで回復した。
フォローサイトメトリーにより、肝線維化回復期における免疫再暮雲動態を解析すると、病態誘導によって顕著に増加していたCD8T細胞が、肝線維化病態は改善しているにもかかわらず、回復期においても残存し続けていることがわかった。除去抗体を用いて回復期のCD8T細胞を除去したところ、肝線維化からの開腹は遅延した。→CD8T細胞は、肝線維化からの開腹で重要である。
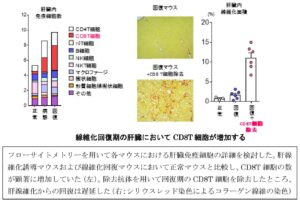
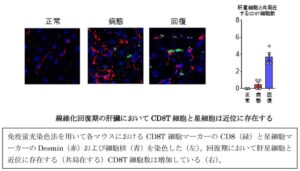
線維化回復期のCD8T細胞は、線維化病態において悪化させている肝星細胞と非常に近接して存在している。CD8T+Trm細胞の回復期における遺伝子発現を検討したところ、肝星細胞を近くに呼び寄せる作用を持つケモカインを非常に多く産生していることがわかった。肝星細胞の表面にあるこれらのケモカインを完治する受容体(CCR5)の発現を低下させたところ、CCR5の発現を低下させたマウスにおいて、線維化からの回復が顕著に遅れた。
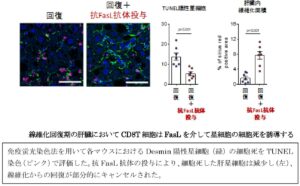
CD8T+Trm細胞がFasLと呼ばれるタンパク質を介して肝星細胞の細胞死を誘導していることが判明し、回復期に抗FasL抗体を用いてこのシグナルを抑制すると細胞死した肝星細胞の数が減少し、肝線維化の下腹がキャンセルされた。→CD8T+Trm細胞が肝星細胞と近位に存在し、線維化の悪玉である肝星細胞の細胞死を誘導することで、線維化からの回復を促進している。
https://www.keio.ac.jp/ja/press-releases/files/2021/7/29/210729-1.pdf
























