川村所長の勉強会参加記録
2015.08.24
原発性アルドステロン症 伊藤貞嘉教授
2015年6月29日 ホテル横浜キャメロットジャパン
演題「原発性アルドステロン症」
演者: 東北大学大学院医学系研究科 腎・高血圧・内分泌学教授 伊藤貞嘉先生
内容及び補足「
アルドステロンは、1953年にSimpsonが副腎皮質の球状帯から分泌されるナトリウムカリウムのバランスを制御するステロイドホルモンとして初めて単離した。
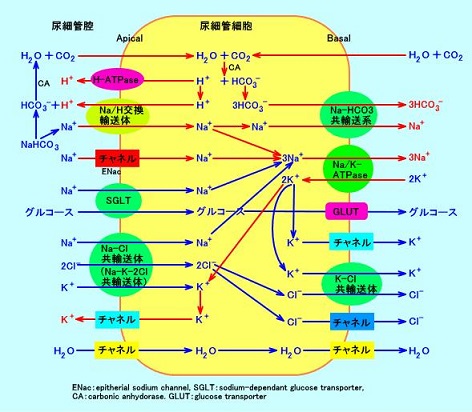
アルドステロンは尿細管腔側(刷子縁膜側)のNa+チャンネルを介して、Na+を尿細管細胞に取り込み、基底膜側(血管側)のNa+/K+-ATPaseでNa+を汲みだし、Na+再吸収を活性化させる。
遠位尿細管や集合管の上皮では、基底膜側のNa+/K+-ATPaseで、細胞内のNa+を細胞外(血液中)に汲みだし、尿細管腔側のNa+チャンネルから、尿細管腔の原尿中のNa+を細胞内に流入させる。この時同時に、K+とH+が、血液中から尿細管腔へ転送される。
ナトリウム再吸収はNa+HCO3-共輸送系により行われるので重炭酸イオン(HCO3-)の吸収も促進する。
そのため、原発性アルドステロン症では、高血圧、高Na血症、低K血症、代謝性アルカローシルが現れる。
http://hobab.fc2web.com/sub4-aldosterone.htm
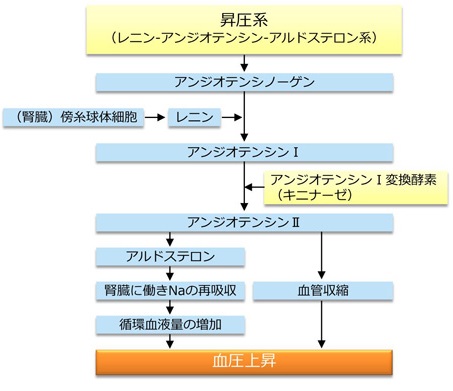
アルドステロンは、レニン・アンジオテンシン・アルドステロン系RAA系といわれる調節系で分泌が調節されている。
ヒトの体液量は、体内のNa+量により決定され、その体内のNa+量は、主にRAA系により調節される。
体内のNa+量が低下し、それに伴い尿細管液(原尿)のCl-濃度の低下や、血圧の低下(体液量の低下)を腎臓の傍糸球体装置が感知すると、レニン分泌を増加させる。レニン分泌の増加に伴い、アンジオテンシノーゲンからアンジオテンシン1の変換が亢進する。それに伴って増加したアンジオテンシン2により、副腎皮質の球状帯からアルドステロンが分泌され、腎臓でのNa+再吸収が増加し、体液量が増加し、血圧が上昇(回復)する。
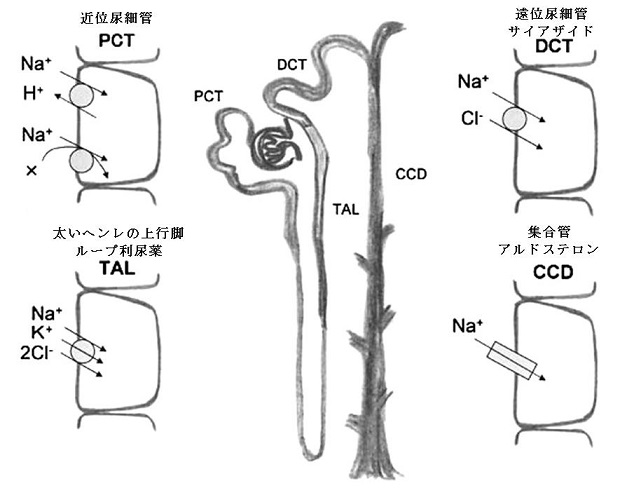
太いヘンレの上行脚でNa+、K+、2Cl-の再吸収が行われ、ここにはループ利尿薬が作用する。
遠位尿細管でNa+、Cl-の再吸収が行われ、サイアザイドが作用する。
集合管でNa+の再吸収とCl-、K+、H+の排泄が行われて、アルドステロンが作用する。
日生誌 67、325-332:2005を改変
http://physiology.jp/wp-content/uploads/2014/01/067100325.pdf
アルドステロンの分泌は、アンジオテンシン2(AT2)、カリウム(K)、副腎皮質刺激ホルモン(ACTH)によって、刺激される。
http://www.adalat.jp/ja/home/pharmacist/basic/01/t07.php
原発性アルドステロン症(Primary aldosteronism:PA)は1955年にConn, J.W.が全高血圧患者の20%を占める疾患として報告された。
日本においては鳥飼龍生東北大学病院第二内科教授
http://www.int2.med.tohoku.ac.jp/enkaku.html
により昭和31年に原発アルドステロン症第一例が報告された。
昭和35年に鳥飼教授は、PAについて以下の特徴を上げている。
1. 診断が重要で、手術により治癒する
2. 低K血症を伴わない症例がある
3. 腎不全で浮腫がない
4. コモンな病気である
5. バリエーションが大きい
6. 徐々に重症化する
日本内分泌学会雑誌 36(9), ????, 1960-12
低カリウム血症からスクリーニングされていた時代においては高血圧患者の0.5%にPAが認められると考えられていたが、近年ではスクリーニングに血中アルドステロン/レニン比*高値を指標に用いるようになり、平成22年度の全国疫学調査で5年間の推定患者数7487人と報告されており、高血圧症の5-10%程度の頻度で発見されるとの報告が増えている。

J Clin Endocrinol Metab 93:3266-3281, 2008
スクリーニングは近年『血漿アルドステロン濃度(PAC)と血漿レニン活性(PRA)の比=ARR=PAC(ng/dL)/PRA>20、PAC>12かつPRA<1』で行っている。
http://www.yamaguchi-endocrine.org/pdf/Treatise01.pdf
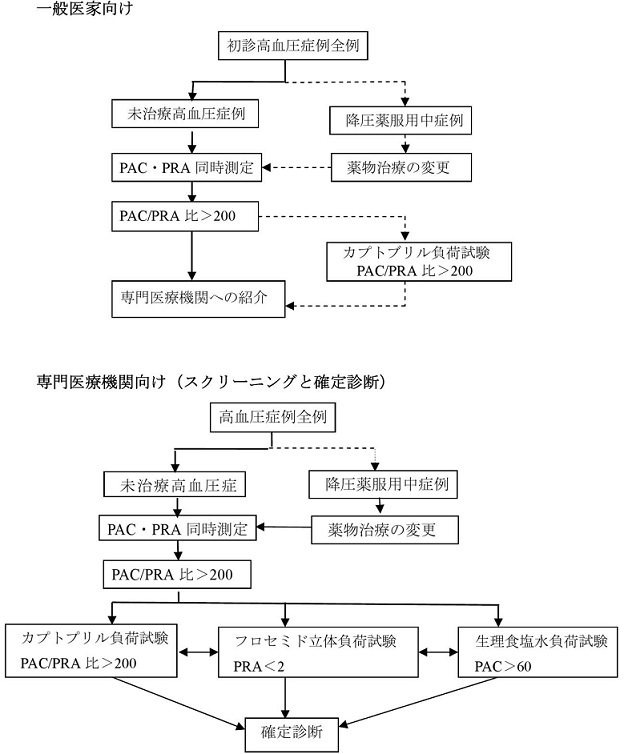
http://www.yamaguchi-endocrine.org/pdf/Treatise01.pdf
降圧薬による血漿レニン活性、血漿アルドステロン濃度への影響を下に示す。

ARR測定については、ARBやACEIは原則中止としているが、服用中止が困難な場合には、継続したままの測定を勧められている。
PAスクリーニングのためのARRカットオフ値とその感度・特異度を示す。
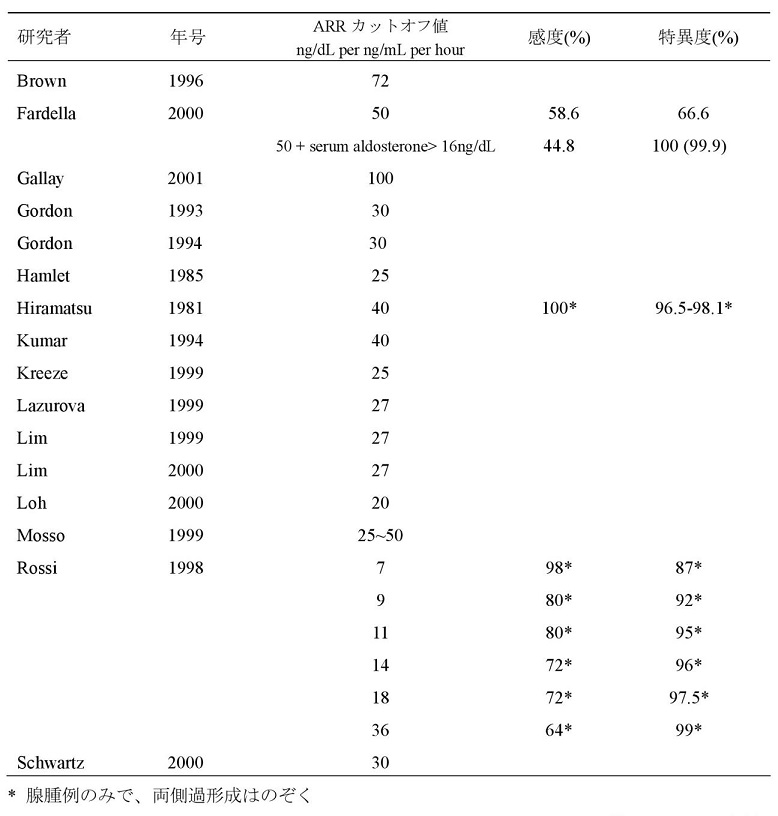
Endocrinol Metab Clin North Am 31:619-632, 2002
PAの確定診断のために行わせる各種負荷試験の内容と判定を下記に示す。

ガイドラインにはまだ記載されていないが、迅速ACTH負荷試験によるPACの課題反応の有無をとらえることが、PAの診断に非常に有用なことがわかってきたので、30分間の安静臥床後、負荷試験(カプトリル50㎎負荷後もPAC/PRA>20、またはPRA<1で、ACTH負荷後のPAC(ng/dL>20)で確定診断を行っている。
『薬剤での血圧低下が困難な人、30-40代で家族歴のない高血圧、ARBやACEI投与でも低カリウム血症が認めている人』は積極的な検査がすすめられている。
高血圧治療ガイドライン2014でも以下の高血圧群においてスクリーニング検査が推奨されている。
https://www.jpnsh.jp/data/jsh2014/jsh2014v1_1.pdf
・ 低カリウム血症(利尿剤誘発性も含む)合併高血圧
・ 若年者の高血圧
・ 2度以上(中等症・重症)の高血圧
・ 治療抵抗性高血圧
・ 副腎偶発腫瘍を伴う高血圧
・ 40歳以下で脳血管障害合併例
鑑別すべき疾患:
低レニン性本態性高血圧
先天性副腎過形成(11-、17-水酸化酵素欠損症)
リドル症候群(低レニン性低アルドステロン)血症
肝臓投与による高血圧(グリチロン、甘草を含む各種漢方薬)
Apparent mineralcorticoid excess (AME:11-hydroxysteroid dehydrogenase deficiency)
PAの合併症:
年齢、性別、血圧、血糖値で補正した後の本態性高血圧症症例との比較であるが、脳卒中が4.2倍、心筋梗塞が6.5倍、心房細動が12.1倍、左室肥大が1.6~2.9倍と高率に見られており(J Am Coll Cardiol 45:1243-1248, 2005)、本邦でも、171例のPA患者の合併症を検討した報告があり、心肥大が53%、腎機能障害12%、脳血管障害10%(Surgery 112 :987-993, 1992)と高頻度に認められている。
アルドステロン過剰による臓器障害(脳出血、脳梗塞、心筋梗塞、心肥大、不整脈、腎不全など)を示す疾患として考えられているが、その機序として、術前の罹病期間やホルモン活性の強さに伴う心血管径への直接障害が影響しているものと考えられている。
http://repository.kulib.kyoto-u.ac.jp/dspace/bitstream/2433/173720/1/59_225.pdf
PAの病型分類

1.1のAPAが最も多い。
症状:高血圧及び低カリウム血症が代表的症状。低カリウム血症がある場合には、口渇、多尿、多飲、筋力低下、四肢麻痺などの症状が出るが、PAの約半数(10~40%)でしか認められていない。
治療:PAの病型分類が重要で、病型により治療法も異なる。
アルドステロン過剰分泌が片側性か両側性かをAVS(adrenal venous sampling)で確認する。
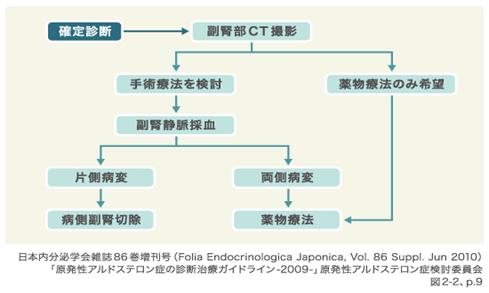
http://www.tuh-endocrine.net/pa.html
片側副腎病変であれば、その摘出を、両側病変では抗アルドステロン剤などによる薬物療法を行う。
局在診断した後、副腎病変を腹腔鏡下内視鏡的に全摘する。微小病変によるPAもあるため、病理検索が重要であり、3β-HSD免疫組織学的検査で確定診断が可能である。
1. 外科的処置:片側病変である副腎腫瘍(腺腫、癌腫)、UAH、UMNの摘出を行う。心血管合併症が重症化した症例や高齢者では、手術の侵襲を考え薬物治療も考慮する。IHAでも片側全的+対側部分切除を行う場合もある。
平均腫瘍系17.0㎜の50例の手術前後の変化で、163mmHgの血圧が133mmHgに低下している。完治した症例は29.5%であり、53%は著明に血圧が改善しているが、残りの18.2%は軽度の改善であった。
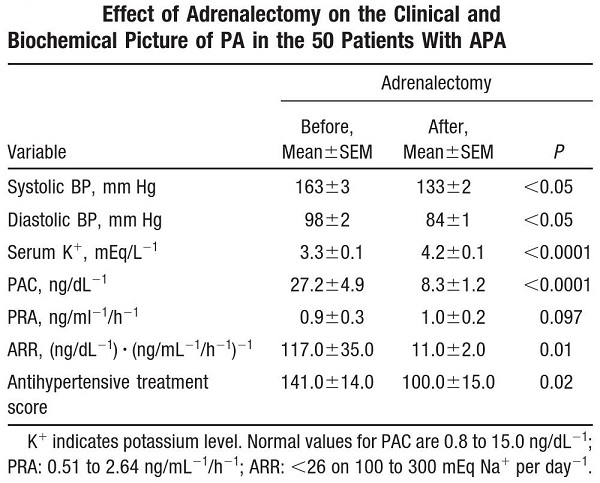
http://hyper.ahajournals.org/content/51/5/1366.full.pdf
2. 薬物治療:両側病変が考えられるIHA、GSHでは薬物治療を行う。Bilateral APAsでは、両側副腎の結節部分のみの部分切除や片側全的+対側部分切除を行う。
IHA、GSHいずれの病型でも抗アルドステロン剤を用いる。
スピロノラクトン(アルダクトンA25㎎)1~8錠 分1~2経口
エピレレノロン(セララ 25㎎)2~4錠 分2経口
3. ラジオ波焼却治療の試み:
20歳以上の症例で、片側の副腎腺腫による原発アルドステロン症であり、CTで腺腫が明瞭に確認でき、CTガイド下での穿刺が可能な位置にあり、腺腫と腎臓や腸管が5㎝以上離れていること、反対側の副腎のホルモン分泌が正常であることがAVSで確認されている人に対して行っているが、ラジオ波で焼却した翌日には血漿アルドステロン値は低下し、血圧も低下する人が多く、今後期待できる治療法である。
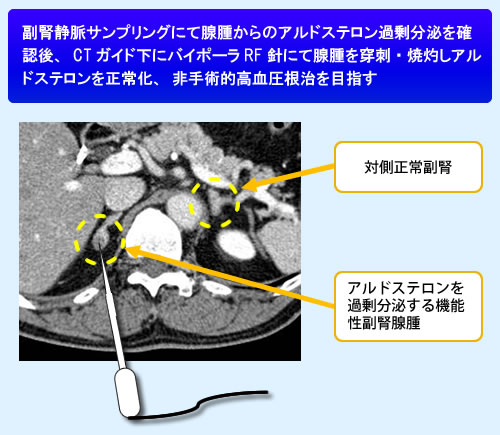
http://www.crieto.hosp.tohoku.ac.jp/seedlist/seed01.html
予後:http://merckmanual.jp/mmpej/sec12/ch153/ch153f.html
腺腫の場合は、外科的切除後に全例血圧が低下し、完全寛解は50~70%に認められる。
副腎過形成では、両側副腎摘除後も70%が高血圧のままとなるので、外科的手術は推奨されない(2005年11月更新記事)。
一般的には、他の高血圧に比較し、脳卒中、心筋梗塞、心房細動、慢性腎臓病などの合併率が高く予後が悪いと考えられている。

http://content.onlinejacc.org/article.aspx?articleid=1136490
参:2015年6月22日聖マリアンナ医科大学横浜市西部病院:代謝・内分泌内科教授 方波見卓行先生の「抗アルドステロン薬による心血管イベント抑制は可能か:自験データから考える」の講演の中で、手術治療後2年以上経過観察されたPA症例と、本態性高血圧症例329例中、治療前にPRAおよびPACが測定されていないものを除外し、測定結果から本態性高血圧である症例を選び出しコントロールとした治療介入後の経過観察中に起こったイベントを比較した結果が下の表になる。
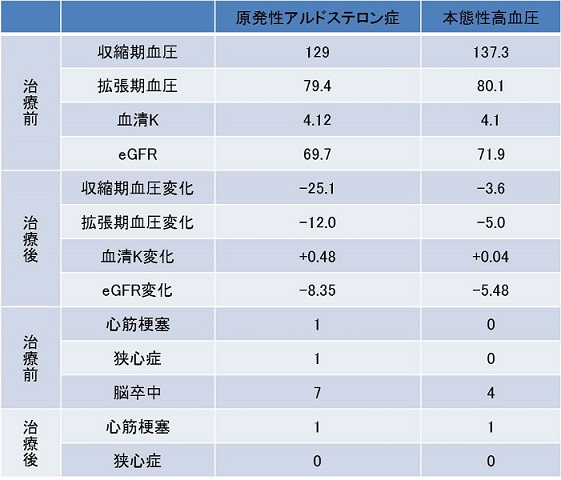
Case-control試験ではないが、血清K低下があまり認められず、腎機能低下軽度のうちにPAを早期発見し、手術療法を含め厳格な血圧コントロールがPAの予後を改善する可能性があることを示された。
症例1:42歳より高血圧がありアムロジピン5㎎内服していた。
最近2年間で4kgの体重増加に伴い血圧上昇し、ARBの併用となった。
155cm 62kg 146/94mmHg 尿:蛋白± pH 5.3、血清K 3.7 Cl 100 Na142である。
ARBを内服していて低K血症。
アニオンギャップ:AG=Na+-Cl–HCO3-=12mEq/L・・・増えると酸が貯まっている状況であり、具合が悪くなる。
本症例のNa+-Cl-=HCO3- (24)+AG(12)=36のはずであるが、計算すると142-100=42・・・本症例は元気であるからAGは12のはず。となるとHCO3-が30となり、代謝性アルカローシスが存在している可能性があり、PAの可能性を強く疑う。
症例2:42歳より高血圧があり治療開始され徐々に薬が増えていった。54歳時に健診の腹部超音波で右副腎に30mmの腫瘤が指摘された。中心性肥満を認めた。
白血球分画でSeg 76% Eosino 1% eGFR 58.2 Na 145 K 4.1 Cl 105 TG 206 TC 255 BS 104 BNP 60.3 ACTH <2 Cortisol 24 Ald 12.8 PRA 0.1 尿:pH 7.5 Ald 60 17OHS 20.2 であり、負荷試験の結果右副腎のクッシング症候群と診断され右副腎部分切除を行ない、血圧の低下を認めたが術後6ヶ月してから血圧が上昇し始め、Captoril testでARRが42から8に低下したため、左副腎からの過剰分泌を疑い手術を行ったところmicroAPAを2か所認めた。
近年このようなCo-morbidities APA and Cushing syndrome症例が認められることが見つかるようになってきた。
東北大学のFujimotoらは2003年から2011年の間に静脈サンプリングを行ってPAと診断された39例のうち5例(12.8%)にSubclinical Cushing Syndromeを、異例にovert Cushing Syndromeを認めたと報告している。
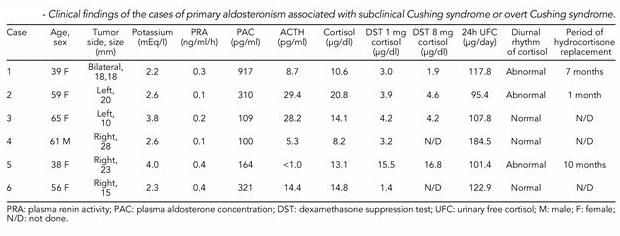
http://www.ncbi.nlm.nih.gov/pubmed/23385627
PAの特徴をまとめてみると
1. 考えられているよりも頻度が高い。
2. 脳、心、腎障害を起こしやすい。
3. CKDを合併しているPAは厄介である。
4. 腫瘍径が小さいものも少なくなく、しばしば5mmほどのものにも出くわす
我々のCKD合併症例213例の検討では、PAの治療後にGFRが悪化することがあり、それは術後一か月以内に認めており一年後の変化はなかった。
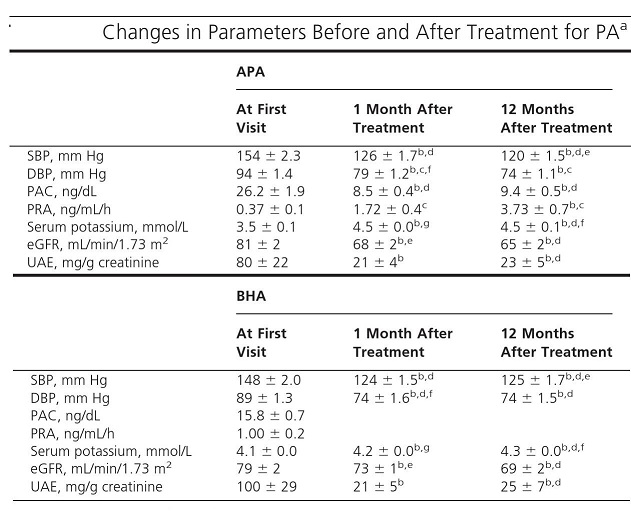
アルブミン尿があり、Hyperfiltrationの状態となっているため、腎障害に気付きにくいことによると考えている。術前のアルブミン尿と低カリウム血症がその独立した予測因子であった。

http://press.endocrine.org/doi/pdf/10.1210/jc.2013-2180
参考文献:
原発性アルドステロン症の診断治療ガイドライン-2009-
原発性アルドステロン症診療の進歩
























