川村所長の勉強会参加記録
2016.03.22
膵β細胞目線で考えたインクレチン薬 吉田昌史先生
2016年3月10日
演題「膵β細胞目線で考えたインクレチン薬の効果的な使用法」
演者: 自治医科大学付属埼玉医療センター 内分泌代謝科 助教 吉田昌史先生
内容及び補足「
今回の吉田先生の講演は、リズムの良いウイットのある講演内容だったのですが、その会話を再現することが困難なので、基礎知識をはじめに記載し、後半に講演の用紙を記載しました。
参:
インスリンの分泌顆粒:電子顕微鏡的研究によると、各β細胞には10,000~13,000この顆粒があり、そのうち約600個が細胞膜にdockしている(Olofssonら、2002)。約1500個は細胞膜内側表面から0.2μm以下のところにあるL-type Ca2+チャンネルの周りに分泌顆粒は集積している(Wiserら、1999)。
http://physiology.jp/wp-content/uploads/2014/01/071010006.pdf
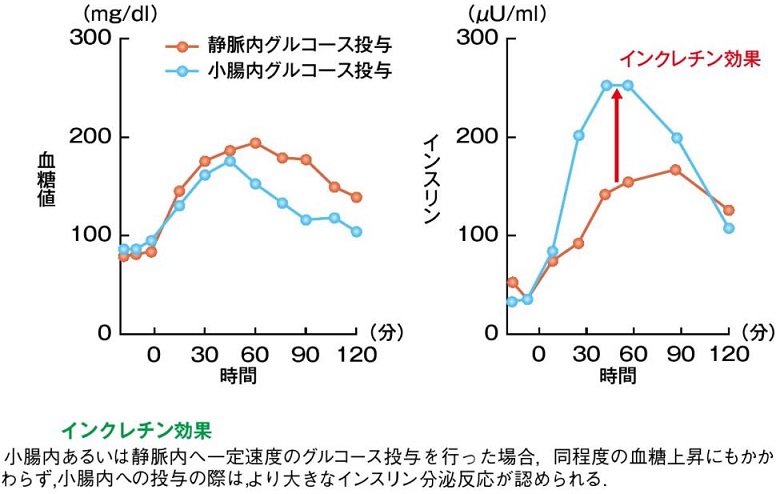
インクレチン:1906年に腸粘膜の抽出物が尿糖を減少させる働きがあることが明らかになり、1932年La Barreによってインクレチンと名付けられた。1962年にグルコースを経口投与した場合に静脈投与に比べてインスリン分泌が促進されることが報告され、その原因因子としてインクレチンが注目された。
http://www.igaku.co.jp/pdf/1108_tonyobyo-4.pdf
糖負荷後の総インスリン分泌の半分以上は、インクレチンによるインスリン促進作用といわれており、食後血糖維持に大きく働いている。(J Clin Endocrinol Metab 1986;63:492-8)
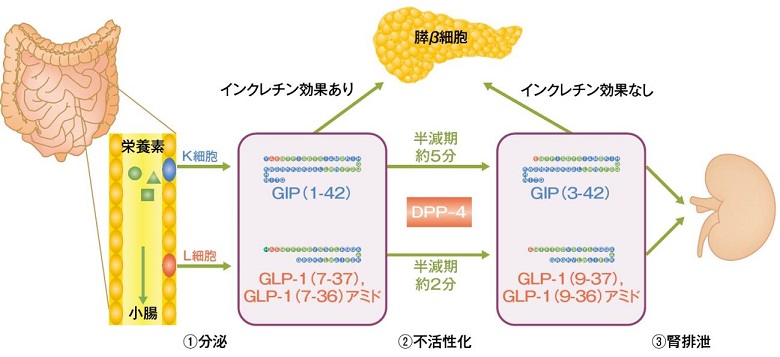
GIP(glucose-dependent insulinotropic polypeptide)は、1971年にBrownによって同定された、豚の腸管から単離された42個のアミノ酸からなる一本鎖のポリペプチドで、胃酸分泌を抑制する作用がありgastric inhibitory polypeptideと名付けられたが、人の胃酸分泌の抑制作用がほとんどなく、グルコース依存性にインスリン分泌を強力に促進することが見いだされ、GIPと呼ばれるようになった。人においては十二指腸、上部小腸に局在するK細胞から活性型GIP(1-42)として分泌され、N末端2残基がDPP-4により切断されて、不活型GIP(3-42)に分解される。この半減期は欧米健常者で約5分とされている。
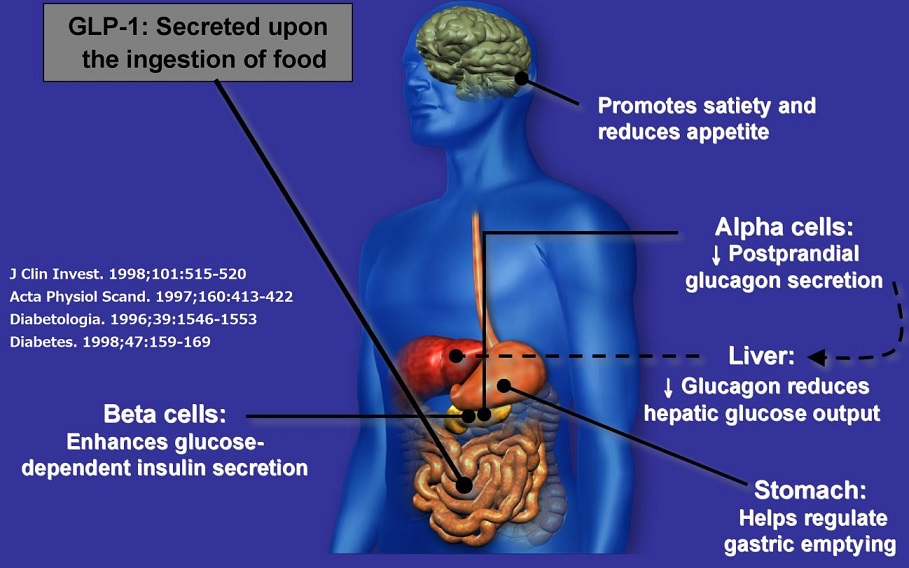
GLP-1(glucagon-like peptide 1)は、1987年にインクレチンであることが証明された。下部小腸に存在するL細胞から分泌され、膵β細胞からのインスリン分泌の促進、グルカゴンの分泌抑制、腸管運動を抑制し、食物の吸収速度を抑え、脳に働き満腹感を惹起する作用が認められているが、DPP-4により約2分で分解され効果を失う。
http://www.igaku.co.jp/pdf/1108_tonyobyo-4.pdf
http://plaza.umin.ac.jp/~y-dm/npo-image/h22kouen%20slide.pdf
GLP-1とGIPの作用を比較すると以下のようになる。

http://medical.nikkeibp.co.jp/all/special/novo/vic/3-1.html
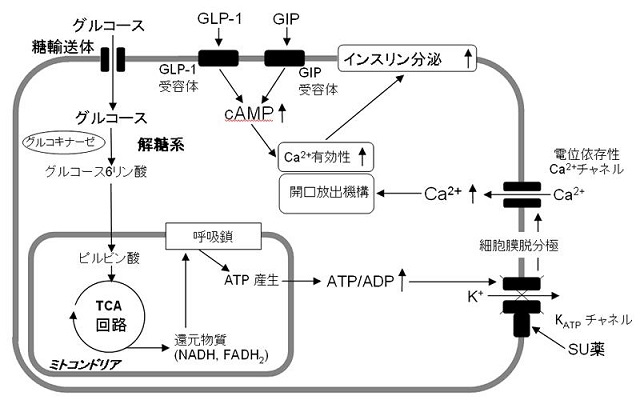
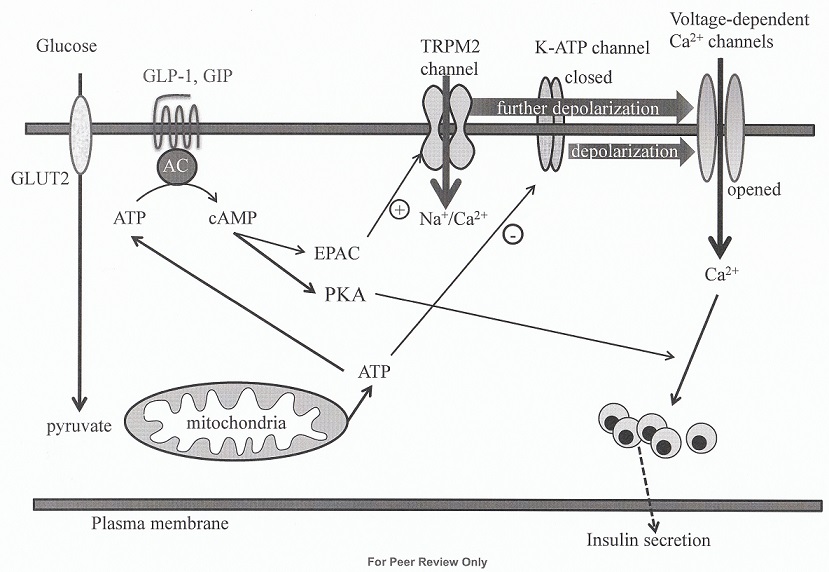
インスリンの分泌機構は、グルコースがβ細胞に取り込まれ、代謝によりATPが産生され、ATP/ADP比が増大し、ATP感受性カリウム(KATP)チャンネルを閉じ、細胞膜の脱分極が生じ、電位依存性カルシウムチャンネル(voltage-dependent calcium channels:VDCC)が開口による細胞内Ca2+濃度の上昇によって、インスリン顆粒の開口放出が起こる(グルコース代謝依存性経路:惹起経路)。
SU薬は、このKATPチャンネルに作用する。
炭水化物や蛋白質、脂質を摂取することでGIPとGLP-1は分泌され、特にGIPはGLP-1に比較し、脂質に対する刺激によりか分泌する。分泌されたGIPとGLP-1は血行性に運ばれ、膵β細胞膜上にあるGIP受容体とGLP-1受容体に結合する。
GIP受容体とGLP-1受容体は7回膜貫通型Gタンパク共役受容体でGs蛋白と共役したアデニル酸シクラーゼ(adenylate cyclase:AC)を活性化し、細胞内cAMP濃度を上昇させる。細胞内のcAMP濃度の上昇はprotein kinase A(PKA)の活性化を介して、細胞内のカルシウムの有効性を高め、グルコース代謝によるインスリン分泌を増強する(増幅経路)。
また、exchange protein activated by cAMP(Epac2)を介した低分子GTP結合蛋白Rap1などの活性化によるインスリン顆粒の開口放出促進も報告されている。
欧州人を対象とした2型糖尿病患者において、インクレチン効果は健常人に対して低下しており、2型糖尿病患者において、経静脈的にインクレチンを投与した報告では、GLP-1投与に対するインスリン分泌反応は認められたが、GIPに対するインスリン分泌促進作用は消失していた。(J Clin Invest. 1993;93:301-7)
膵β細胞でのGIPに対する反応性低下の原因として、GIP受容体発現量の低下が考えられており、高血糖の改善した状態では、膵β細胞のGIPに対するインスリン分泌促進効果が回復していることから、この反応は可逆的なものと考えられている。
http://www.chugaiigaku.jp/upfile/browse/browse1215.pdf
http://terra58.hatenablog.com/entry/2015/03/22/190000
今回の講演の趣旨:
GLP-1の生理的濃度は10~100pMであるのに、これまでのGLP-1関連の研究で使用されているGLP-1濃度は、ほぼすべての研究において10nM以上の生理的濃度が使用されているので、今まで得られた結果の臨床的価値は低いと考えられる。
生理的濃度のGLP-1が、膵β細胞の背景電流の一種であるtransmembrane receptor potential melastatin 2 (Trmp2)チャンネルを直接刺激し、インスリン分泌を増強することを発見した。GLP-1はcAMP-EPAC2を介してTrmp2チャンネルを直接制御し、静止膜電位を脱分極させることで、グルコース感受性を改善していると考えられた。
Trmp2チャンネルは背景電流の一種で、非選択的陽イオンチャンネルで、Na+、K+、Ca2+などが通過することが分かった。
GLP-1作動薬であるexendin-4を生理的濃度である10~100pMで刺激した際に、容量依存性に有意な背景電流の増加を観察した。また、native GLP-1、liraglutideでも同濃度で背景電流は増加した。
これらの変化はTrmp2チャンネルインヒビタ―である2-Aminoethyl diphenylborinate(2-APB)同時投与にて消失し、Trpm2チャネルノックアウトマウスから採取された膵β細胞に手も消失したため、exendin-4刺激により増加する背景電流はTrmp2チャネル電流であると考えられた。
この電流の増加はGLP-1受容体アンタゴニストであるexendin9-39存在下にて消失したため、GLP-1受容体を介した反応であるといえる。
膜透過性cAMPであるdibutyril cAMP投与にても同様にTrmp2電流の有意な増加が観察されたが、protein kinase A(PKA)インヒビタ―であるH89存在下でも同様の結果が得られ、PKAエンハンサーである6-phe-cAMPや6-Bnz-cAMP投与では電流の増加が観察されなかったため、PKAの関与は否定的である。
PKAと同じくcAMPの下流にあるEPAC2エンハンサーである8-pCPTにて同様の有意な電流増加が得られたため、exendin-4によるTrmp2電流の増加は、EPAC2型によると考えられる。
背景電流に対してグルコース濃度が2.8mM(50.4 mg/dL)と16.6mM(298.8 mg/dL)の差を検討したところ、高濃度で背景電流は有意に増加した。低濃度グルコースに13.8 mMスクロースで浸透圧を補正した場合には、背景電流の増加は生じなかったため浸透圧の影響は否定的である。この電流変化は、電子伝達系ブロッカーおよびEPACインヒビタ―により消失したため、糖代謝がEPACを介して背景電流を制御していることが明らかとなった。
これらの変化はTrpm2インヒビタ―(2-APB)同時投与にて消失し、Trmp2ノックアウトマウスから採取された膵β細胞にても消失したため、Trmp電流であると考えられる。
Exendin-4刺激によるTrmp2電流変化はグルコース濃度依存性であるが、EPAC2アクティベータ(8-pCPT-AM)投与では、Trpm2は2.8mMグルコース中においても最大反応を示した。
これらの結果より、グルコース代謝およびGLP-1は、両者ともEPAC2を介して膵β細胞Trpm2電流を増加させ、インスリン分泌を促進することが示された。
グルコース代謝は、K-ATP(外向き電流)を減少させるだけでなく、EPAC2を介してTrpm2電流(内向電流)を増加させることでインスリン分泌を促進し、GLP-1はそのTrpm2経路を増強する。
https://kaken.nii.ac.jp/pdf/2013/seika/CFZ19_11/32202/24890219seika.pdf
インクレチン効果は、インスリン分泌促進増強ではなく、血糖上昇時のインスリン分泌反応を良くしているといえる。インクレチンの最大効果は、空腹時血糖値を低下させるときではなく、食後血糖値の上昇を下げるときに見られる。その効果は、血糖値が100前後の時が強いといえる。
http://diabetes.diabetesjournals.org/content/63/10/3394
参:
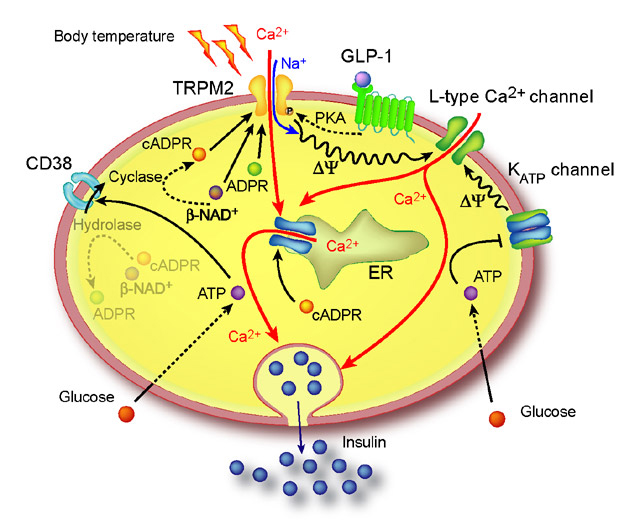
Trpm2チャンネル:Trpm2チャンネルは膵臓β細胞に強く発現しているcADP-riboseが室温ではTrpm2受容体を活性化しないが、体温近傍の温度ではTrpm2受容体と結合して活性化する温度受容体であることが分かった。
http://www.nips.ac.jp/biomol/Res_TRPM2.html
























