川村所長の勉強会参加記録
2016.08.18
抗動脈硬化粒子としてのHDL 角田史敬先生
2016年7月30日
演題「抗動脈硬化粒子としてのHDL~これまでとこれから~」
演者: 昭和大学医学部内科学講座 循環器内科学部門講師 角田史敬先生
場所:ホテルプラム
内容及び補足「
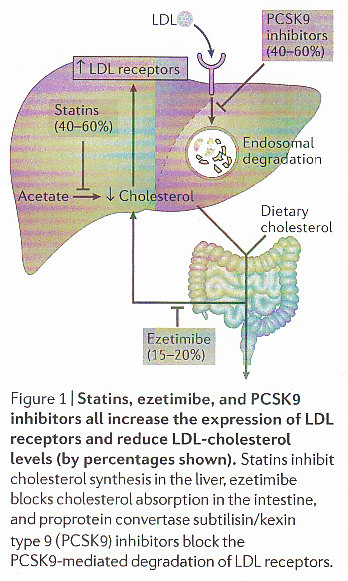
LDLコレステロールはスタチンで40-60%低下できEzetimibeで15-20%低下できる。近年開発されたPCSK9阻害薬でも40-60%低下できる。
HDLコレステロールと冠動脈疾患のイベントの頻度や死亡は逆相関関係にあり、HDLコレステロールが高いほど低いという結果は多数ある。
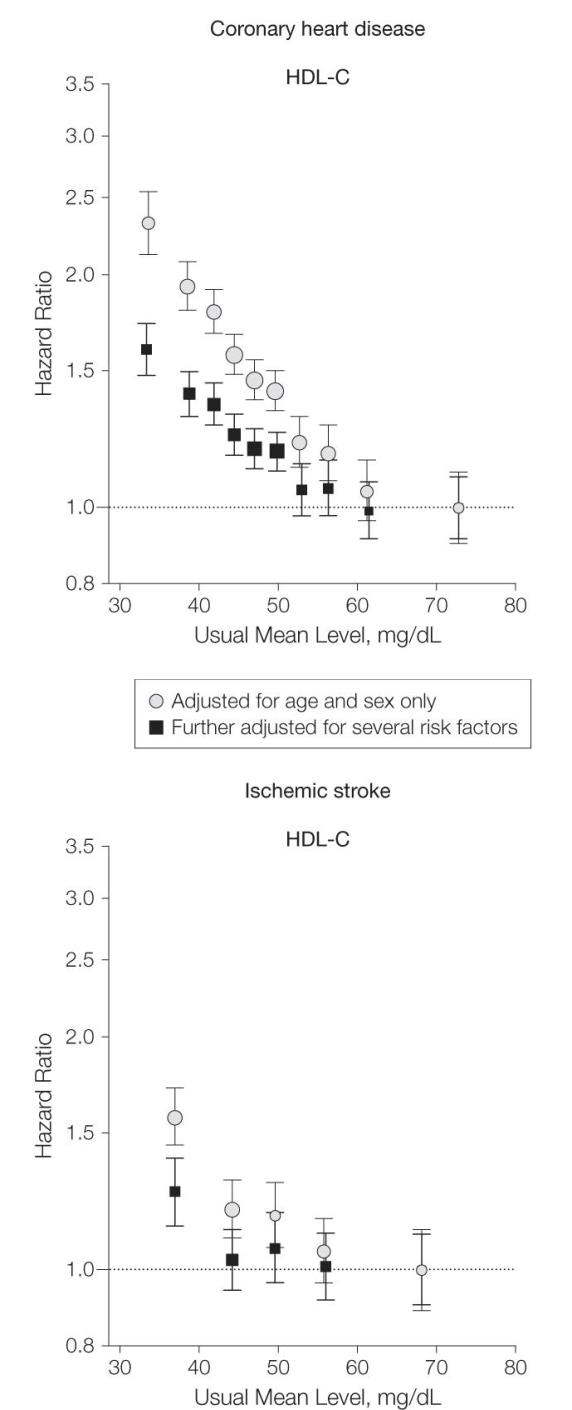
JAMA. 2009;302(18):1993-2000
それでは、薬物治療によりHDLコレステロールを高くすることにより心筋梗塞などの心血管イベント及び死亡リスクが低減するのであろうか?
HDLコレステロールを上げる方法の一つとしてCETP(Cholesteryl ester transfer protein)の阻害がある。 CETP阻害薬の一つであるTorcetrapibを15067名の高リスク患者にatrovastatn単独投与群7534名とTorcetrapib併用群7533名の二群間で主要心血管イベントが減少するかどうかを検討した。
12か月投与時点でTorcetrapib投与群はHDL-Cが72.1%上昇し、HDL-Cが24.9%低下、SBPは5.4mmHg上昇し、血清K低下、Na上昇、重炭酸塩およびアルドステロンが上昇した。心血管イベントのHazard Ratioは1.25、全死亡のHazard Ratioは1.58と上昇し、試験が中止となった。
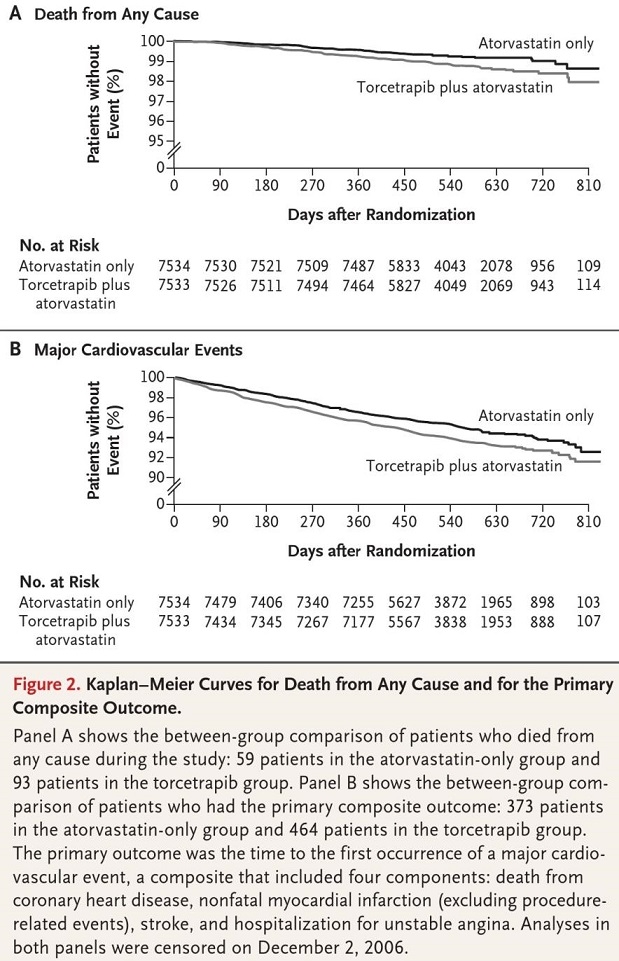
http://www.nejm.org/doi/full/10.1056/NEJMoa0706628#t=article
Genestらは急性冠動脈症候群(ACS)の発症72時間以内と12週間後の安定冠動脈性心疾患(CAD)、非CAD患者の計52例のHDL-C濃度及びHDLのコレステロール引き抜き能を比較した。HDL-C濃度には差を認めなかったが、コレステロール引き抜き能は非CAD患者に比し、ACS、安定CADで有意に低値であった。
これらの結果、HDL-CよりはHDLのコレステロール引き抜き能がACDに関連していることが示唆される。
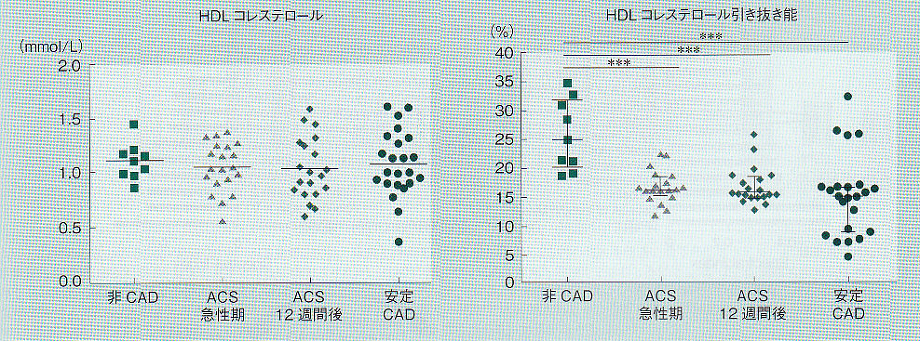
Am J Cardiol 113(2):249-255, 2014
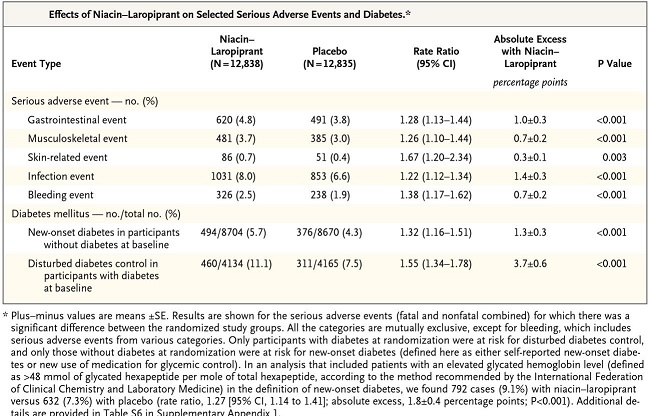
HDLを上昇させる薬としてニコチン酸があるが、Simvastatin40㎎にニコチン酸の除法製剤Niacin/Laropiprantを併用投与した群とプラセボを併用した群での比較試験がある。
LDL-Cは10mg/dL低下し、HDL-Cは6mg/dL増加したが、心血管系ベントの抑制効果はないことが示された。
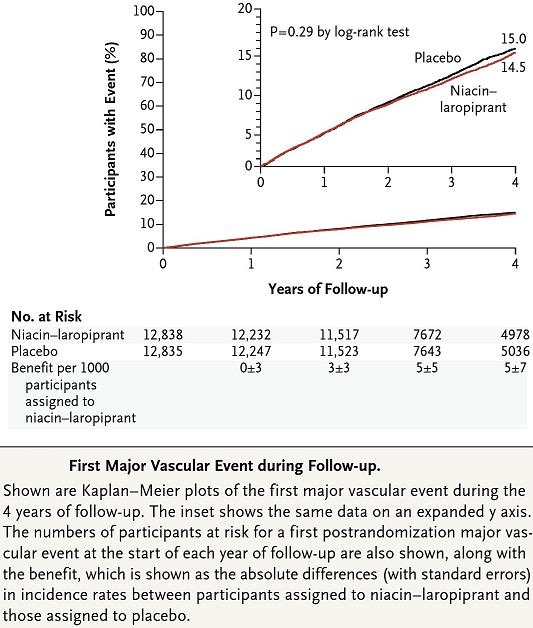
その上、種々の副作用が増加し、とりわけ糖尿病の新規発症や血糖コントロールの悪化を認める結果となった。その結果、薬剤としての発売が中止となった。
http://www.nejm.org/doi/full/10.1056/NEJMoa1300955#t=article
今までのHDL-Cを上昇させる薬の開発はいずれも失敗に終わっている。
http://www.nature.com/nrd/journal/v13/n6/abs/nrd4279.html
https://www.researchgate.net/publication/262578663_HDL-targeted_therapies_Progress_failures_and_future
HDL-Cに関連したsingle nucleotide polymorhpisms(SNPs)の異常との関連はいくつも報告がある。
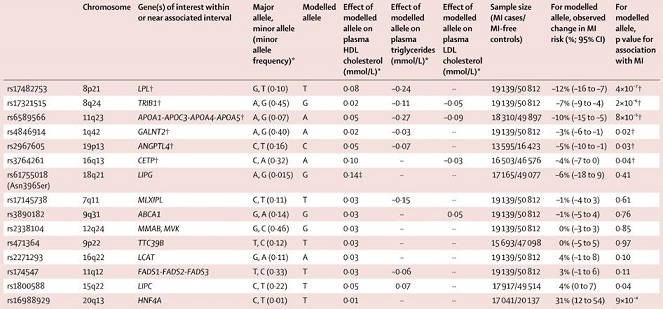
6つのコホート試験の結果からはHDL-C濃度に関連する遺伝の異常が心血管イベントに影響するというエビデンスは見つからなかった。
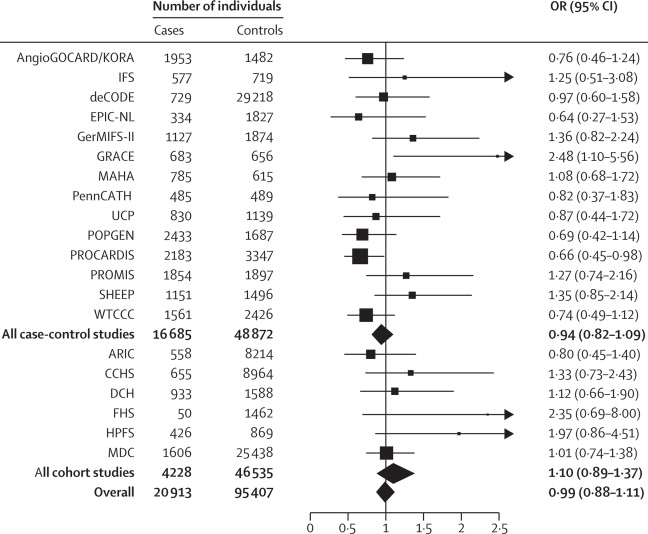
http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(12)60312-2/fulltext
HDLのこれから
HDLは小腸や肝臓で脂質をほとんどつくらないApo A1として分泌され、この脂質成分が少ないLipid-poor apo A-1(pre-βapoA-1)を新生HDLといい、コレステロールを大量に含んだマクロファージからコレステロールトランスポーターABCA1を介してコレステロールを受け取り、原始HDL(nascent HDL)となる。そして、別のコレステロールトランスポーターであるABCG1を介してさらにコレステロールを受け取る。受け取ったコレステロールはLCATによりエステル化され成熟HDL(mature HDL)になる。成熟HDLは肝臓のすか便ジャー受容体SR-BIを介して肝臓に取り込まれ、胆汁中に排出される。『コレステロール逆転送系』。
また、成熟HDLはコレステロールエステル輸送蛋白質(CETP)によりLDLにコレステロールエステルを輸送し、LDLからトリグリセリドを受け取り、TGリッチHDLとなる。TGリッチHDLは肝臓のLDL受容体により、肝臓に取り込まれるか、肝臓のリポ蛋白リパーゼにより、トリグリセリドが分解され遊離脂肪酸を分泌し、原始HDLとして再生される。
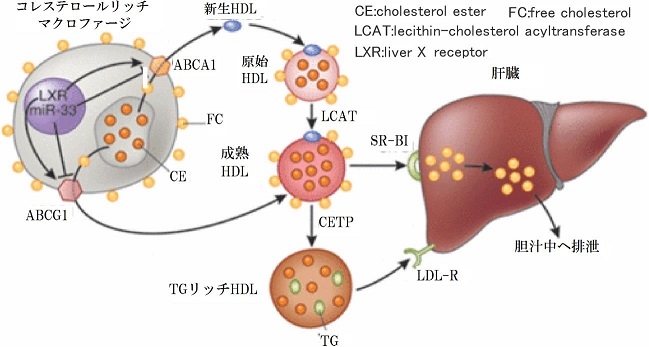
これらの変化を見ると、HDLは大きく分けて新生HDL、原始HDL(HD L 3)、成熟HDL(HDL2)、TGリッチHDLの四種類に分けることができるが、測定ではすべて一緒くたになっている。
コレステロールエステルの移動を考えると新生HDLや原始HDLは引き抜く方向であるが、成熟HDLやTGリッチHDLはコレステロールエステルを引き抜く粒子ではないので抗動脈硬化的に働いているとは言えない。上述したCETP阻害薬やナイアシンは後者のHDL濃度を増加させているので、心血管イベントの減少に寄与しなかったものと考えられる。
http://www.tmd.ac.jp/mri/cph/members/PDF/nikkei_HDL2.pdf
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4918468/
これらの研究結果はHDLコレステロール高値が抗動脈硬化作用を示しているのではないということを示唆している。
抗動脈硬化作用は、動脈硬化層からコレステロールを引き抜く力によるのではないかと考えられるようになった。
263名のマクロファージからのコレステロール引き抜き能を検討したところ、小型のHDLが多いほど、コレステロール引き抜く力が強かった。
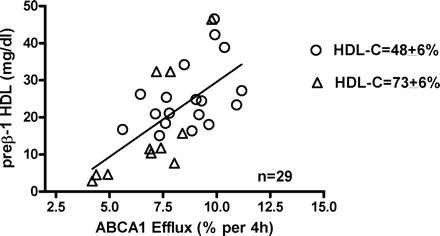
Correlation of ABCA1 efflux to the concentration of preβ-1 HDL in serum with similar high or low HDL-C. ABCA1 efflux from cAMP J774 cells was the probucol-sensitive efflux measured after 4-hour incubation with 2.8% apoB-depleted serum from specimens with similar HDL-C (HDL-C ±6%) at either the 25th percentile (open circles, HDL-C of 48; range, 45-51; n=22) or the 75th percentile (open triangles, HDL-C of 73; range, 69-77; n=18). The specific contribution of ABCA1 to cholesterol efflux from cAMP-treated J774 macrophages was significantly associated with the serum level of preβ-1 HDL (r2=0.425; P=0.0002; n=29) measured by 2-dimensional gels. All procedures performed as in Methods.
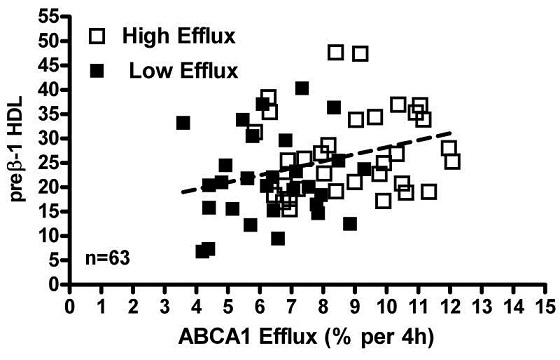
ABCA1 efflux was measured as in above figure using apoB-depleted serum form male and female donors. Levels of preβ-1 HDL in all these specimens (n=63) were measured using a commercial ELISA (see methods) and are reported as ng/ml/aliquot assayed. These values were significantly correlated to ABCA1-mediated efflux (r2=0.102, p=0.011, n=63). Open squares= specimens with high efflux. Closed squares=specimens with low efflux.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2866499/
コレステロール引き抜き能が良いと冠動脈疾患の危険度が低下する
頸動脈内膜中膜肥厚の評価を受けた健康ボランティア203例、血管造影で冠動脈疾患が確認された442例、確認されなかった351例のコホートにおいてコレステロール引き抜き能を評価した研究では、糖尿病と高血圧がリスクを向上させる危険因子であり、HDL-Cがリスク低下因子である結果となり、コレステロール引き抜き能はHDL–Cとは独立したより強いリスク低下因子であるという結果であった。
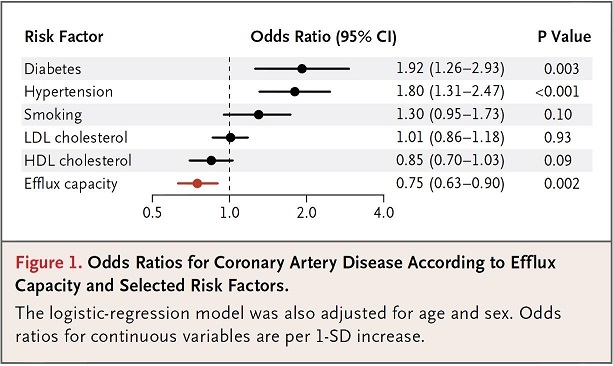
NEJM364(2):127-135, 2011
心血管系疾患のない2924例を対象に、HDL-C値、コレステロール引き抜き能を9.4年間経過観察した研究では、HDL-Cのベースラインの値は心血管イベントとの相関は乏しくハザード比は1.08で有意差は認めなかった。様々な危険因子を補正してコレステロール引き抜き能を4分画に分けて検討すると、引き抜き能が最も高い分画では低い分画に比べリスクは67%低下し、ハザード比は0.33であった。
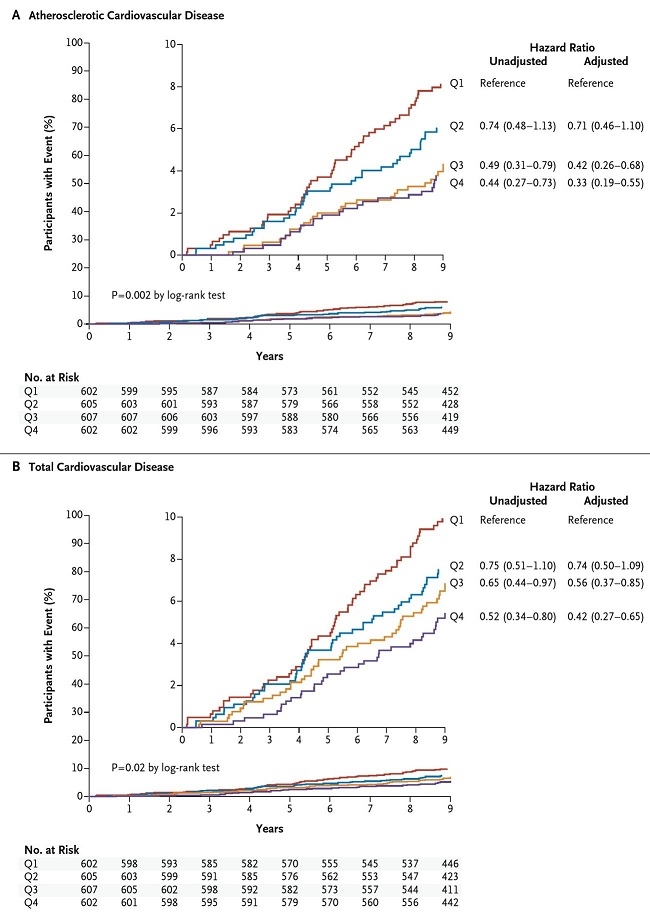
N Engle J Med. 371:2383-2393, 2014
心臓リハビリテーションとHDL機能
自分たちの臨床研究の結果であるが、急性冠症候群で入院した患者68名(男性57名、女性11名)に対して心臓リハビリテーション(Cardiac rehabilitation’s)を行った群と行わなかった群で比較した際、HDL-C濃度とHDLのコレステロール引き抜き能が有意に上昇していた。
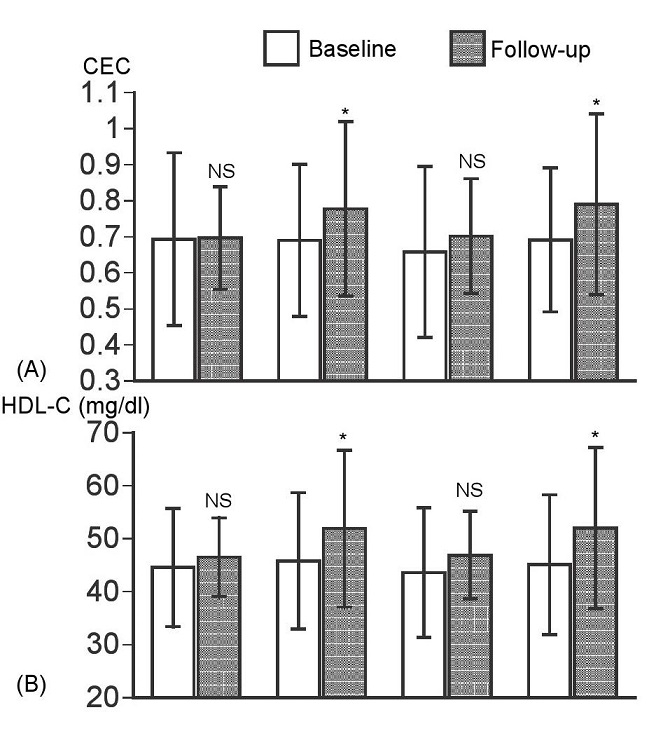
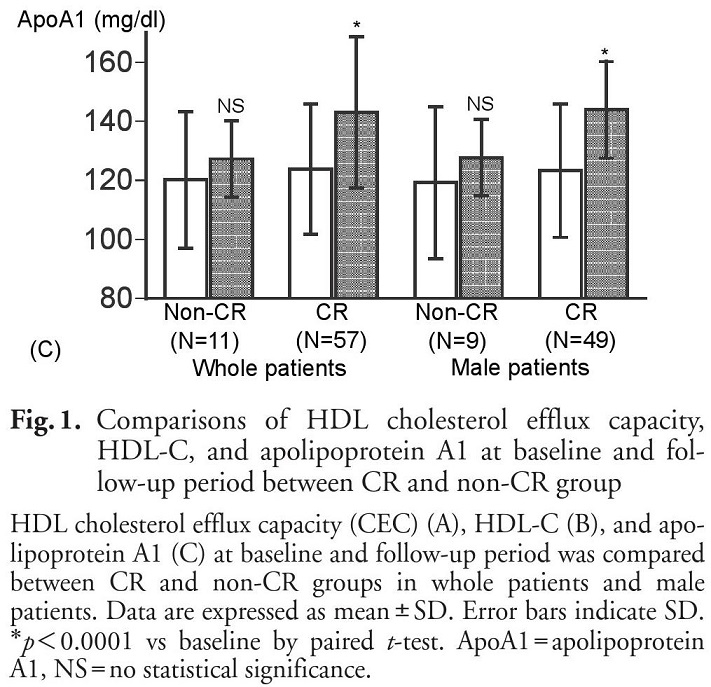
https://www.jstage.jst.go.jp/article/jat/23/7/23_34454/_pdf
a=Framingham Offspring Study:FOSとb=Coronary Heart Disease:CHD患者169名のHDLを二次元電気泳動法で比較してみた研究では、小型のHDL分画は両者と身に同じ程度の濃度で認めた。
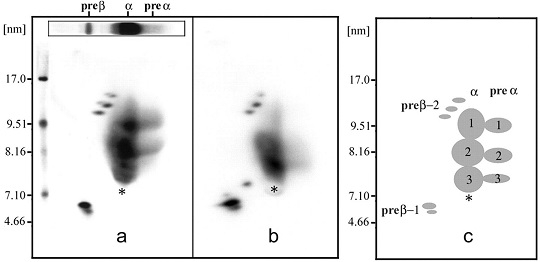
A, Apo-I-containing HDL subpopulations of a representative FOS male control subject (HDL cholesterol=45.7 mg/ld., α-1=17.3 mg/LD.). The insert rectangle represents agarose electrophoresis in the first dimension, which separates HDL by charge into preβ-, α-, and preα-mobility subclasses. A duplicate of the agarose strip was transferred to the top of a no denaturing 3% to 35% gradient polyacrylamide gel, and HDL was separated by size in the second dimension, followed by electro transfer to nitrocellulose membranes. Membranes were then incubated with monospecific anti-human Apia-I first and 125I-labeled second antibodies. Signals were quantitatively evaluated in a phosphor-imager. 125I-labeled Pharmacia high-molecular-weight standard proteins can be seen at the left side of the picture. The asterisk represents the endogenous human serum albumin, which marks the α-mobility front. B, Distribution of the Apia-I-containing HDL subpopulations of a representative CHD patient (HDL cholesterol=34.3 mg/ld., α-1=7.4 mg/LD.). C, Schematic representation of the Apia-I-containing HDL particles.
http://atvb.ahajournals.org/content/24/11/2181.full
HDL粒子の亜分画が大事なのではなく、HDLの代謝が重要ではないかと考え、現在研究を継続している。
参:
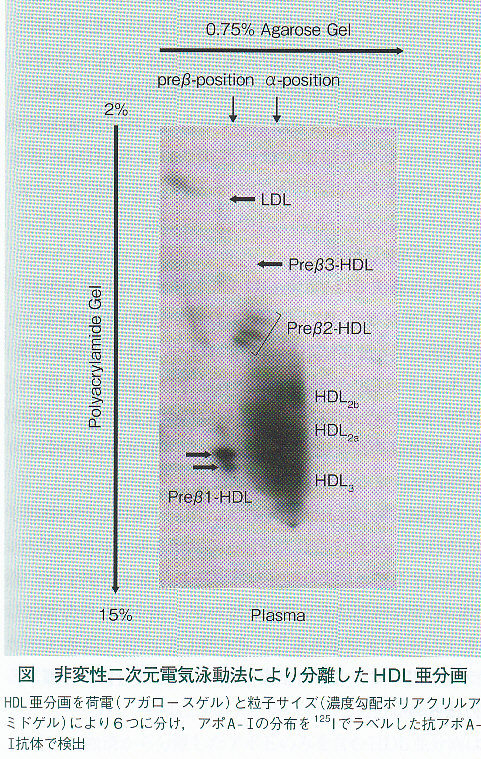
HDLの電気泳動法
アガロースゲル電気泳動法では、HDLはα位に単一のバンドとして泳動される。CETP欠損症や胆汁うっ滞型肝障害などでは、α位より少し減点寄りにslowα-HDLが検出される。アガロースゲル電気泳動と非変性濃度勾配ポリアクリルアミドゲルを組み合わせた二次元電気泳動法は、ゲル内に分離された粒子をニトロセルロース膜等に転写し、ウエスタンブロットにより特定の蛋白の濃度としてHDL亜分画を定量できる。HDLは、粒子サイズだけでなく電荷によっても分離されるため、より詳細なHDL亜分画の解析が可能である。
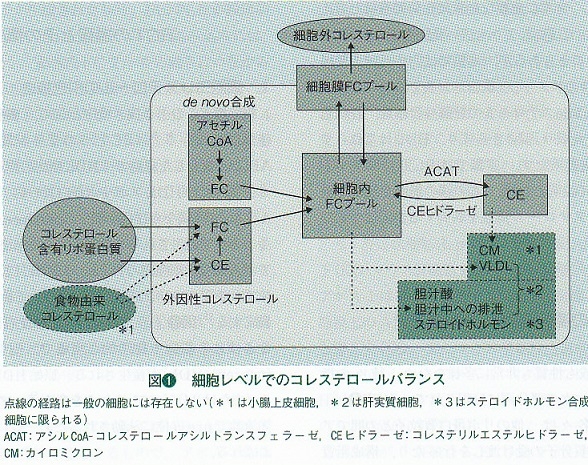
細胞でのコレステロールの移動
コレステロールは全ての細胞の必須構成成分であり、その上ステロイドホルモンや胆汁酸の前駆体としても重要な脂質である。
細胞は、自分の細胞内でde novo合成したり、血中リポ蛋白質から取り込んでコレステロールを得ているが、遊離コレステロール(FC)の過剰な蓄積は膜の不安定化を招き危険であるため、細胞コレステロール量や分布は厳密にコントロールされる必要がある。しかし、コレステロールは脂肪酸やほかの脂質と異なりエネルギー源として使用されることはなく、肝臓や一部のステロイド合成器官以外には、コレステロールを排泄したり代謝したりする経路はない。
コレステロール代謝経路がない細胞においては、FCレベルを下げる機序は、『流入制限』、『隔離』、『放出』の三通りとなる。
『流入制限』としては、de novo合成に関する酵素やLDL受容体の発現抑制で行われるもので、転写制御因子SREBP-2の働きによっている。変性LDLを取り込むスカベンジャー受容体の発現は、SREBP-2により制御されていないので、変性LDLの流入制限はできない。
『隔離』はFCを細胞内で安定して蓄積可能なコレステリルエステル(CE)に変換するもので、アシルCoA‐コレステロールアシルトランスフェラーゼ(ACAT)により触媒されるが、細胞内のコレステロール総量は変化しない。
『放出』は脂肪内コレステロール量の減少をもたらすが、マクロファージを含むほとんどの末梢細胞では、HDL新生または拡散による細胞膜FCの細胞外への移動に限られている。
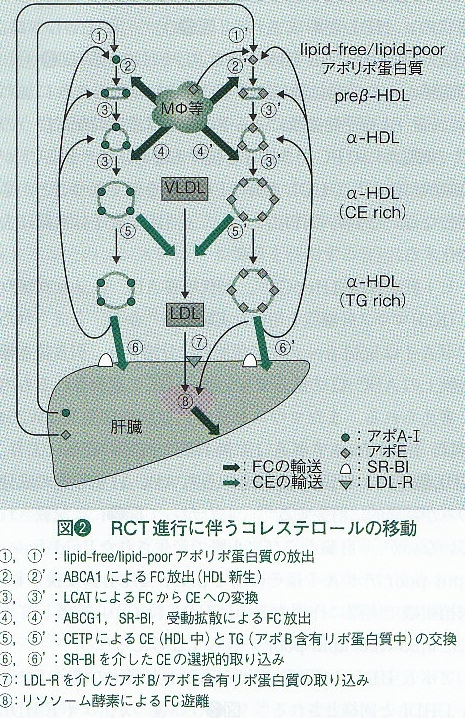
コレステロール逆転送
コレステロール逆転送(reverse cholesterol transport:RCT)は「末梢細胞で過剰となったコレステロールが胆汁中への排泄のために肝臓へ輸送される過程」を示す用語としてGlomsetにより提唱された言葉であり、非常に重要な動脈硬化防御機構と考えられている。
場合によってはより広い範囲の機序を含めてRCTと表現されることがある。
RCTは①細胞コレステロールの引き抜き、②引き抜かれたコレステロールの肝臓への輸送、③肝細胞へのコレステロールの取り込みからなり、これらのすべての過程にHDL粒子が関与している。
HDLの亜分画
HDLは組成や性質が多彩であり、種々の指標に基づいて幾つかの亜分画に分類されている。
形状での分類:分析方法=電子顕微鏡 円盤状HDL、球状HDL
比重での分類:分析方法=超遠心分離 HDL2(1.063~1.125g/mL)、HDL3(1.125~1.210g/dL)
表面電荷:分析方法=アガロースゲル電気泳動法 α‐HDL(球状のアポA1含有HDL、アポA1/A2含有HDL)、preβ‐HDL(円盤状HDL)、γ‐HDL(球状のアポE含有HDL *HDL粒子になっていないlipid-free/lipid-poorのアポA1やアポA2もpreβ位に泳動される
アポリポ蛋白質組成:分析方法=アポリポ蛋白質分析(免疫比濁法等) アポA1含有HDL、アポA1/A2含有HDL、アポE含有HDLなど
細胞膜FCの引き抜き機序
細胞膜FCの引き抜き機序は、以下の四つが確認されている。
1 ABCA1経路:特異的で一方向性でlipid-free/lipid-poorアポリポ蛋白質へ受け渡し
2 ABCG1経路:大型α‐HDLへの受け渡し
3 SR-BI経路:特異的で双方向性でα-HDLへ受け渡し
4 受動的拡散経路:非特異的で双方向性で様々なリポ蛋白質へ受け渡し
この中でABCA1を介する経路がRCTの最大のものであり、HDL産生の律速段階でもある。
生体内でのHDLアポリポ蛋白質の約70%を占めるアポA-1は、肝臓と小腸でlipid-free/lipid-poorアポA-1の形で産生される(下図 1)。このlipid-free/lipid-poorアポA-1は、細胞膜のFCとリン脂質(PL:主要成分はフォスファチジルコリン:PC)を引き抜いて新たなHDL粒子を形成する(下図 2)。この現象はHDL新生(HDL generation)と呼ばれ、円盤状の原始HDL(nascent HDL)が産生される。原始HDL粒子は1個当たりに2~3分子のアポA-1を含み、アガロースゲル電気泳動でpreβ位に泳動されるため、preβ-HDLと呼ばれる。preβ-HDL粒子一個当たりapoA-1分子を2、3、4個含むものが同時に産生されるという報告もあり、HDLの多様性は原始HDL生成時から存在している。
ABCA1は、バクテリアからヒトまで広く分布するATP-binding cassette(ABC)蛋白質の1つである。ABC蛋白質は種を超えて保存性の高いATP結合領域と持ち、ATPの結合または加水分解でその機能が制御されている。
ABCA1を介したHDL新生反応にもATPが必要で、これが一方向性の脂質放出の駆動力と考えられている。
その機序は、アポA-1がABCA1に直接結合して細胞脂質を直接輸送し、アポA-1結合に向けたABCA1構造変化のためにATPを消費しているのか、アポA-1がABCA1近傍の細胞膜上の特定なドメインに結合してそこから脂質を取り込むとするもので、ABCA1が細胞膜の構造を変化させてこのドメインを形成するためにATPが消費しているのかまだ議論が分かれている。
Preβ-HDLのFCとPCは、レシチン-コレステロール アシルトランスフェラーゼ(lecithin-cholesterol acyltransferase:LCAT)の作用でCEとリゾPCになる。
リゾPCは水溶性のためHDLから遊離し、疎水性の高いCEはHDL中心部分に組み込まれ、CEをコアに持つ球状のα-HDLが形成される(下図 3)。
α-HDLへは、ABCG1ならびにSR-BIがFCとPLを付加する(下図 4)。細胞膜からの受動拡散によるFCやPL移動もこれに加わる。
SR-BIや受動拡散によるFC輸送は濃度勾配に従うので、細胞からのFC引き抜きを続けるためには、LCATが持続的に作用してHDL表面のFC濃度を低く保つことが必要になる。
これらの作用が持続することにより、α-HDL粒子は次第に大型化してくる。
合成されたアポA-1はlipid-freeの形で細胞外に分泌され、引き続き細胞膜上のABCA1の働きでpreβ-HDLに変換されると考えられている。
マウス単球性白血病株細胞RAW264では、lipid-freeアポA-1に特異的な抗体の投与により、HDL粒子によるFC引き抜きのうちABCA1依存性の成分のみが特異的に消失する。したがって、肝臓並びに小腸で産生されたlipid-free/lipid-poorアポA-1はその場でpreβ-HDLに変換され、末梢組織で実際に作用するのは、HDL粒子から遊離して生じたlipid-free/lipid-poorアポA-1と考えられる。
アポE-HDLの細胞脂質取り込みや大型化の機序は、アポA-1-HDLと同様(下図①′‐④′)と考えられるが、アポE-HDLは特にマクロファージの細胞FC搬出への関与が大きいと考えられている。
マクロファージにはABCA1、ABCG1に加えてアポEも発現しているが、これらの遺伝子は全てLXR(Liver X receptor)で制御されているので、細胞内コレステロール蓄積時にLXRを介した転写活性化が生じると、産生されたlipid-free/lipid-poorアポEはマクロファージ自身の細胞脂質とともにアポE-HDLを形成することにある。アポEはコア部分に大量のCEを保持した大型のα-HDL粒子を形成できるので、大型α-HDL粒子はABCG1を介したFC放出を受けやすく、効率の良い脂質搬出が可能である。
肝臓への輸送と取り込み
α-HDL上のコレステロール分子は、HDL粒子として運搬されるほかに、CETPを持つ動物では、HDLのCEをアポB含有リポ蛋白に転送し、このアポB含有リポ蛋白質が肝臓へと運搬する経路もある。
CE含量の多くなったα-HDLはCETPのさようによりVLDL、IDL、LDLなどのアポB含有リポ蛋白質との間でCEとTGの交換を行う(下図 5、 5′)。CEとTGはともに疎水性が高いので、移動先でもリポ蛋白質の中心部分に組み込まれる。
TGを受け取ったα-HDLは、肝性リパーゼや血管内皮由来リパーゼにより、粒子内にあるTGやPLが加水分解され、粒子サイズの縮小やpreβ-HDL放出などのリモデリングを受ける。
肝臓やステロイドホルモン合成臓器などで発現の高いSR-BIは、FC放出のみでなく、HDLからのコレステロール取り込みにも関与している。SR-BIに結合したα-HDLの成分のうちCEのみが細胞内へ入り、アポリポ蛋白質の取り込みや分解の生じない選択的なCE取り込みが行われる(下図 6、 6′)。細胞外に残った成分は、小型α-HDLになったり、lipid-free/lipid-poorアポA-1やpreβ-HDLを放出したりするので、アポA-1は再度細胞FC搬出に利用される。そのほかにHDL粒子全体が取り込まれる経路も提唱されている。
一方、CEを受け取ったアポB含有リポ蛋白質は主にLDL-Rを介して細胞に取り込まれるが、LDL-Rのほとんどは肝臓に分布するため、細胞由来コレステロールは、アポB含有リポ蛋白質を介して肝臓へ運ばれることになる(下図 7)。アポEはLDL-Rのリガンドでもあるので、アポE-HDLのコレステロールはこの経路によっても肝臓に取り込まれる。LDL-Rを介した経路ではリポ蛋白質粒子全体がエンドサイトーシスで細胞内に入り、リソソームで分解される(下図 8)。
HDLの多面的機能とその異常に関する最近の知見
HDLの機能として以下のことが挙げられている。
1. 細胞内コレステロールの引き抜き作用
2. 抗炎症作用
3. 抗酸化作用
4. 抗血栓作用
5. 内皮傷害改善作用
6. 抗感染作用
7. 血管拡張作用
8. 抗アポトーシス作用
9. 抗糖尿病作用
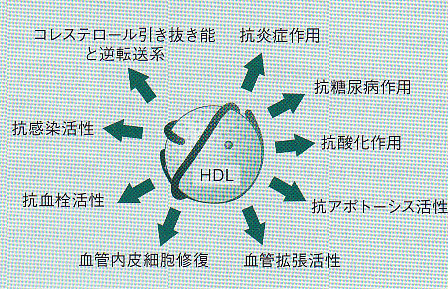
J Atheroscler Thromb 17(5):436-451, 2010
Ansellらはfunctional HDLからdysfunctional HDLが生じる種々の病態を提示し、様々な疾患、病態、食事内容などにより、本来HDLいる抗動脈硬化作用が逆に動脈硬化を促進させる可能性があることを示したがもっている抗動脈硬化作用が逆に動脈硬化を促進させる可能性があることを示した。CHD患者、糖尿病患者、CKD患者などである。また、手術、インフルエンザウイルス感染、慢性関節リウマチなどの膠原病、高ホモシスチン血症などでもHDLの様々な機能低下が指摘されている。
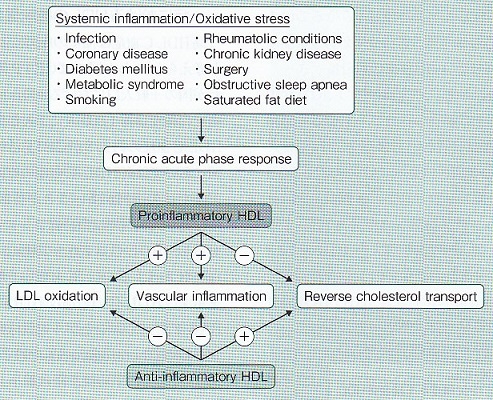
Curr Opin Lipidol 18(4):427-434, 2007
Benjaminらは脂質低下薬未使用のCADまたは同リスクの患者32名、高HDL-C血症のCAD患者20例と年齢・性別の一致した健康人のHDLを沈殿法により抽出し、単球走化活性、過酸化脂質を測定し、CAD患者で抗炎症、抗酸化能が低下していることを示した。
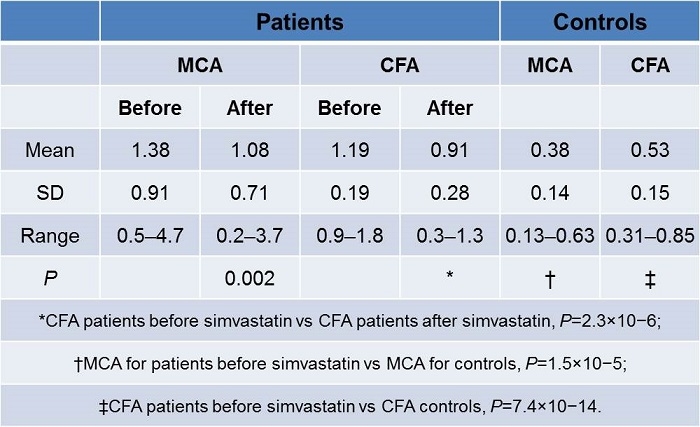
monocyte chemotactic activity (MCA) cell-free assay (CFA)
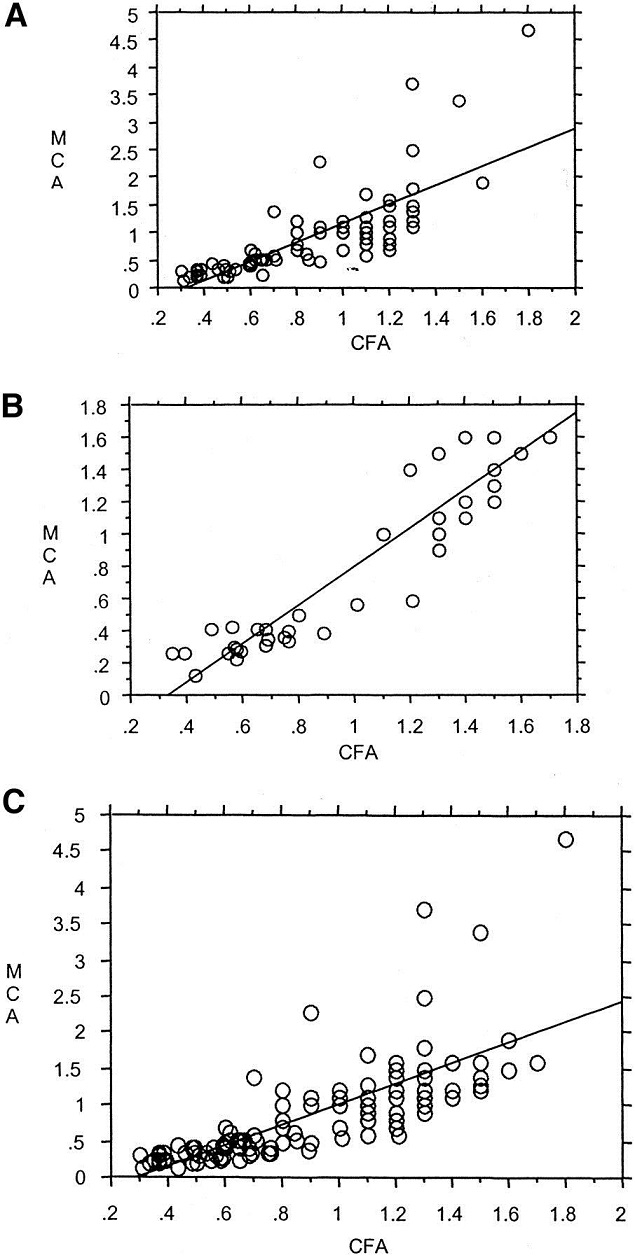
Correlation between values for inflammatory/antiinflammatory properties of HDL as determined by MCA assay vs those obtained using CFA. A, Group 1 patients before and after simvastatin therapy and their age- and sex-matched healthy controls. B, Group 2 patients with documented CHD and high HDL cholesterol levels and their age- and sex-matched healthy controls. C, All patients and controls, ie, combination of data from A and B.
http://circ.ahajournals.org/content/108/22/2751
Christianらは40~70歳の安定CAD(sCAD)患者25名、ACS患者25名、年齢と性別を一致させた健康人25名のHDLを超遠心法で分離抽出し、HDLのNO産生、抗炎症、抗酸化作用を検討した。
健康人のHDLはヒト大動脈血管内皮細胞(HAECs)のNO産生能を濃度依存性に増加させたが、sCADのHDLでは認めず、ACSのHDLではむしろ低下していた。
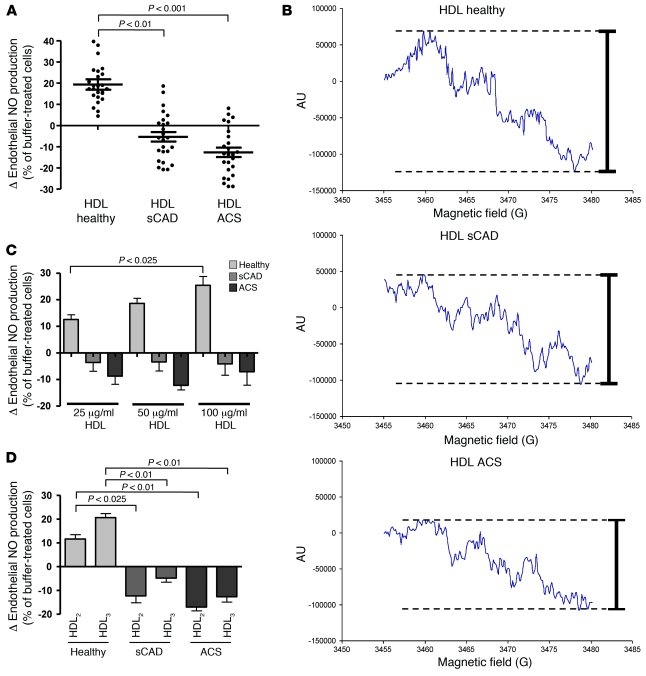
Effects of HDL from healthy subjects, patients with sCAD or ACS on endothelial cell NO production, as determined by ESR spectroscopy analysis.
(A)HDL from healthy subjects and patients with sCAD or ACS was isolated by sequential ultracentrifugation, and the effects of HDL (50 μg/ml) on endothelial cell NO production were analyzed by ESR spectroscopy analysis (n = 25 per group). Data are expressed as percent change versus buffer-treated cells; data points for each study participant are shown. (B) Representative ESR spectra of the NO-Fe(DETC)2 signal in endothelial cells treated with HDL from healthy subjects and patients with sCAD or ACS. (C) Increasing physiological concentrations of HDL (25, 50, and 100 μg/ml) from healthy subjects stimulated endothelial NO production that was not observed with increasing concentrations of HDL from patients with sCAD or ACS (n = 12 per group). (D) Effects of HDL2 (d = 1.063-1.125 g/ml) and HDL3 (d = 1.125-1.21 g/ml) from patients with sCAD or ACS and healthy subjects, separated by sequential ultracentrifugation, on endothelial cell NO production (n = 12-15 per group).
健康人のHDLはヒト大動脈血管内皮細胞(HAECs)のNO産生能を濃度依存性に増加させたが、sCADのHDLでは認めず、ACSのHDLではむしろ低下していた。
Effects of HDL from healthy subjects, patients with sCAD or ACS on endothelial cell NO production, as determined by ESR spectroscopy analysis.
(A)HDL from healthy subjects and patients with sCAD or ACS was isolated by sequential ultracentrifugation, and the effects of HDL (50 μg/ml) on endothelial cell NO production were analyzed by ESR spectroscopy analysis (n = 25 per group). Data are expressed as percent change versus buffer-treated cells; data points for each study participant are shown. (B) Representative ESR spectra of the NO-Fe(DETC)2 signal in endothelial cells treated with HDL from healthy subjects and patients with sCAD or ACS. (C) Increasing physiological concentrations of HDL (25, 50, and 100 μg/ml) from healthy subjects stimulated endothelial NO production that was not observed with increasing concentrations of HDL from patients with sCAD or ACS (n = 12 per group). (D) Effects of HDL2 (d = 1.063-1.125 g/ml) and HDL3 (d = 1.125-1.21 g/ml) from patients with sCAD or ACS and healthy subjects, separated by sequential ultracentrifugation, on endothelial cell NO production (n = 12-15 per group).
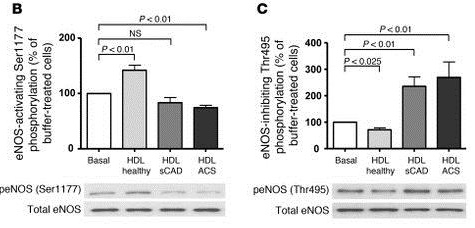
健康人のHDLはAktによるeNOSのセリン残基(Ser1177)のリン酸化を促進しeNOS活性化を増加させたが、CADのHDLはeNOSのスレオニン残基(Thr495)のリン酸化の抑制を促進し、eNOSの活性化を阻害した。
Effects of HDL from healthy subjects and patients with sCAD and ACS on endothelial Akt activation, eNOS-activating/inhibiting phosphorylation, and endothelial superoxide production.
(A) Effects of HDL (50 μg/ml) on phosphorylation of Akt at Ser473, (B) Akt-dependent activating phosphorylation of eNOS at Ser1177, and (C) inhibitory phosphorylation of eNOS at Thr495 in HAECs, as detected by Western blot analysis (n = 10-12 per group). (D) Effects of HDL on endothelial superoxide production (n = 25 per group; data points for all study participants are shown) and (E) NAD(P)H oxidase activity, as measured by ESR spectroscopy (n = 8-10 per group). (F) Representative ESR spectra of NAD(P)H oxidase activity in HAECs treated with buffer (basal) and with HDL from healthy subjects or patients with sCAD or ACS.
PKCβ2のセリン残基(Ser660)のリン酸化が健康人のHDLでは抑制されたが、CADのHDLではむしろ促進された。
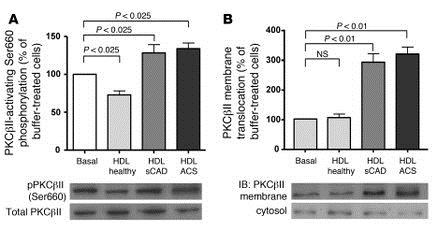
Differential effects of HDL from healthy subjects and patients with sCAD or ACS on endothelial LOX-1 and PKCβII activation — role of PKCβII activation in the altered effects of HDL on endothelial Akt and eNOS-activating/inhibiting phosphorylation in patients with CAD.
(A) Effect of HDL from healthy subjects and patients with sCAD and ACS on PKCβII-activating phosphorylation at Ser660 and (B) membrane translocation of PKCβII in endothelial cells (n = 8-12 per group). (C) Incubation of endothelial cells with the nonselective inhibitor of PKCβI and PKCβII isoforms LY379196 and CGP53353, a highly selective inhibitor of PKCβII, restored the ability of HDL from patients with CAD to stimulate endothelial NO production and (D) the activating eNOS phosphorylation at Ser1177 (n = 8-10 per group). (E) Pretreatment of endothelial cells with an anti-LOX-1 blocking antibody prevented the increase in PKCβII phosphorylation at Ser660 (n = 6-8 per group). (F) Moreover, incubation of endothelial cells with an anti-LOX-1 blocking antibody improved the capacity of HDL from patients with CAD, but not from healthy subjects, to stimulate endothelial NO production (n = 8-10 per group).
CADではHDLのPON1活性が有意に低値であった。
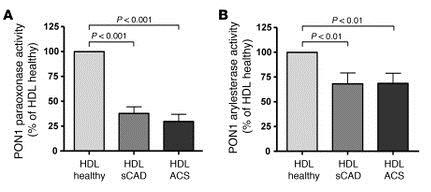
Activity and content of HDL-associated PON1 in healthy subjects and patients with sCAD or ACS — effect of inhibition of PON1 on HDL-associated MDA content and phosphorylation of PKCβII at Ser660.
(A) Paraoxonase and (B) arylesterase activities of HDL-associated PON1 isolated from healthy subjects and patients with sCAD or ACS, as measured by UV spectrophotometry (n = 25 per group). (C) PON1 content in HDL isolated from healthy subjects and patients with sCAD or ACS was determined by Western blot analysis (n = 25 per group). (D) Effect of the specific PON1 inhibitor hydroxyquinoline (HQ, 200 μM) on protein-bound MDA content and (E) MDA-lysine adducts in HDL, as detected by spectrophotometry and mass-spectrometry analysis, respectively (n = 4-6 per group). (F) Effect of HDL pretreated with the PON1 inhibitors HQ or EDTA (5 mM) on phosphorylation of PKCβII at Ser660 was detected by Western blot analysis (n = 8-10 per group).
https://www.jci.org/articles/view/42946
HDLのコレステロール引き抜き能の低下、抗炎症・抗酸化作用の低下、血管内皮保護効果の低下がDMやCAD患者で認められ、HDLの機能低下の重要性が指摘されてきている。
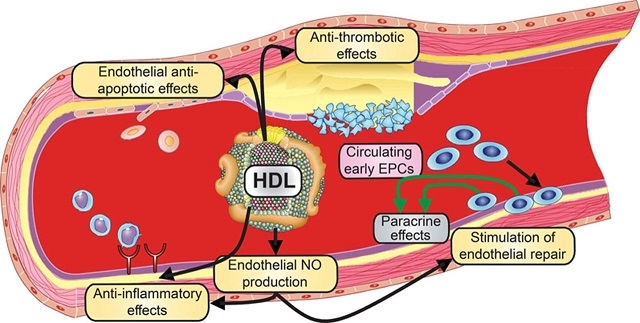
Proposed direct vascular protective and potentially antiatherogenic effects of normal high-density lipoprotein (HDL).
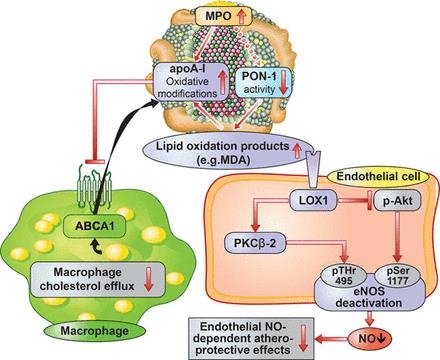
Mechanisms of altered vascular effects of high-density lipoprotein (HDL) in coronary disease. Activity of paraoxonase-1 (PON-1) is reduced in HDL obtained from patients with coronary artery disease. ABCA1 indicates ATP-binding cassette transporter A1; apoA-I, apolipoprotein A-I; eNOS, endothelial NO synthase; LOX1, lectin-like oxidized LDL receptor-1; MDA, malondialdehyde; and MPO, myeloperoxidase. Modified and adapted from Mineo et al.114 Authorization for this adaptation has been obtained both from the owner of the copyright in the original work and from the owner of copyright in the translation or adaptation.
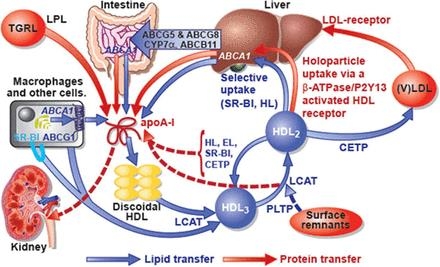
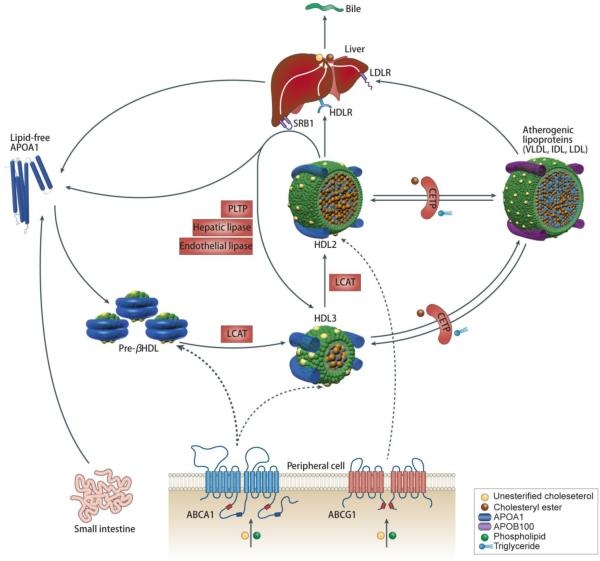
Schematic representation of high-density lipoprotein (HDL) metabolism. HDL metabolism is initiated by the secretion of lipid-free apolipoprotein (apoA-I) by the liver and intestine. Both hepatocytes and enterocytes express ATP-binding cassette (ABC) transporter A1 (ABCA1), which effluxes phospholipids and cholesterol and thereby lipidates apoA-I extracellularly. Lipid-free apoA-I is also generated by the lipolysis of triglyceride-rich lipoproteins (TGRL; chylomicrons and very low-density lipoprotein [VLDL]) and the interconversion of HDL subclasses in the course of lipolysis and lipid transfer and then interacts with ABCA1 in liver and peripheral cells. The resulting nascent HDL discs induce cholesterol efflux from macrophages by mechanisms involving ABCG1 and scavenger receptor BI (SR-BI). Lecithin/cholesterol acyltransferase (LCAT)-mediated cholesterol esterification turns the discoidal HDL into mature spherical particles. The initially smaller HDL3 particles grow in size by ongoing lipid efflux, cholesterol esterification, and fusion with HDL and surface remnants of TGRL through phospholipid transfer protein (PLTP). The resulting HDL2 particles deliver lipids to the liver, either directly via HDL receptors or indirectly via lipid transfer to LDL, which are then internalized by the LDL receptor pathway. In the direct pathway, SR-BI mediates the selective uptake of cholesteryl esters into hepatocytes. In addition to this nonendocytic pathway, an as-yet-unknown HDL receptor, which is stimulated by the interaction of apoA-I with ectopic β-ATPase and the subsequently activated P2Y13 receptor, mediates holoparticle uptake. The indirect pathway requires the exchange of cholesteryl esters and triglycerides between HDL and VLDL, which is mediated by the cholesteryl ester transfer protein (CETP). Reverse cholesterol transport is finalized by the biliary excretion of cholesterol from the liver into the intestine either directly via ABCG5 and ABCG8 or after cytochrome P enzyme (CYP7α)-mediated oxidation to bile acids via the bile salt export pump ABCB11. The actions of SR-BI, CETP, hepatic lipase (HL), and endothelial lipase (EL) on HDL2, as well as of PLTP on HDL3, lead to the interconversion of HDL particles and also liberate lipid-free apoA-I, which is either used for de novo formation of mature HDL particles or filtrated through the renal glomeruli for tubular uptake and degradation (red dotted arrows). Blue arrows indicate lipid transfers; and red arrows, protein or holoparticle tranfers. Modified and adapted from von Eckardstein.11 Authorization for this adaptation has been obtained both from the owner of the copyright in the original work and from the owner of copyright in the translation or adaptation.
Circ Res 114(1):171-182, 2014
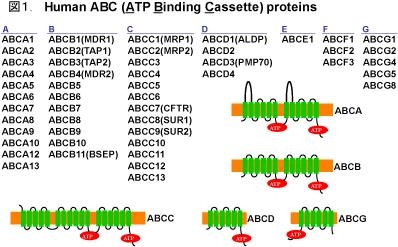
ABC(ATP Binding Cassette)蛋白
ABC蛋白は、脂溶性低分子化合物をATP加水分解のエネルギーを用いて輸送するトランスポーターである。複数の膜貫通αへリックスを持つ大きな膜たんぱく質で、細胞質側にアミノ酸配列が良く保存されたATP結合領域を1機能分子あたり二つ持つ。
バクテリアから人まで生物界に幅広く存在し、真核生物のABC蛋白質では、ATP結合領域はペプチド鎖に二つ挿入されている。バクテリアのABC蛋白質の場合には、2つのATP結合領域は、サブユニットとして膜貫通サブユニットと分子結合している。
ヒトの染色体上には48~49のABC蛋白質遺伝子が存在し、ATP結合領域のアミノ酸配列の相同性からAからGまでの7つのサブグループに分けられている。
固形がん治療の際にみられる多剤耐性の獲得された細胞に過剰に発現しているMDR1(Multidrug resistance)遺伝子産物のアミノ酸配列から予測される構造が、ABCに似ていることがわかり、人にもATP加水分解に依存して低分子化合物を輸送する新しいタイプのトランスポーターファミリーが存在することが明らかになった。その結果地球上の多くの生物が50-100種類のABC蛋白質遺伝子を染色体上に持っていることが明らかになった。
ABC蛋白質研究の面白さは以下の6点にまとめることができる。
1. ヒトABC蛋白質は様々な疾患と関係している。
2. ヒトABC蛋白質は脂質恒常性維持に重要な役割を果たしている。
3. ABC蛋白質は薬の体内動態に関与している。
4. MDR1は構造に類似性のない多くの気質を認識し輸送する(生化学の常識を覆す基質認識の広さ)
5. ABC蛋白は類似の二次構造を持ちながら、トランスポーター、チャンネル、レギュレーターということなった機能を持つ膜たんぱく質に分化している。
6. バクテリアからヒトまでそれぞれの生物で50-100種類のABC蛋白質が機能している。
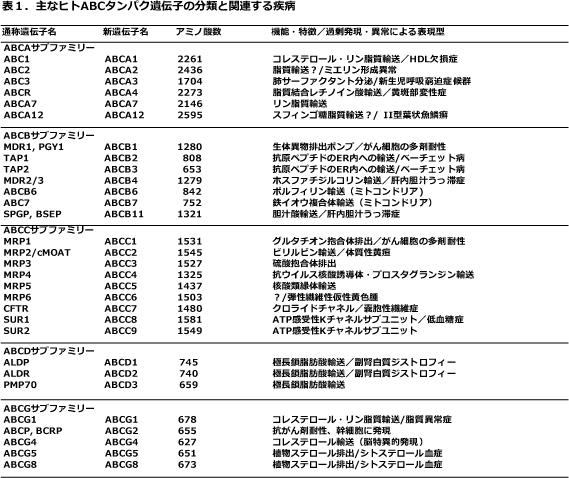
生理的重要性
ABC蛋白の異常により下表のように様々な疾患が引き起こされる。つまりABC蛋白質は我々の健康のために重要な役割を果たしている。
脂質恒常性維持
脂質恒常性に関与する主なABC蛋白質に下図のようなものがある。
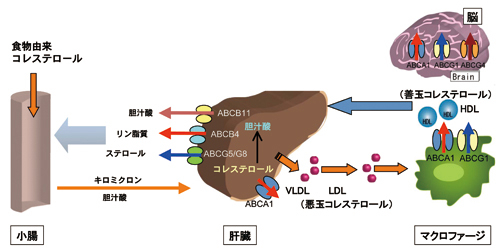
http://japanest-nippon.com/jp/ap/ap_journal_page.php?id=31
脂質代謝経路
脂質の代謝経路は腸管から吸収された外因性代謝経路と肝臓で合成された内因性代謝経路がある。
外因性代謝経路:腸管から吸収された脂質は腸管粘膜でアポB48などのアポ蛋白を膜蛋白として持つ粒子径の大きなカイロミクロンとして血中に放出される。血流にのって全身をめぐる途中でリポ蛋白リパーゼにより中性脂肪が分解され脂肪酸を各臓器に渡しながら代謝され、カイロミクロンレムナントとなり肝細胞表面にあるレムナントレセプターにより取り込まれる。
内因性代謝経路:肝臓で合成されたVLDL粒子は血中でLPLに中性脂肪が分解されながら、IDL、LDLと代謝され、肝細胞表面にあるレムナントレセプターやLDLレセプターにより取り込まれ代謝される。
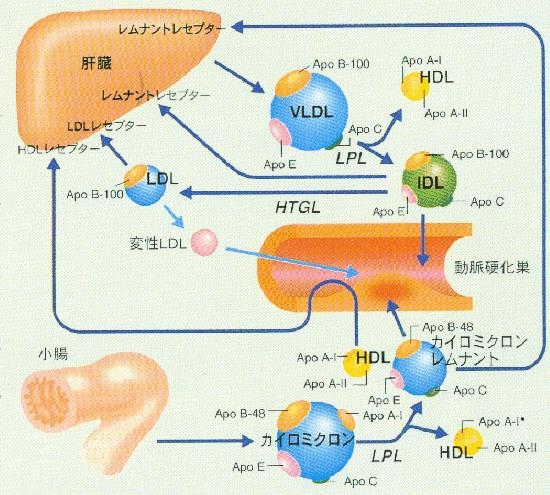
この流れの中の途中でIDLやLDL、レムナントが動脈硬化巣内に入り込んだり、出て行ったりしているが、動脈硬化巣内で酸化や糖化などの修飾を受けると出ていけなくなり、動脈硬化巣が進展していくことになる。
ABCA1を安定発現させた培養細胞液にアポA-1を加えると、アポA-1にリン脂質とコレステロールが結合したHDL様粒子が形成される。
アポA-1がABCA1に直接結合して細胞脂質を直接輸送し、アポA-1結合に向けたABCA1構造変化のためにATPを消費しているのか、アポA-1がABCA1近傍の細胞膜上の特定なドメインに結合してそこから脂質を取り込むとするもので、ABCA1が細胞膜の構造を変化させてこのドメインを形成するためにATPが消費しているのかまだ議論が分かれている。
細胞内にコレステロールの量が上昇すると、その代謝中間体であるオキシステロールをリガンドとする核内受容体LXRによりABCA1遺伝子の転写は活性化され、ABCA1の量が増加し、細胞外へのコレステロールの排出が促進される。しかし、コレステロールは細胞膜の必須な構成成分であり、通常細胞膜にはリン脂質成分ともほぼ同量のコレステロールが存在しており、コレステロールが減少しすぎると逆に細胞は死滅してしまうのでABCA1蛋白質の半減期は1-2時間と短時間で分解され、過剰のコレステロールの排出に抑制がかかっていると考えられる。
http://www.biochemistry.kais.kyoto-u.ac.jp/ABCprotein/intro.html
真核生物で最初のABC蛋白質として発見されたABCB1(MDR1)は多彩な構造の薬剤や生体異物を細胞外へ排出するATP依存トランスポーターで、細胞膜中に存在する両親媒性の基質を結合し、ATPの結合/加水分解に伴う構造変化によって基質を細胞外へと排出する。
一方、肝臓に発現するABCB4(MDR3)はリン脂質のホスファチジルコリン(PC)を生理的輸送基質とし、胆汁中に排出することで、界面活性作用の強い胆汁酸をミセル化し、胆管膜を保護する役割がある。ABCB4とABCA1はともに胆汁酸にPCとCEを排出することができるが、ABCB4はアポA-1に基質を排出できない。HDL粒子を形成するABCA1には、アポA-1受容体としての機能が備わっていると考えられる。
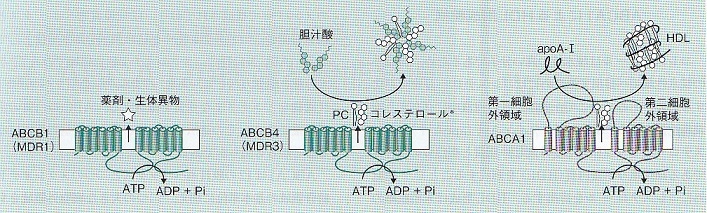
ABCA1によるHDL形成機構モデル。
1. 脂質輸送ステップ:ATP加水分解に依存してコレステロールとPCを輸送する。(このとき、ABCA1の細胞外領域に輸送された脂質が蓄積すると植田らは考えている。)
2. アポA-1に結合ステップ:ATP加水分解に依存して細胞外ドメインの構造が変化し、正電荷アミノ酸からなるアポA-1結合部位がABCA1の表面に現れ、アポA-1が結合する。
3. 脂質蓄載ステップ:細胞外ドメインに結合したアポA-1に、脂質輸送ステップで輸送したコレステロールとPCが一度に受け渡される。
4. HDL遊離ステップ:脂質と複合体となったアポA-1は構造が変化し、ABCA1との親和性が低下するため、ABCA1からHDLが遊離する。さらに、ABCA1は細胞表面で機能しているだけでなく、恒常的にエンドサイトーシスと細胞表面へのリサイクリングを繰り返していて、このエンドサイトーシス過程は細胞内部にコレステロールを過剰に蓄積したような状況においては重要であることがわかってきた。
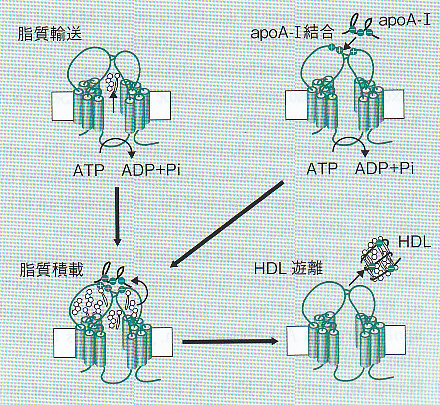
The Lipid 23(4):378-383, 2012
LXR(Liver X receptor)
末梢マクロファージのABCA1はマウスで選択的に欠損させても血中HDL低下はわずかであるが、肝特異的ABCA1欠損マウスでは血中HDLが80%低下し、肝ABCA1がHDL産生に最も重要な役割を持つことが判明した(J. Clin. Invest.,115,1333-1342, 2005)。
肝で合成・分泌される遊離アポA-1は、血中では不安定で腎臓で分解される。その消失は、肝ABCA1が欠損すると速やかに起こることから、肝ABCA1がアポA-1に脂質を供給することにより安定化することが判明した。
肝ABCA1が未成熟のHDLを、末梢のABCA1がコレステロール含量の高い成熟したHDLを形成していることが判明しているが、肝と末梢のABCA1はどのような機序でコレステロール含量の異なるHDL粒子を形成するのであろうか?
培養細胞が産生するHDLのコレステロール/リン脂質の比率は細胞の種類により異なり、強制発現系では、ABCA1発現が増えるとコレステロール含量が増加する。したがって、アポA-1とリン脂質からHDLを形成することがABCA1の基本的機能であり、HDLコレステロール含量は、ABCA1が局在する細胞膜ドメインの環境や細胞内コレステロール輸送系とのリンクの有無による可能性が考えられる。未成熟のpreβ-HDLに細胞コレステロールを移す機能を持つABCG1がABCA1と強調して働くことも、コレステロール含量の高いHDLを産生する要因の一つと思われる。ABCG1はマクロファージ系細胞での発現が高く、肝ではクッパー細胞や内皮細胞に強く発現している。
マクロファージや線維芽細胞のABCA1は細胞にコレステロールを負荷すると発現が上昇し、細胞内コレステロールを放出してHDLを産生することにより細胞内コレステロールの量を調節している。この応答はオキシステロールを感知して活性化する核内受容体liver X receptor:LXRがABCA1プロモーターを直接活性化するメカニズムによる。
ヒドロキシメチルグルタリルHMGCoA還元酵素阻害剤であるスタチンやスクアレンエポキシダーゼ阻害剤を投与すると、コレステロール生合成経路で生成する内因性LXRリガンドが低下し、ABCA1発現も低下する。
山口らは、肝細胞由来のABCA1は、蛋白質、mRNAともに合成LXRアゴニストで上昇するものの、ステロールでは逆に低下し、スタチンでは低下しない反応を見出し、肝ABCA1は末梢細胞とは異なる発現制御を受けること唱えた。
ラット肝および小腸のABCA1mRNAを5′-RACE(rapid amplification of cDNA end)法により分析すると、小腸ではエクソン1から転写が開始されるABCA1mRNAが存在しており、肝型命名した。肝型と末梢型のABCA1mRNAはマウスおよびヒト肝にも検出され、二重制御が種を超えて存在することが示唆されている。
肝型及び末梢型は翻訳開始店より上流に転写が開始されており、同じN末端を持つ蛋白質が生成されていると考えられる。
ラットのほとんどの組織では主に末梢型が、肝および腎では末梢型以外のmRNAの存在量が多く、肝では2/3が肝型であった。
エクソン1上流の末梢型プロモーターはLXRにより制御され、LXRアゴニストTO901317で活性化され、LXR内因性リガンドを低減させるスタチン処理で活性が低下する。
これに対し、エクソン2上流に見出した肝型プロモーターは、LXRアゴニストに応答せず、スタチンにより活性化された。
このような肝型プロモーターのスタチン/ステロール応答は-221領域に存在するsterol responsive element(SRE)が担っていた。SREBP-2はコレステロール欠乏により活性化され核内移行する転写因子であるが、実際にスタチンでSREBP-2の核内移行型が増加し、このSRE配列に結合すること、さらに肝型プロモーターのコレステロール低下による活性化はSREBP-2が担うことを、siRNAノックダウンや核内移行型SREBP-2発現により明らかにした。
さらに、肝ABCA1の二重制御はin vivoでも機能し、胆汁酸吸着樹脂/スタチン投与でラット肝のコレステロールを20%低下させると、末梢型ABCA1mRNAの低下と肝型の増加、肝ABCA1蛋白質と血中HDLの上昇が認められる。
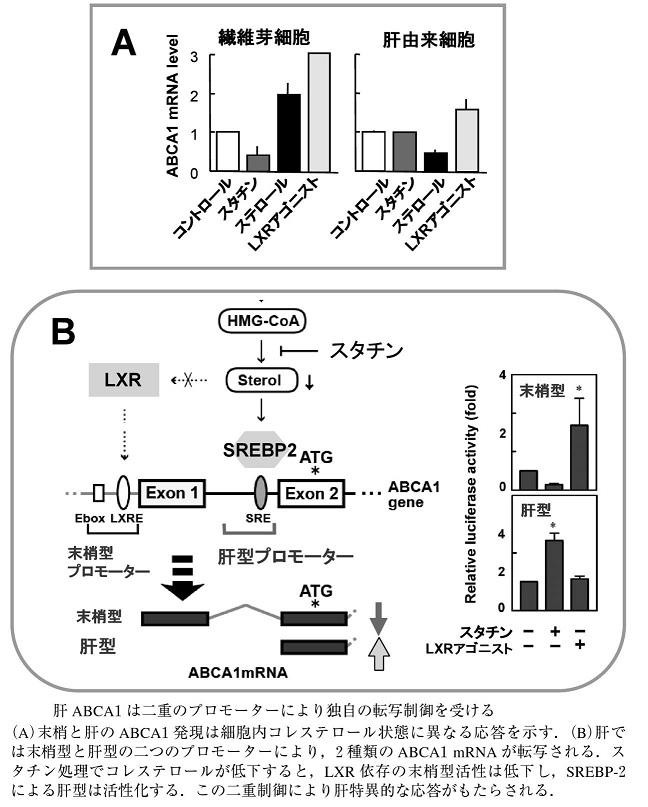
http://www.jbsoc.or.jp/seika/wp-content/uploads/2013/05/82-09-09.pdf
末梢ではLXR応答プロモーターがABCA1-HDL系を介して細胞へのコレステロール蓄積を防ぐ。
肝臓でコレステロール濃度が上昇しLXRが活性化されると、胆汁酸への転換反応の律速酵素CYP7A1とともに、胆管にコレステロールを排出するABCG5/ABCG8の発現が上昇する。
ABCA1末梢型プロモーターは強力に活性化されるが、このままABCA1発現が過剰に上昇すると、肝内のコレステロールは再び末梢に輸送される危険がある。
そこでSREBP-2依存の肝型プロモーター活性が低下することにより、再輸送を防ぐのかもしれない。
また逆に肝内コレステロールが枯渇した場合には、LXR活性が低下してもSREBP-2依存の肝型プロモーターが活性化すれば一定のABCA1発現とpre-β-HDL生産を維持することができ、末梢からコレステロールを回収できる。
























