川村所長の勉強会参加記録
2019.12.25
Hippo-YAP経路から腫瘍循環器まで 木田圭亮先生
2019年12月6日
演題「Hippo-YAP経路から腫瘍循環器までの基礎から臨床を考える」
演者:聖マリアンナ医科大学薬理学准教授 循環器内科 木田 圭亮 先生
場所: 横浜グラントインターコンチネンタルホテル
内容及び補足「
心筋症診療ガイドライン2018年改訂版が2019年3月29日に発行され、6月28日に更新された。
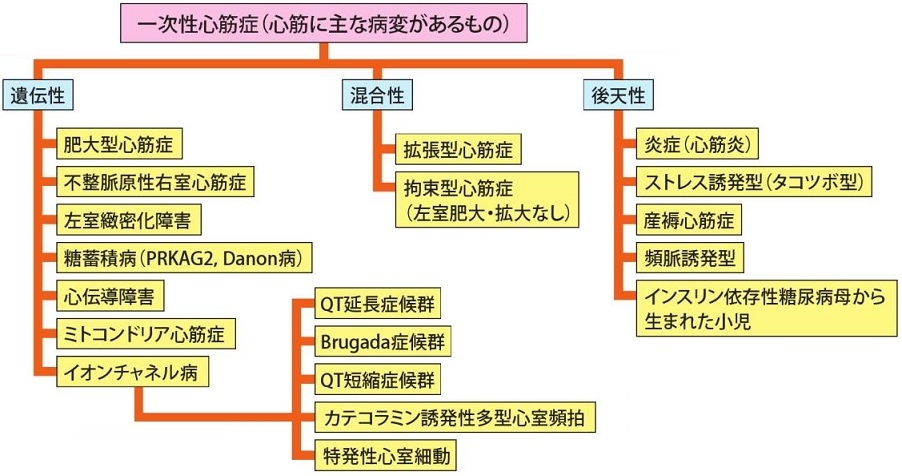
心筋症は心機能障害を伴う心疾患をいう。
1995年WHO/ISFC合同委員会による病型分類は、1. 拡張型心筋症、2. 肥大型心筋症、3. 拘束型心筋症、4. 不整脈源性右室心筋症、5. 分類不能の心筋症に分けられた。
米国心臓協会は、2006年に「心筋症はしばしば心室の肥大や拡張を示す機能的および・または電気生理学的機能異常を伴う一群の疾患である。その原因は多岐にわたるがしばしば遺伝性である。心臓死や心不全の原因となりうる」と定義した。病変の主座が心臓にある心臓原発性と全身疾患の新病変である二時性心筋症に大別している。
原発性心筋症は、遺伝性、混合型(遺伝性と後天性)、後天性の三つに分類され、QT延長症候群やBrugada症候群などのイオンチャンネル病も遺伝性含まれた。
欧州心臓病学会は2008年に心筋症の定義を「冠動脈疾患・高血圧・弁膜症・先天的奇形によるものではない、構造的・機能的異常を伴う心筋疾患」とし、二次性心筋症という概念を排除している。
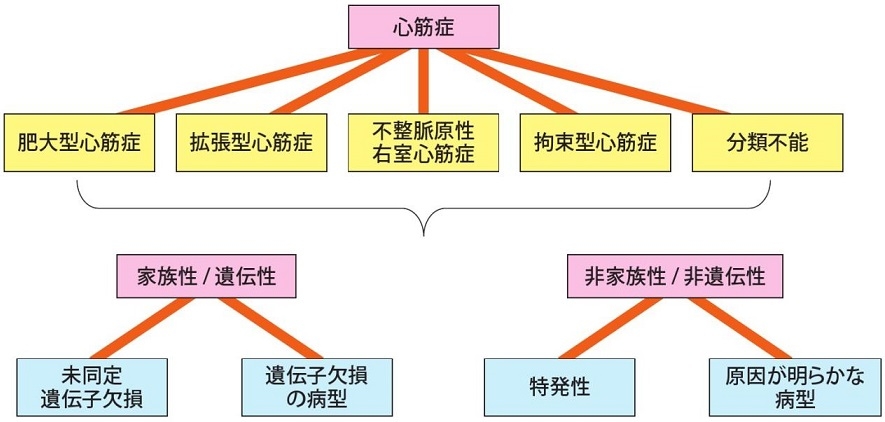
この度のガイドラインでは、従来の診断の手引きにおける提示・分類に準拠しながら、「心機能障害を伴う心筋疾患」のうち、いわゆる原発性(以前の特発性)心筋症を、肥大型心筋症、拡張型心筋症、不整脈源性右室心筋症、拘束型心筋症のが、4つに分類した基本病態の一部は中腹を示し、相互に鑑別が困難なこともしばしばある。
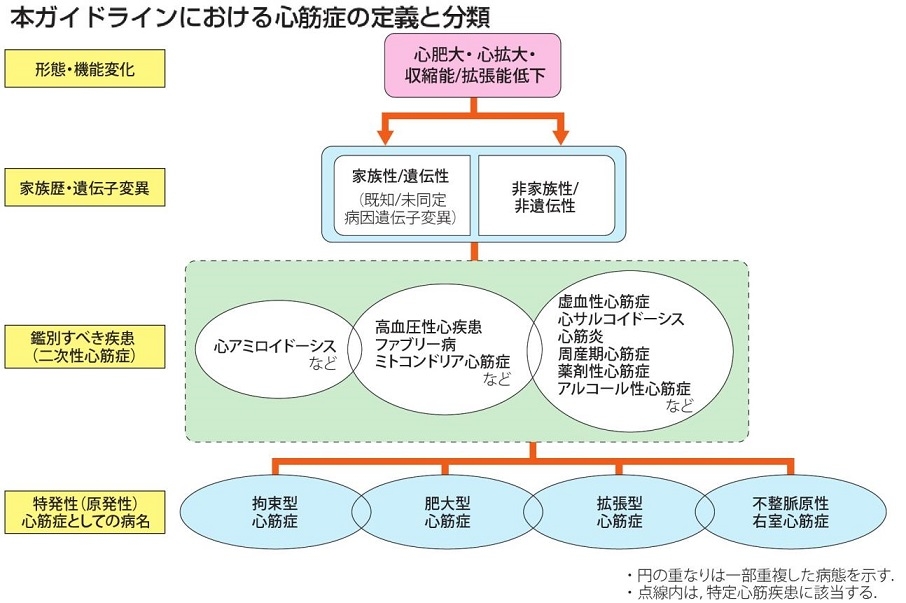
高血圧による心筋症は、心筋に対して高血圧の負荷という筋トレを行った結果として、びまん性の左室肥大を呈するが、肥大型心筋症は、高血圧という筋トレをしない状況下で、局所性の左室肥大を呈した状態といえる。
Hippoシグナル経路の最終的なeffectorであるYAP(Yes-Associated Protein)は高脂肪食のマウスや糖尿患者の心筋を肥大させる。
糖尿病患者はそうでない人に比べ、高血圧の存在下においてより高頻度に心不全に至る。YAPはTEAD1(Transcriptional enhancer factor 1)を活性化させて心筋の脱分化を促し、心不全に至らないように心筋を保護する。
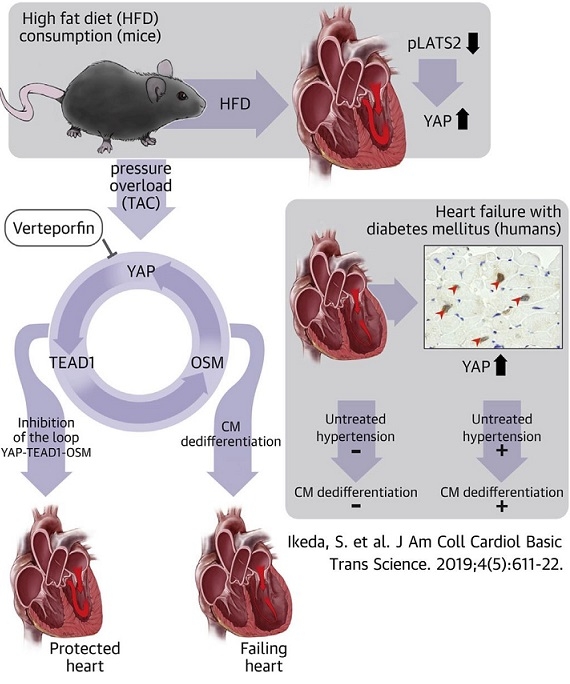
J Am Coll Cardiol Basic Trans Science. 2019;4(5):611-22
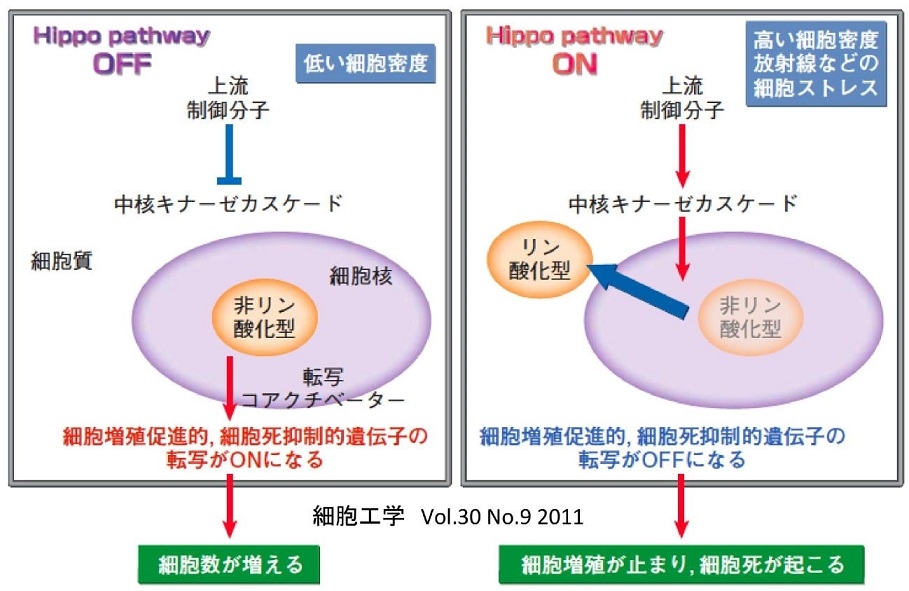
参:Hippo-YAP経路:ショウジョウバエからヒトに至るまで高度に保存されている細胞内シグナル伝達経路である。
ショウジョウバエHippoはセリン/トレオニンキナーゼであり、その遺伝子変異は細胞の過増殖に起因する「カバ(hippopotamus)の皮膚」様の表現型を示す。マウスやヒトのHippoホモログは2種類のセリン/トレオニンキナーゼMst1とMst2である。
一方YAPは転写共役因子であり、核内で複数種類の転写因子と結合し、遺伝子発現の制御を担う。YAPはHip経路によってリン酸化されると核内から排除され、不活化状態となる。
Hippo-YAP経路は、細胞の増殖や死の制御を通じて、細胞数を調節し、器官サイズを決定する。また、細胞接着や細胞極性、細胞分化とも密接にかかわり本経路の破綻が癌などの疾患の原因となる。
Hippo pathwayの破綻、YAP1、AZの活性化がヒト癌で高頻度に認められ、臨床的予後の悪化と相関し、実験的には、癌細胞の間葉細胞化、幹細胞化をもたらすと考えられる。Hippo pathwayの機能を高め、AP1、TAZを抑制すれば、癌治療に有益と推察される。Hippo pathway研究の成果は癌治療につながるだけでないく、Hippo pathwayとYAP1に関する心臓の研究はYAP1の機能を高めると心臓に対して保護的に働く可能性を示唆している。皮膚の再生についても同様の期待がある。神経幹細胞の機能にもYAP1の活性は必須である。となると、YAP1の活性剤は、心筋梗塞、火傷、加齢に伴う脳の高次機能障害に対して治療的に有用と期待される。TAZは、間葉組織幹細胞の骨細胞、筋細胞分化を促進し、脂肪細胞分化を抑制するので、TAZを活性化すると骨粗鬆症、筋萎縮、肥満治療に役立つと予測される。
高血圧下において、Hippo経路の上流にあるKinaseであるMst1とLats2を活性化するWW45cKOマウスではより高度な心不全となったことからYAPとTEAD1、OSM1は心筋細胞の脱分化を促進していると考えられる。
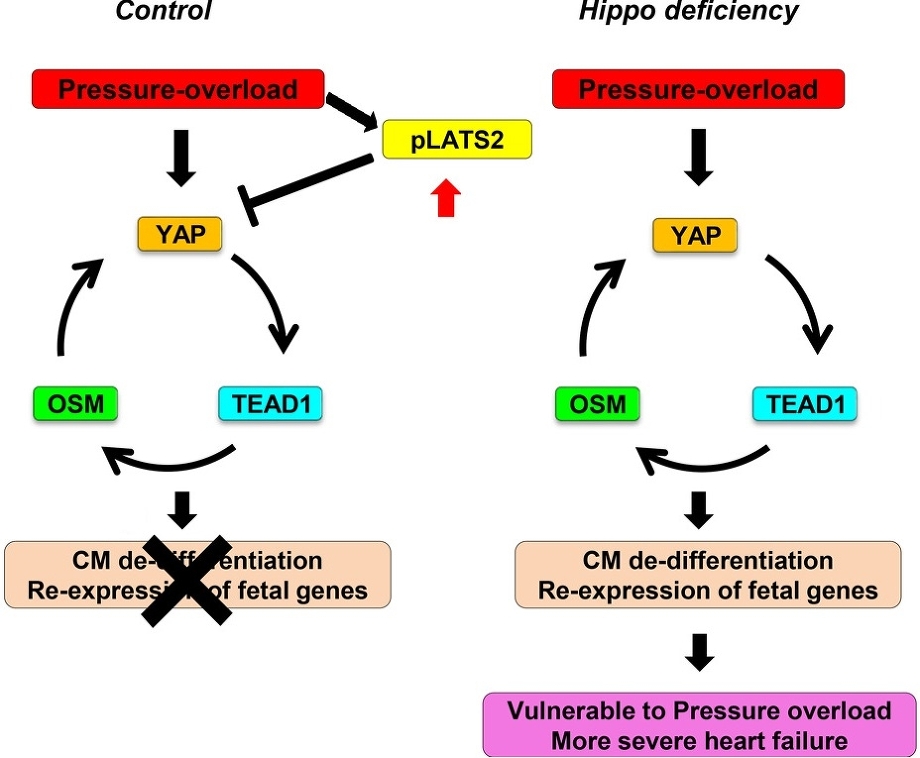
Circ Res. 2019;124:292-305.
Hippo-YAP/TAZシグナル伝達経路が体や器官のサイズを制御していることが示された。
Science, 316, Iss.5821 (2007)
Hippoシグナル伝達経路の標的となる蛋白質として転写共役因子であるYkiが同定され、Ykiと転写因子との複合体が細胞の増殖や細胞死に関与する遺伝子の転写を制御することが明らかにされた。
Hippoシグナル伝達経路を破綻させるとYkiが活性化し、ショウジョウバエの複眼や翅の肥大が観察され、Hippo-Ykiシグナル伝達経路は細胞の数を制御することにより器官のサイズを制御することが示された。
Hippo-Ykiシグナル伝達経路は高頻度に哺乳動物においても保存されていることが示された。
(a)ショウジョウバエにおけるHippo-Ykiシグナル伝達経路。Hippo経路は、セリンスレオニンキナーゼであるHippoとWarts、および、制御タンパク質であるSavとMatsの4種類の主要なタンパク質により構成される。Wartsの活性化によりYkiはリン酸化され、リン酸化型のYkiは14-3-3と結合し細胞質に局在する。脱リン酸化型のYkiは核へと移行し、転写因子Sdと結合し遺伝子の発現を制御する。Ex-Merlin-Kibra複合体はHippoを活性化する。
(b)哺乳動物におけるHippo-YAP/TAZシグナル伝達経路。HippoはMst1/2と、WartsはLats1/2と、MatsはMob1a/1bと、YkiはYAP/TAZと、SdはTEADと、それぞれ対応する。リン酸化されたYAP/TAZは、14-3-3との結合にくわえ、分解に導かれる。
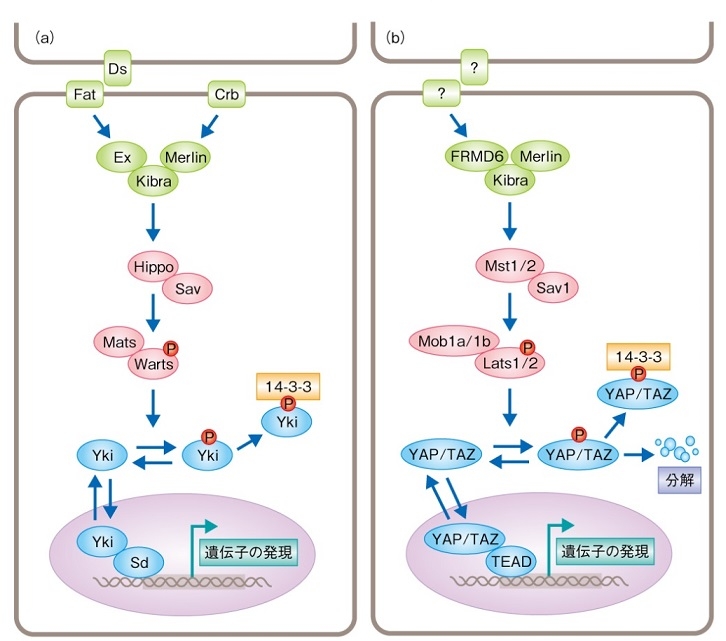
http://leading.lifesciencedb.jp/5-e004
心筋細胞に対して虚血や再灌流、血圧負荷が起こることにより、リン酸化およびLASTS1/2キナーゼの活性化によりSAV1が結合することによりMST1/2キナーゼの活性化が起きる。リン酸化とMOB1が作用してLATS1/2の活性化が起こり、YAP/TAXとTEADの結合が阻害される。
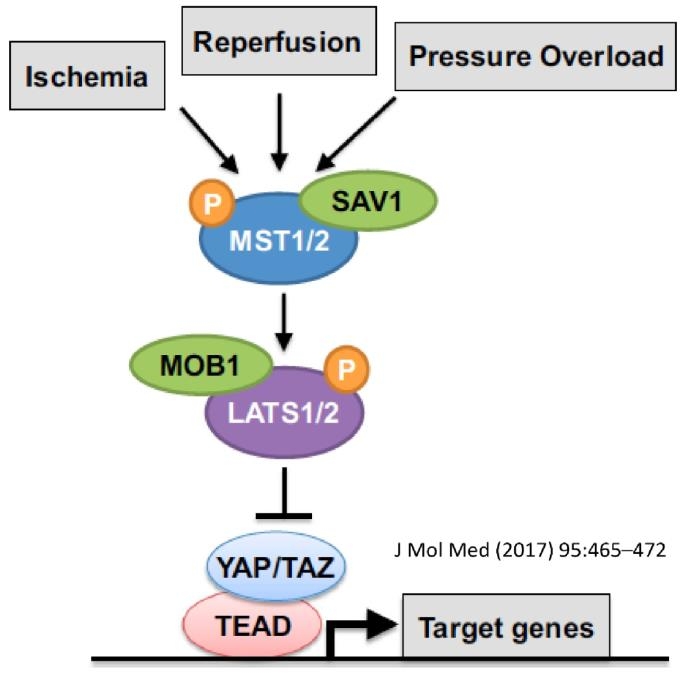
J Mol Med 2017, 95, 465-472
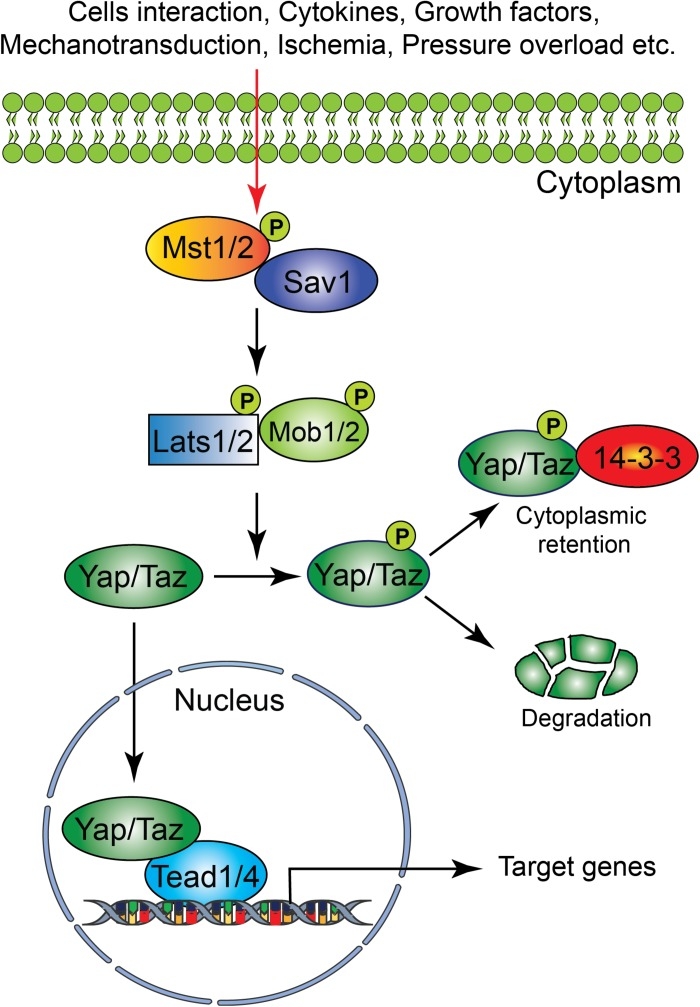
Hippoシグナル伝達系が幾つかの生理学的(細胞間相互作用、サイトカイン、成長因子など)および病理学的(虚血―再灌流障害などの酸化ストレス、圧力過負荷などの機械的ストレス、心筋梗塞などの心筋障害など)シグナルにより刺激を受けると活性化される。セリン/スレオニンキナーゼ、転写コアクチベーター、および転写因子でHippoシグナル系は構成されている。活性化されると、上流のMst1/2、Lasts1/2、Sav1およびMOB1などのキナーゼが下流のメディエーターYap及びTazのリン酸化を促進し、細胞質の保持、または分解をもたらす。対照的に、上流キナーゼの不活化は、YapとTazの核内移行につながる。
YAP-TEADsの活性化が心筋細胞内で起こると、心筋細胞が増殖する。TT-10 (C11H10FN3OS2)を入れた際に、心筋梗塞後の心筋細胞の増殖が顕著であり、心機能も良かった。
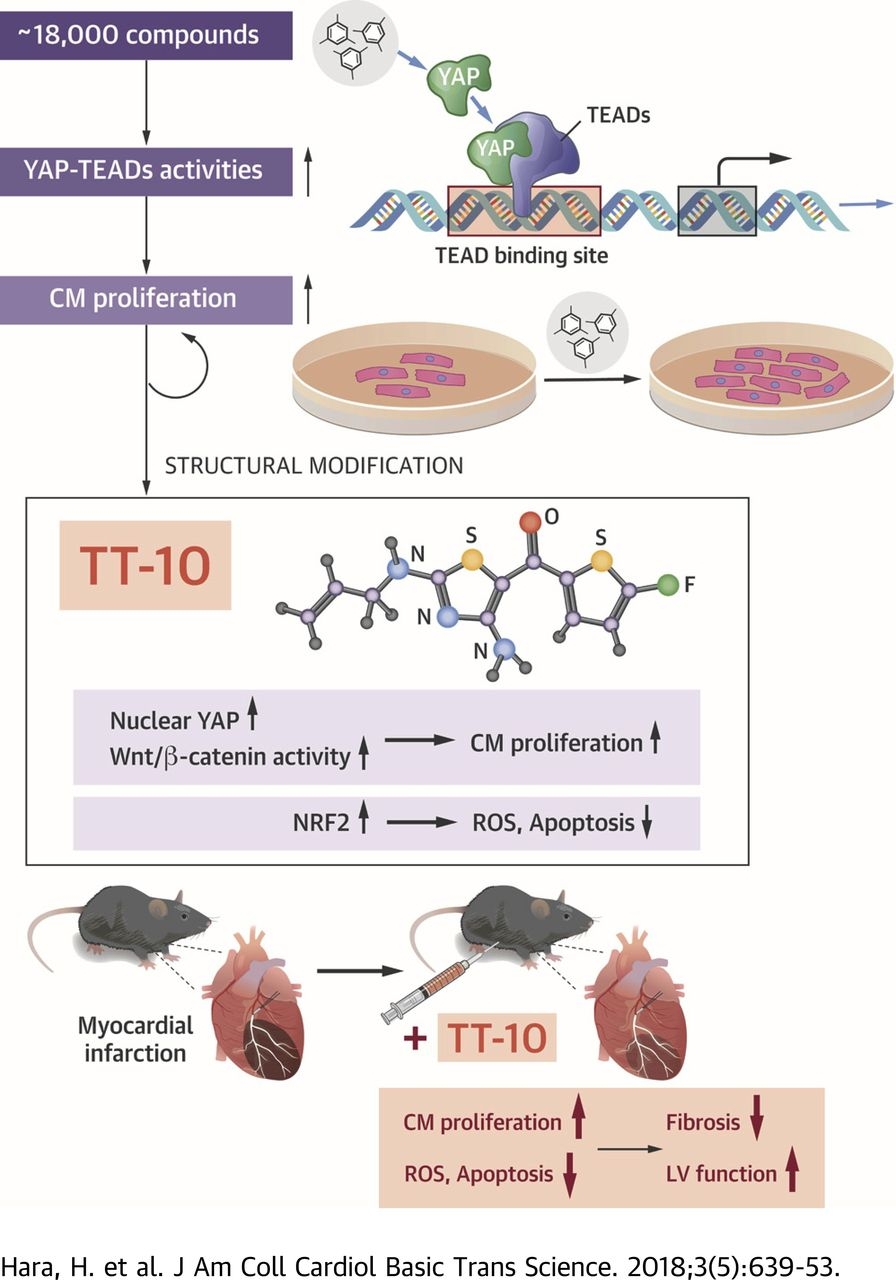
file:///C:/Users/PCUser/Downloads/639.full.pdf
Hippo-YAP経路は、細胞の増殖、アポトーシス、分化に重要な役割を果たし、器官のサイズと成長の進化的に保存された調節因子である。心筋細胞の増殖と分化、ストレス応答、および機能的シグナル伝達の調節においてHippo-YAP経路は極めて重要な役割を担っている。人間の心筋は自己修復能力が無いので、心筋梗塞後の心筋細胞の損失は、心不全年につながる。Hippo-YAP経路の研究は心筋細胞の修復と再生の治療に役立つ可能性がある。
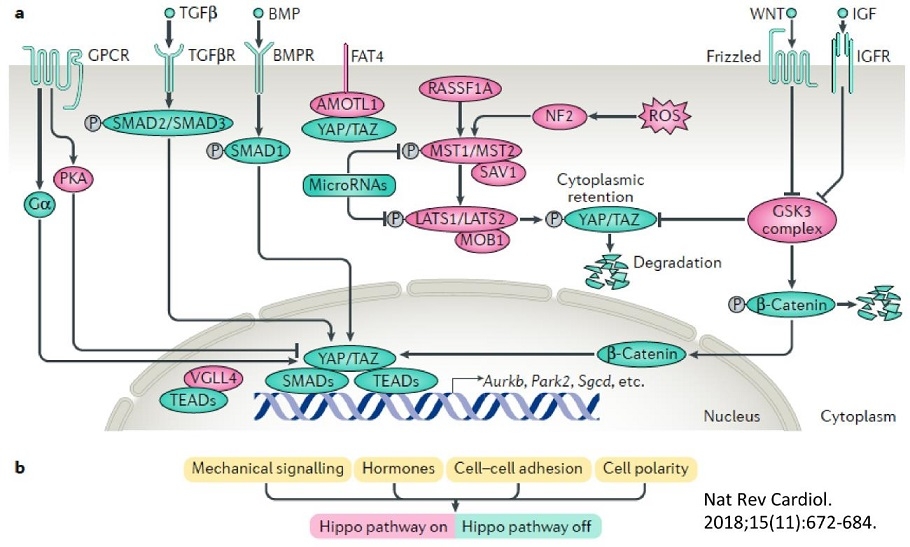
Nat Rev Cardiol. 2018 Nov;15(11):672-684. doi: 10.1038/s41569-018-0063-3.
心臓の発生、再生/修復及び疾患においてのHippoシグナル伝達系の役割
A 心臓の発生中におけるHippoシグナル伝達系の活性化/不活性化は、心筋細胞、心外膜及び内膜細胞の増力と分化を調節している。
心筋において
Hippo kinase不活化→心筋細胞の増殖亢進
Hippo effector不活化→増殖の抑制、心筋壁の減少:低形成、除脈
Hippo effector活性化→増殖、心筋発育の亢進:周辺の出血、心室の消失、心筋症・心不全、胎児致死
心外膜において
Hippo kinase不活化→心外膜細胞の線維芽細胞への分化抑制:冠血管系の異常、胎児致死
Hippo effector不活化→心外膜細胞の増殖抑制、心外膜由来細胞の分化の抑制、EMT(内皮間葉移行)の抑制:心外膜―心筋シグナルの障害
心内膜において
Hippo effector不活化→心内膜細胞の増殖抑制、心室壁厚の減少、EMT(内皮間葉移行)の抑制:neuregulin1とTGFβ-Smadシグナリングへの影響、出生後致死
B Hippoシグナル伝達の活性化/不活性化は、心筋損傷後の新生児および成人の心臓の再正反応を異なる制御をしている。
新生児心臓において
Hippo kinase不活化→心筋細胞の増殖亢進、再生亢進
Hippo effector不活化→心筋損傷後の再生抑制、線維化亢進
Hippo effector活性化→心筋細胞の細胞周期の活性化及び増殖の亢進、心筋損傷後の再生の亢進、線維化の抑制
成人心筋において
Hippo effector活性化→心筋細胞の増殖亢進、心梗塞後の心機能亢進、再正反応亢進、生存率上昇、心筋梗塞後の梗塞範囲の減少
C Hippoシグナル伝達系の活性化/不活化は、多くの心臓病を引き起こす。
心筋肥大において
Hippo kinase不活化→横行大動脈の縮窄後の過形成の抑制、線維化の抑制
Hippo effector不活化→横行大動脈の縮窄後の過形成の抑制、心筋アポトーシスの亢進、線維化の亢進、横行大動脈の縮窄後の心機能の低下
虚血性心疾患、拡張型心筋症において
Hippo kinase不活化→酸化ストレスの抑制、心筋細胞のアポトーシス抑制、虚血による線維化の抑制、心筋障害の軽減、虚血再灌流や心筋梗塞後の心機能の亢進:デュシェンヌ型筋ジストロフィーにおける大動脈縮窄による拡張型心筋症の心筋保護作用
Hippo kinase活性化→酸化ストレスの亢進、心筋細胞のアポトーシス亢進、拡張型心筋症の促進、虚血再灌流や心筋梗塞後の心機能の低下
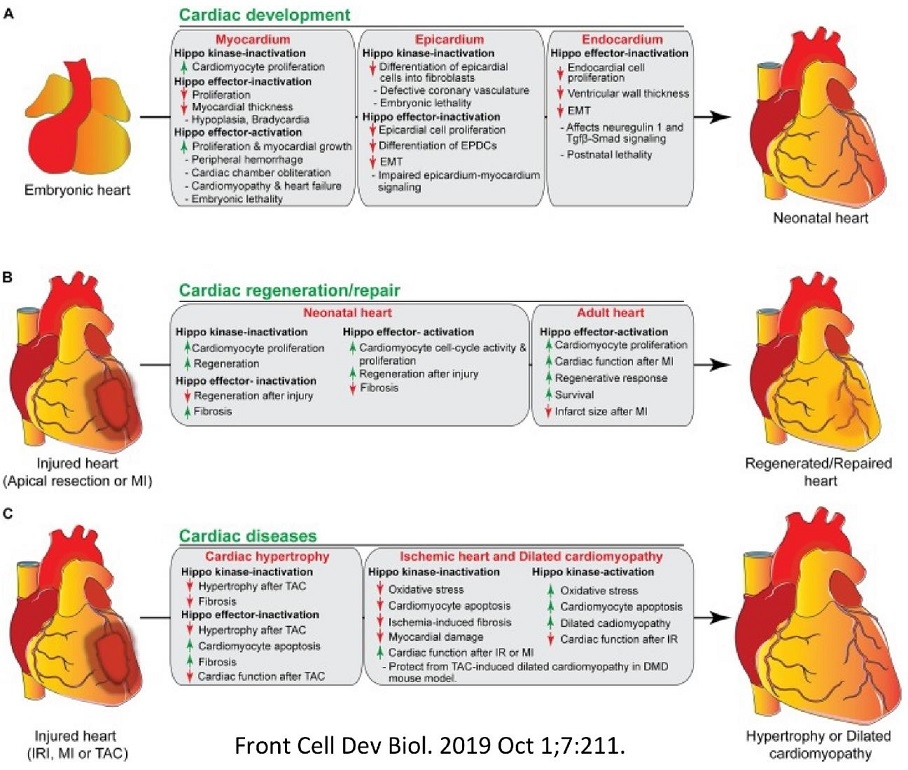
Front Cell Dev Biol 2019 Oct 1;7 211
哺乳類の心筋細胞はほとんど増殖しないため心臓の再生はほとんど見られない。その一因は心筋細胞の増力速度は年間1%未満であり、50歳のヒトにおいておよそ半分の心筋細胞は出生の時のものと試算されている。一方新生仔期においては、心臓の再生は既存の心筋細胞が増殖することにより促進される。成体のマウスの心筋細胞において組織に特異的にHippo経路を阻害すると心筋梗塞の後心臓の再生が促進された。
心尖部の切除、冠動脈の結紮による心筋梗塞を胎生期に行った場合には、既存の心筋細胞が増殖し心臓は再生されるが、生後に行った場合には、線維化が起こり、瘢痕が形成され後に心不全となる。聖母にHippo経路を阻害して振戦の切除や冠動脈の結紮を行って心筋梗塞を起こしても、既存の心筋細胞が増殖し心臓は再生される。
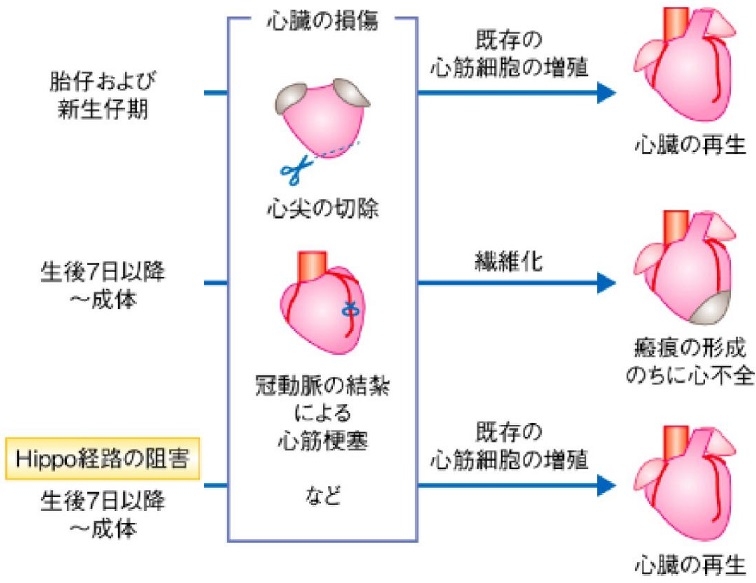
Development 2013 140: 4683-4690; doi: 10.1242/dev.102798
進化的に保存されたシグナル伝達系であるHippo経路は、胎仔期の心筋細胞においては、その増殖を抑制することにより心臓の大きさを制御する。Hipppo経路が活性化されると転写共役因子Yapがリン酸化され細胞質に局在することにより活性が抑制される。一方、Hippo経路が不活性化されるとYapは角へと移行し、TEADなどの転写因子とともに標的となる遺伝子の発現を促進する。Yapの強制発現はHippo経路の阻害と同様に、非再生期における心筋梗塞の後の心臓の再生を促進する。Yapが心筋細胞において細胞周期の進行を制御する遺伝子、アクチンの重合を促進する遺伝子、細胞骨格と細胞外マトリックスとの連結に関与する遺伝子などを制御する。また、筋細胞に特異的なジスロトフィン-糖蛋白質複合体の構成成分をコードする遺伝子はYapの標的であり、ジストロフィン-糖蛋白質複合体は新生仔期における心臓の再生に必須であることが示されている。
筋ジストロフィーのモデル動物であるmdxマウスはジストロフィンを欠損するため、ジストロフィン-糖蛋白質複合体の集合が起こらない。このマウスとHippoキナーゼのアダプター蛋白質であるSalvのコンディショナルノックアウスマウスのダブルノックアウトマウスの心筋細胞の再生能を調べるため、通常では非再生期である生後8日目において心臓を損傷したところ、心筋細胞の過剰な増殖がみられ、心臓の先端にこぶのような心筋細胞の塊が生じた。Hippo経路のみ疎外されたマウスの心臓において、障害の後に心臓のもとの大きさへの再生が促進されたこととは対照的であった。このダブルノックアウトマウスにおいては、損傷付近の心筋細胞においてYapの核への移行が観察され、Yapの核への移行が観察され、Yapの標的となる蛋白質の発現が上昇していた。よってジストロフィン-糖蛋白しt複合体が何らかの形でYapの核への移行を抑制していることがわかる。
筋ジストロフィーは骨格筋の疾患であるが、進行とともに心機能障害も引き起こされ、心不全で亡くなることも少なくない。筋ジストロフィーのモデルマウスであるmdxマウスにおいて心不全の症状が現れるのに生後15か月もしくはそれ以上の期間が必要である。
生後9週マウスにおいて横行大動脈の縮窄の後2週間で心筋細胞の壊死、線維化、心機能の低下が起こったが、Hippo経路が阻害されたダブルノックアウトマウスにおいては線維化が減少しており、心機能の低下も見られなかった。この時、ダブルノックアウトマウスの心筋細胞において細胞の増殖及びアポトーシスの両方がみられた。さらにアデノ随伴ウイルスベクターを用いてHippo経路の構成蛋白質をノックダウンしたところ、ノックアウトと同様に、mdxマウスにおいて心臓の線維化及び心機能の低下が軽減された。
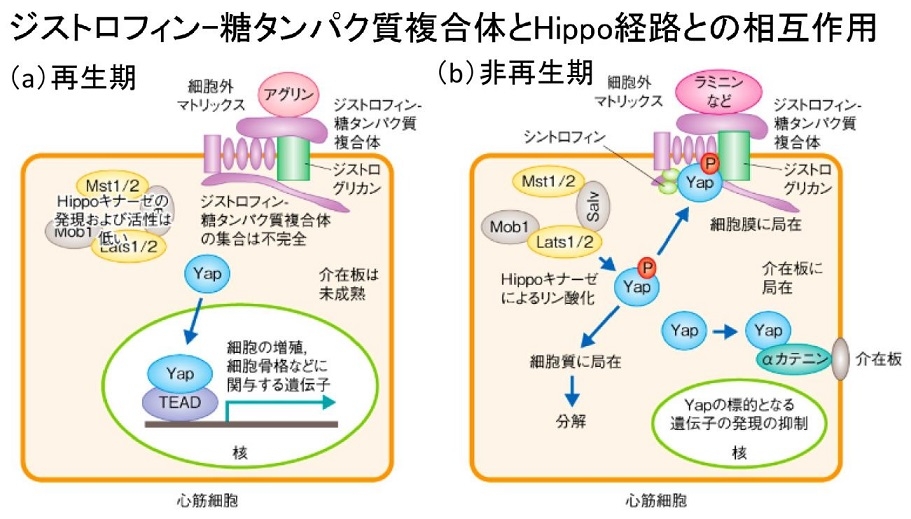
a:再生期 Yapは核に局在し、細胞の増殖、細胞骨格などに関与する遺伝子の発現を促進する。細胞外マトリックスであるアグリンとジストログリカンとの結合のためジストロフィン-糖蛋白質複合体の集合は不完全であり介在板は未成熟である。また、Hippoキナーゼの発現や活性は低く抑制されている。
b:非再生期 Yapの核への移行は複数の機構により抑制されている。YapはHippoキナーゼによりリン酸化されるが、一部はジストログリカンおよびシントロフィンとの結合を介してジストロフィン-糖蛋白質複合体と相互作用し細胞膜に局在する。また細胞質のリン酸化Yapは分解系に移行する。一部のYapはαカテニンとの結合を介して介在板に局在するが、これにはリン酸化は不要である。
現在日本で死因の第一位はガンであるが、後期高齢者では循環器疾患による死亡数の方が多く、両者を合併する患者数が近年増加している。またガン治療の進歩により、癌患者の予後は大幅に改善し、寛解あるいは完治するケースも増加してきているが、抗がん剤による心血管系の合併症の頻度も増加しているし、心血管疾患のハイリスク患者に癌治療を行った場合、高率に心不全になると考えられる。また、癌患者においては血栓塞栓症が多く、抗癌剤でこの血栓塞栓症が促進される場合も少なからず出てきている。近年、癌の専門医と循環器専門医が連携することでガン患者の生命予後を延伸し、QOLを改善することを目的に日本腫瘍循環器学会Onco-Cardiologyが設立された。
http://onco-cardiology.kenkyuukai.jp/special/index.asp?id=27611
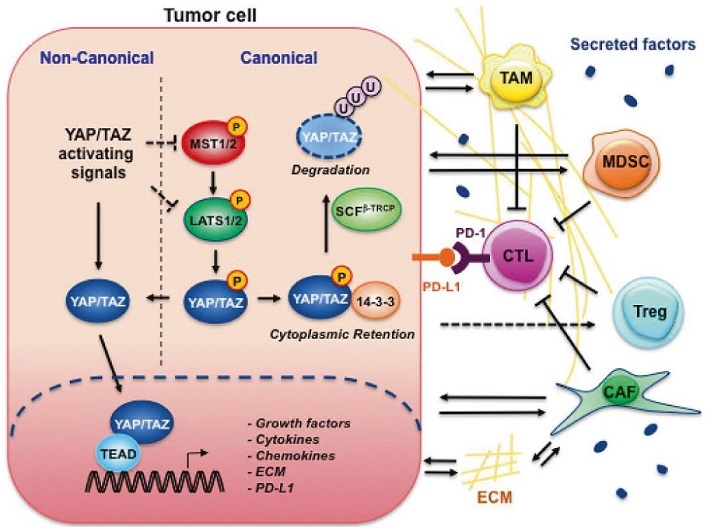
もともと臓器の大きさの中心的な発達調節因子として特定されたHippo-Yap / Taz経路は、多くのタイプのヒト腫瘍細胞に存在し、腫瘍の成長、生存、回避、転移、幹細胞性、および薬剤耐性に関連している。これらの腫瘍細胞固有の機能に加え、Hippoシグナル伝達系は重要な免疫調節の役割を果たしている。
Hippoシグナル伝達系は、腫瘍細胞を適応免疫システムと自然免疫システムの両方に接続する重要な橋渡しとして機能しおり、Hippo-Yap / Taz経路に対する今後のすべての治療開発では、成長調節機能に加え、腫瘍免疫の調節における多面的な役割を考慮する必要がある。
腫瘍細胞では、標準的なHippo経路の抑制、または非標準的な活性化シグナルのいずれかによって活性化されたYap and/or Tazは、核に移行し、Teadファミリーの転写因子と結合し、成長因子、サイトカイン、ケモカイン、細胞外マトリックス(ECM)、PD-L1などの遺伝子発現を促進する。PD-L1は細胞膜に移行しCTLなどに結合する。
Oncogene 2019 38 2899-2909
参:肺癌、結腸直腸癌、卵巣癌、肝臓癌、前立腺癌などの様々な癌腫でHippo経路からのderegulationが報告されている。Yap1過剰発現は、非小細胞がんのケースにおいて60-70%で報告され、YAPの活性化が病期の重症化、リンパ血管系への浸潤、予後の悪さと関連している。YapとTazは肺の発達と恒常性には必要であるが、成人の肺には必要ではない。Yap欠損KrasG12D:Lkb1Lマウスの腫瘍形成は大幅に減少し、Tazのconstitutive発現により免疫不全マウスに不滅化した気管支細胞が腫瘍を形成し、KrasG12Dノックインマウスにおいて異所性にYapを発現させると肺腺癌が急速に発育する。EGFR変異非小細胞肺癌マウスでは、Yapの発現増強によりEGFR TKI抵抗性が生じる。
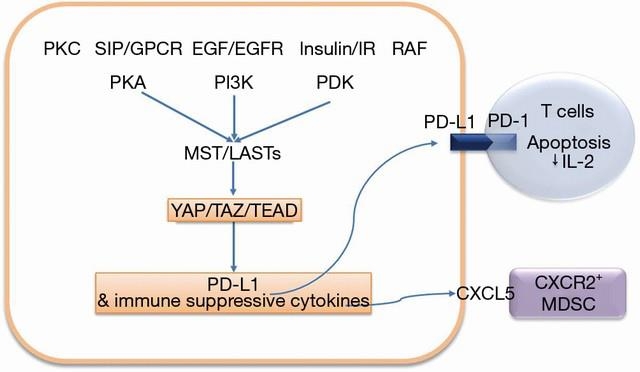
Hippo経路による免疫回路の促進
Tazの過剰発現(またはMst1/2またはLasts1/2のノックダウン)は、Taz-low/PD-L1-low細胞株のPD-L1発現を増加させ、Tazの欠損(またはLats1/2過剰発現)は、Taz-high/PD-L1-high細胞株のPD-L1を減少させる。誘導されたTaz発現を有する癌細胞はPD-L1を介したT細胞アポトーシスを促進し、T細胞IL-2産生を抑制する。Tazを過剰発現した肺ガン細胞でPD-L1をブロックすると、T細胞のアポトーシスを抑制し、T細胞のIL-2の発現をレスキューする。
http://jtd.amegroups.com/article/view/26594/html
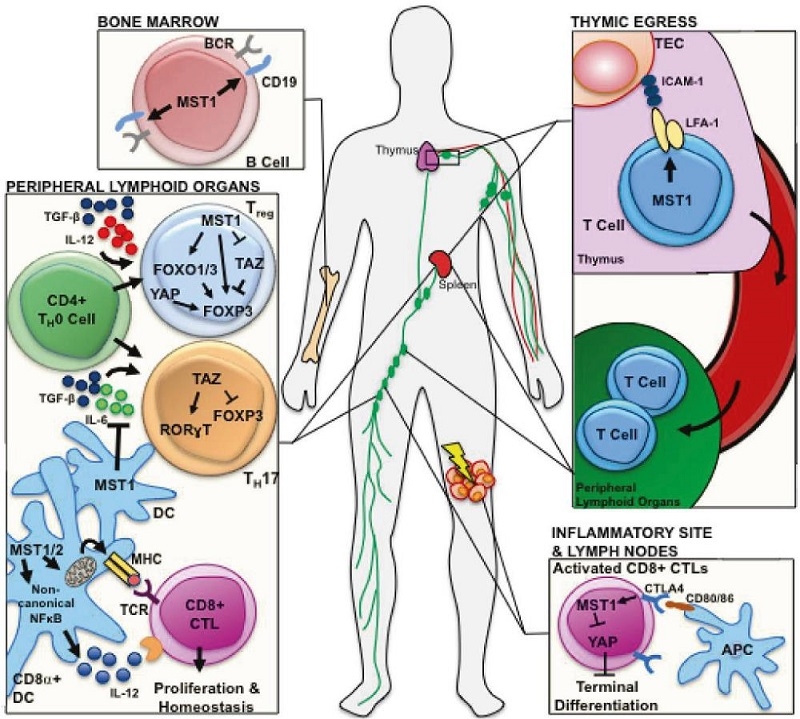
リンパ球の発生において、Mst1はBsaiboudeno CD19の発現を促進し、LFA-1膜のクラスター化とICM-1陽性胸腺上皮細胞(TEC)との相互作用を促進することにより、T細胞の胸腺の移動と退行を誘導する。CD4+T細胞の分化中、Mst1はTaz依存性及び非依存性の両方のメカニズムを介してTreg転写因子Foxp3の発現を促進する。
Oncogene 2019 38 2899-2909
がん治療による心筋症と虚血の管理のベストプラクティス。
アントラサイクリン系化学療法薬は、用量依存的に心毒性を引き起こす。トラスツズマブをアントラサイクリンと併用すると、通常、重大な心毒性生じるが、これらの薬物の併用を避けることで予防できる。5-FUおよびVSP阻害剤は、特に既存のCADの患者で心虚血を引き起こす可能性がある。リスクの高い患者では、治療の前に虚血性心疾患の精密検査がを行うべきである。
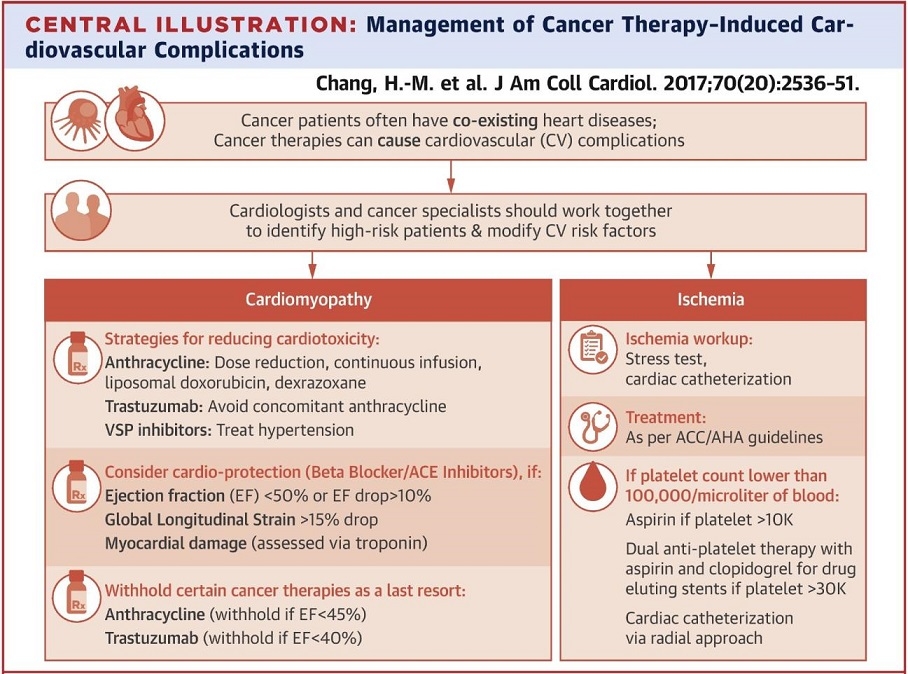
JACC 2017 70 2536-51
新たに開発された標的療法薬は、高血圧、血栓塞栓症、QT延長、心房細動といったoff-target効果を示す。放射線療法は動脈硬化を促進させ、治療の数年後に心臓の弁、伝導系、心膜に損傷を与える。従って癌患者の治療、とりわけ心臓に問題を持つ患者の治療を行う際には、循環器専門医が、Onco-cardiologyに興味を持つことは重要となってくる。
全身性高血圧:ガン登録患者の37%に見られるもっとも一般的な血管合併症である。高血圧は化学療法による心毒性発生の主要な危険因子であり、中途半端な血圧のコントロールが抗癌剤の治療中止に至ることがあり、ガン治療に直接影響することもある。
血管内皮成長因子シグナル伝達経路(Vascular endothelial growth factor signaling pathway:VSP)阻害剤
Bevacizumab、Sorafenib、SunitinibはVSPを標的として、血圧の上昇とともに治療効果を発揮する。Bevacizumabは4~35%、Sorafenibは7~43%、Sunitinibは5~24%の割合で高血圧の合併が報告されている。降圧薬による治療を行っても、入院や抗がん剤の中止が必要となる重度の高血圧になる可能性があり、Bevacizumabの治療例においては1.7%の患者においてそうなった。
Proteasome阻害剤:
再発性多発性骨髄腫に対してCarfilzomibを使うENDEAVOR、ASPIRE諜報の際に17%、11%に高血圧が認められ、Grade 3以上になったのが3%、6%で、2%未満であるが死亡例もある。高血圧がコントロールできない場合には、Carfilzomibは中止すべきである。
病態生理:
VEGFは、一酸化窒素とプロスタサイクリンの産生を促進する一方、エンドセリン1の生成を低下させる。VSP阻害剤は、細動脈壁における一酸化窒素の産生を阻害することにより血管収縮、末梢血管抵抗の増加をきたし、血圧上昇に寄与する。
Bevacizumabは、内皮型一酸化窒素シンターゼ活性を低下させ高血圧をもたらす。
レニンアンギオテンシン系はVFGFに影響すると考えられているが、抗VEGF治療は血清カテコラミン、レニンアルドステロン値を変化させない。
VEGFRの強力な阻害薬であるTelatinibは、毛細血管の希薄化を誘発する。
Carfilzomibは、アセチルコリンによる血管拡張反応を減弱させ、ニトロふりセリンにより治療可能な血管攣縮を誘発する。つまり血管内皮機能障害によるって生じていると考えられる。
心膜疾患:
心嚢液貯留は、癌の後期に発生し5~15%の患者にみらえる。肺癌、乳癌、白血病、悪性リンパ腫に多くみられる。肺癌に比較し、乳癌やリンパ腫の予後は良い。
リンパ管や血液を介した転移や直接的なガン細胞の浸潤により生じるものが多いが、化学療法や放射線療法の副作用や日和見感染からも発生する。
化学療法剤としては、anthracyclines、cyclophosphamide、cytarabine、imatinib、 dasatinib、interferon-α、 arsenic trioxide などで多く見られ、頻度は低いがdocetael、5FUでも見られる。
血栓塞栓症:
癌患者の血栓症は組織因子、ムチン、四ステインプロテアーゼなどの凝固紳士カスケードを活性化する因子が循環血液流に放出されることにより生じる場合が多い。動脈血栓塞栓症のリスクは、がん診断後の最初の6ヶ月が高く、1年後にはベースラインに戻る。肺癌、膵癌、結腸-直腸癌、腎癌、前立腺癌や、転移性ガン、中心カテーテルの使用、浮動、心不全、心房細動、低循環血液量、抗がん剤治療などの特定の危険因子があった場合に、血栓塞栓症発症のリスクが高い。
がん患者におけるDOACの治療効果は、ほとんどの臨床試験でガン患者が除外されているためデータが少なく、LMWHが最適な抗凝固剤といえる。
Rivaroxabanがガン関連VTEに安全かつ有効であったという小規模な前向き研究がある(J Thromb Thrombolysis, 43 (2017), pp. 166-171)。
QT延長:
QT延長は脱分極/再分極の以上によって引き起こされ、torsades de pointes (TdP)や突然死につながる可能性がある。
Arsenic trioxide aとTKIsは治療後にQT延長が出現する可能性がある。制吐剤、H2ブロッカー、PPI、抗菌薬、抗精神病薬もQT延長するものがあり、ガン治療中・後の吐き気・呕吐、および下痢によりカリウムとマグネシウムの喪失が引き雄壊れると、よりQT間隔が延長されるので注意が必要である。
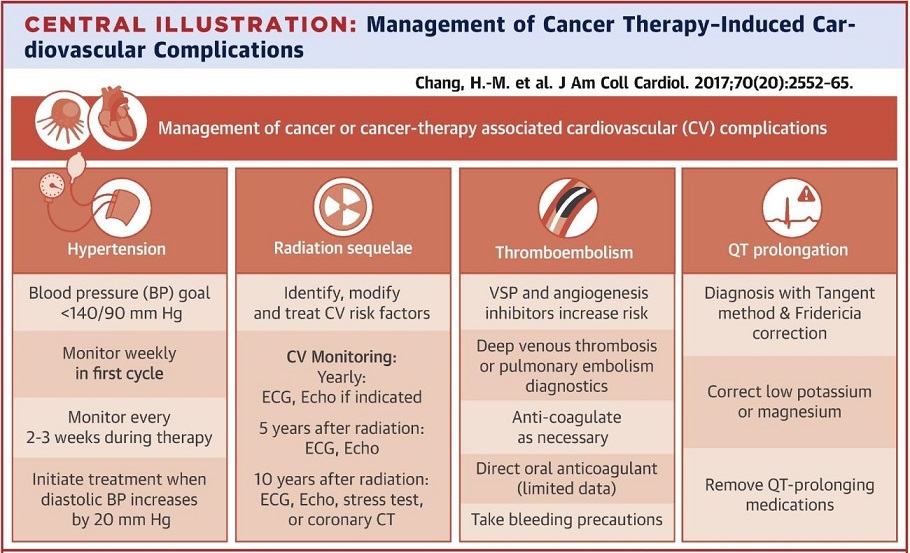
JACC 2017 70 2552-65
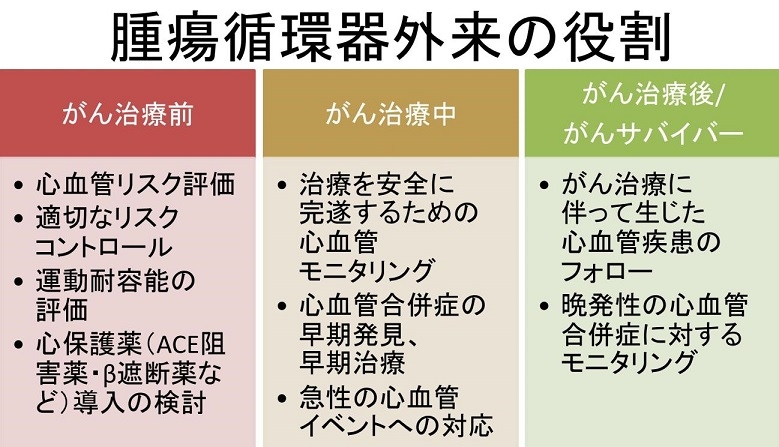
腫瘍循環器外来の役割は
がん治療前:心血管リスク評価、適切なリスクのコントロール、運動耐容能の評価、心保護薬の導入検討
がん治療中:心血管のモニタリング、合併症の早期発見・早期治療、急性イベントへの対応
がん治療後/ガンサバイバー:癌治療に伴って生じた心血管疾患の治療・フォロー、晩発性合併症に対するモニタリング
がある。
心臓リハビリスタッフは、患者のベースラインのリスク(肥満、高血圧、加齢)、治療による障害、治療に伴う健康状態の変化を理解し、心肺機能のFitnessの向上、QOLの向上、疲労感の回復、心血管リスクファクターの改善を目指す。
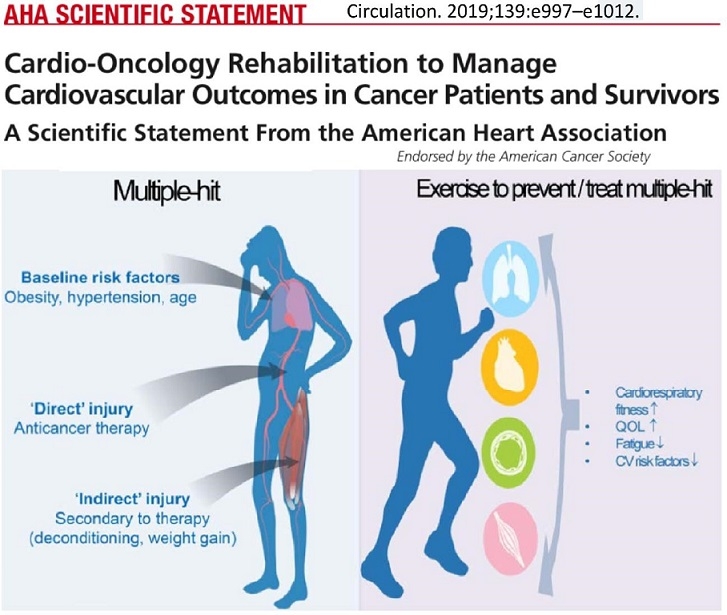
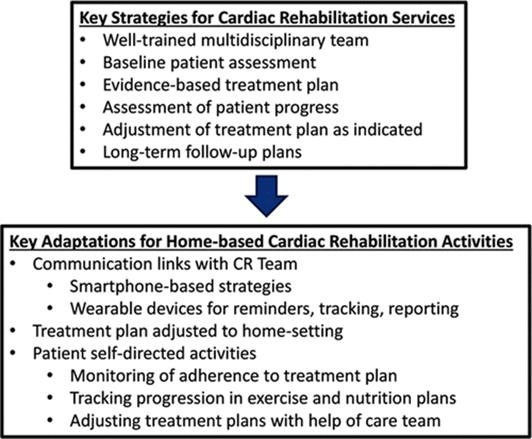
Circulation 2019 139 e997-1012
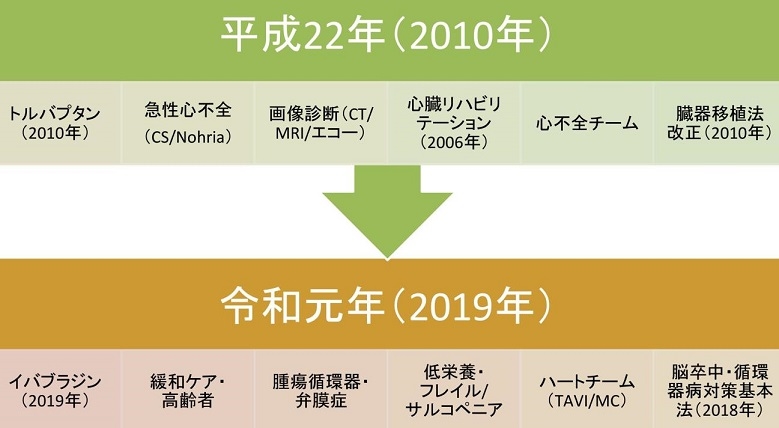
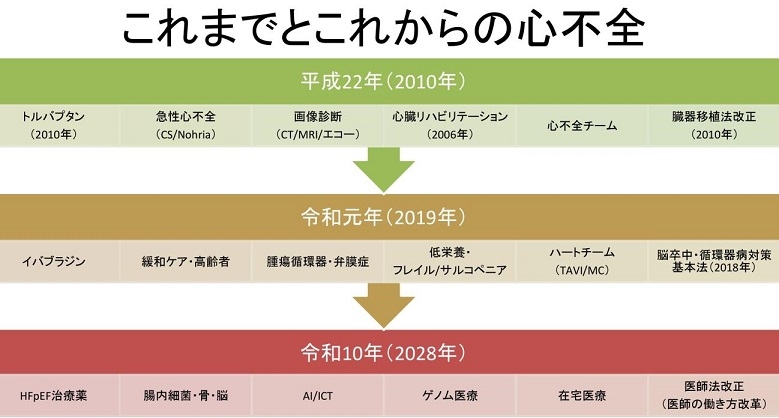
循環器の治療の変遷の中で、2010年には臓器移植法が改正され、薬剤としてはトルバプタンが使用可能となり、急性心不全の治療に対して心不全チームを作り総括的に治療を行うようになったが、2018年委は脳卒中・循環器病対策基本法が制定され、2019年にイバプラジンが使用可能となり、緩和ケア・高齢者治療に目を向け、低栄養・フレイル/サルコペペニア対策が掲げられ、腫瘍循環器・弁膜症に対して力が入れられるようになり、ハートチームが各病院で結成されている。
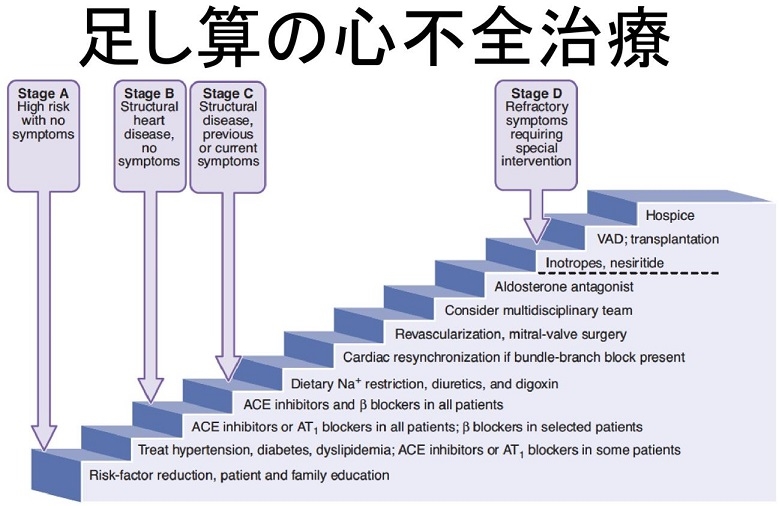
心不全の治療は、基本的には、患者や家族の教育に加え、いろいろな治療が足し算されて行われてきているのが現状である。
左室駆出率が低下している患者で、亢進している神経ホルモン活性、構造的異常と心不全症状が改善する駆出率が低下している心不全(HFrEF)患者は、HFiEF(heart failure with improved ejection fraction)と考えるべきである。
1. 左室駆出率の改善の要因が示されている。これらの患者は再発性の心筋症を発症するリスクがあるので、ガイドラインにのっとった心不全の治療継続が必要である。
2. HFrEF再発の特徴が示されている。分娩時心筋症(PPCM)、劇症型心筋症、タコつぼ型心筋症のような特殊な心筋症の場合、構造や機能が正常になり、左室駆出率が正常化した症例もある。(最近は異なったデータも出てきている。)
3. これらの患者は薬剤中止が可能である可能性があるが、定期的に心電図やバイオマーカなどによるモニターが必要である。
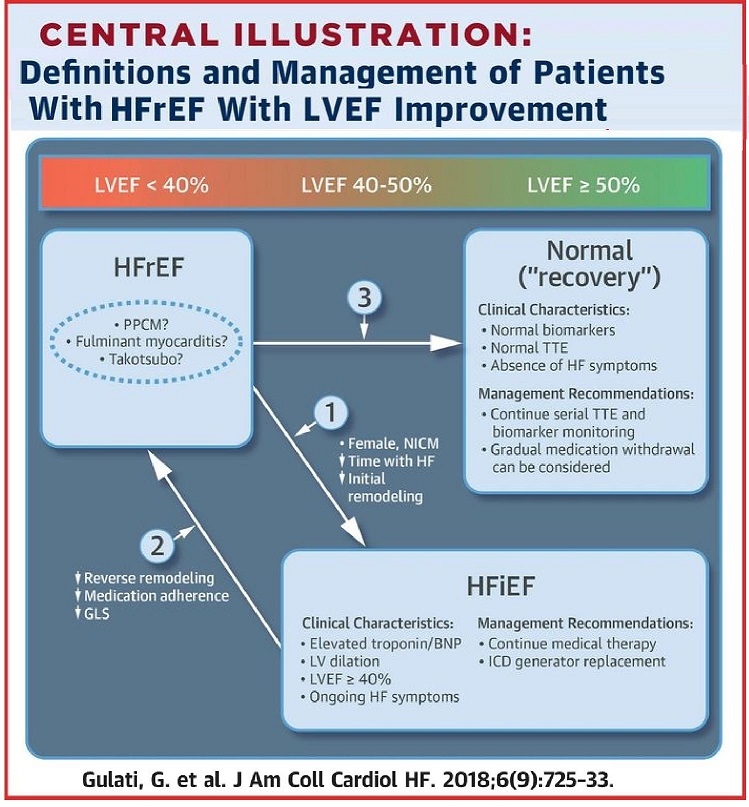
JACC 2018 6 725-33
症状・心機能が回復した拡張型心筋症患者(LVEFが40%未満から50%以上に改善した症例でNT-pろBNO<250ng/L)51例でControlの治療継続群26例と治療中止群25例で経過を見たところ、半年以内のDCM心不全指標の悪化の一次エンドポイントに治療中止群は11例44%が達した。この研究によるとDCM心不全患者においては治療中止すべきではないという結果となった。
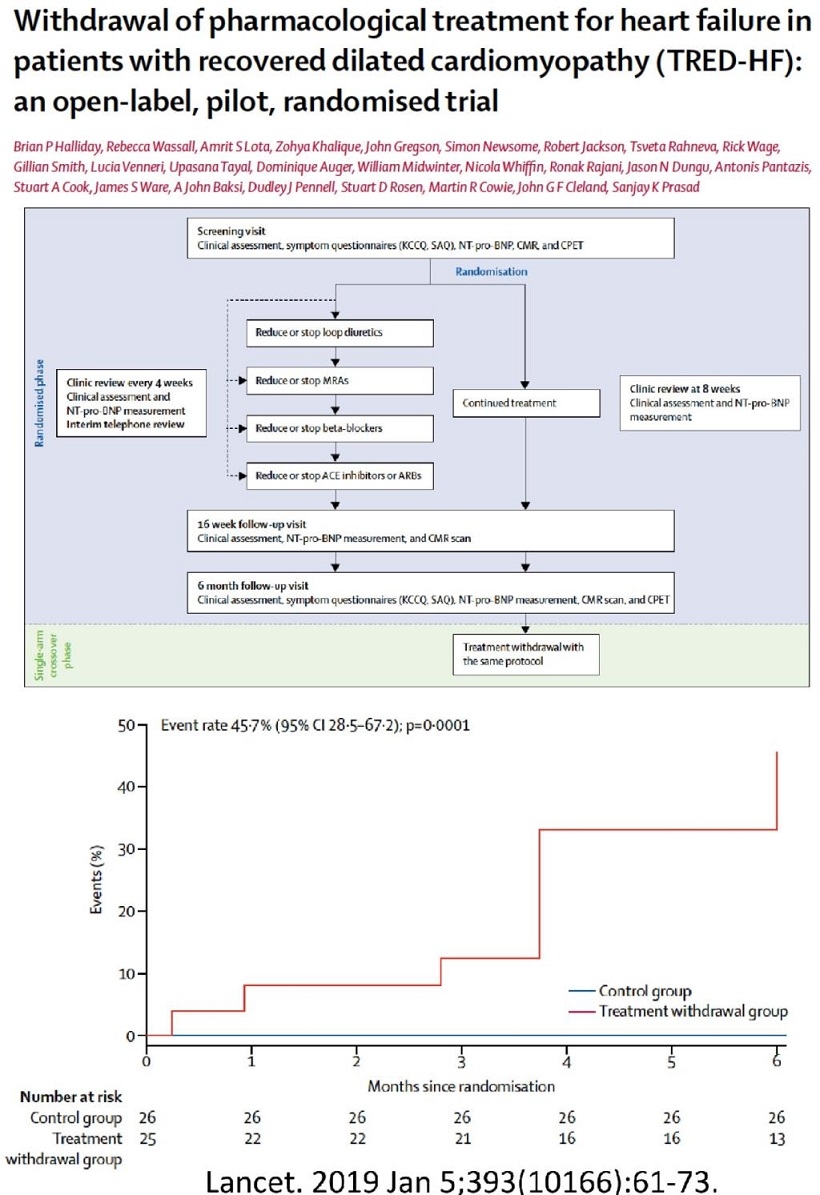
Lancet 2019 393 61-73
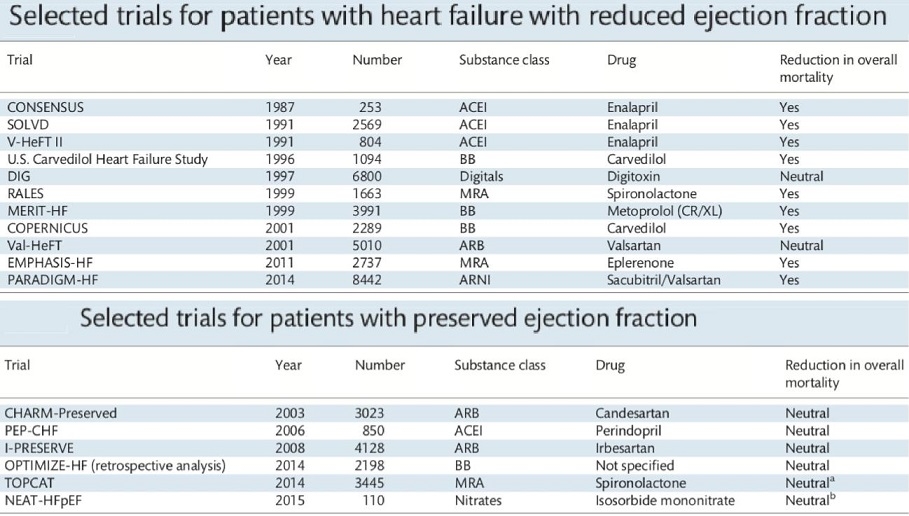
HFrEFの治療としてはACEIやβブロッカーやMRAなどが有効であるというトライアルが幾つか報告されているが、HFrEFに関しては、有効薬は報告されていない。
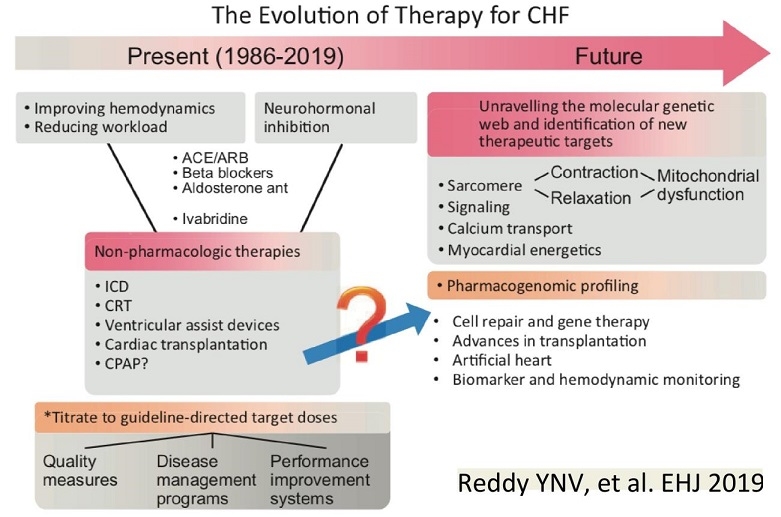
現在の治療は、循環動態を改善し、仕事を減らすために、ACE/ARB、βブロッカー、抗アルドステロン薬、Ivabridinなどの薬剤のほか、ICD、CRT、左室機能補助具、心臓移植、SASの合併している症例に対してCPAPを行い、生活の質を評価し、疾患対応プログラムを作成し、パフォーマンスを良くするシステムを作成してきた。これからは、ミトコンドリアの機能不全によるサルコメアの収縮や弛緩、シグナリング、カルシウム輸送、心臓のエネルギー理論などの遺伝分子学の研究結果から、患者個人の遺伝的特性による薬理作用の差を念頭に置き、細胞の修復、遺伝子治療、移植を推進し、人工心臓の活用、バイオマーカーや循環動態のモニタリングの開発が推進していくと思われる。
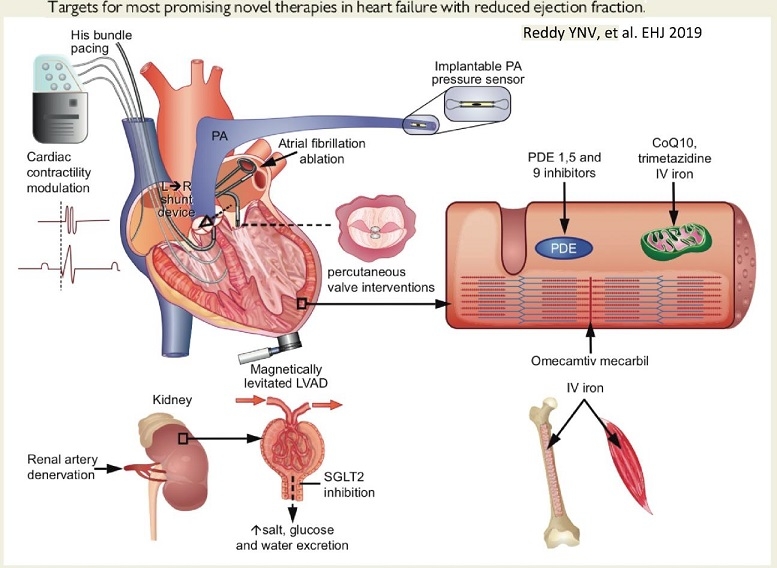
HFrEFのち医療として、ヒス束ペーシングや肺動脈圧センサーの植め込み、心房細動アブレーション、左右シャント治療デバイス、経心膜弁治療、補助人工心臓、腎動脈除神経治療、SGLT2阻害薬、PDE 1,5 and 9阻害薬、CoQ10、Trimetazidine(バスタレル:心筋代謝改善薬)、Omevamtive Meacrbil(心臓ミオシン・アクチベーター)などがある。
poly(ADP-ribose)(PAR)とγ-H2A.XのDNA損傷マーカーを58人の拡張型心筋症患者で心筋核染色し評価した。Left ventricular reverse remodeling(LVRR)のある患者は、LVRRのない患者に比較して、心筋生検標本のPARとγ-H2A.Xの陽性核の割合が有意に少なかった。LVRRの可能性を予測するのにDNA損傷マーカーの染色が有用であることが示された。
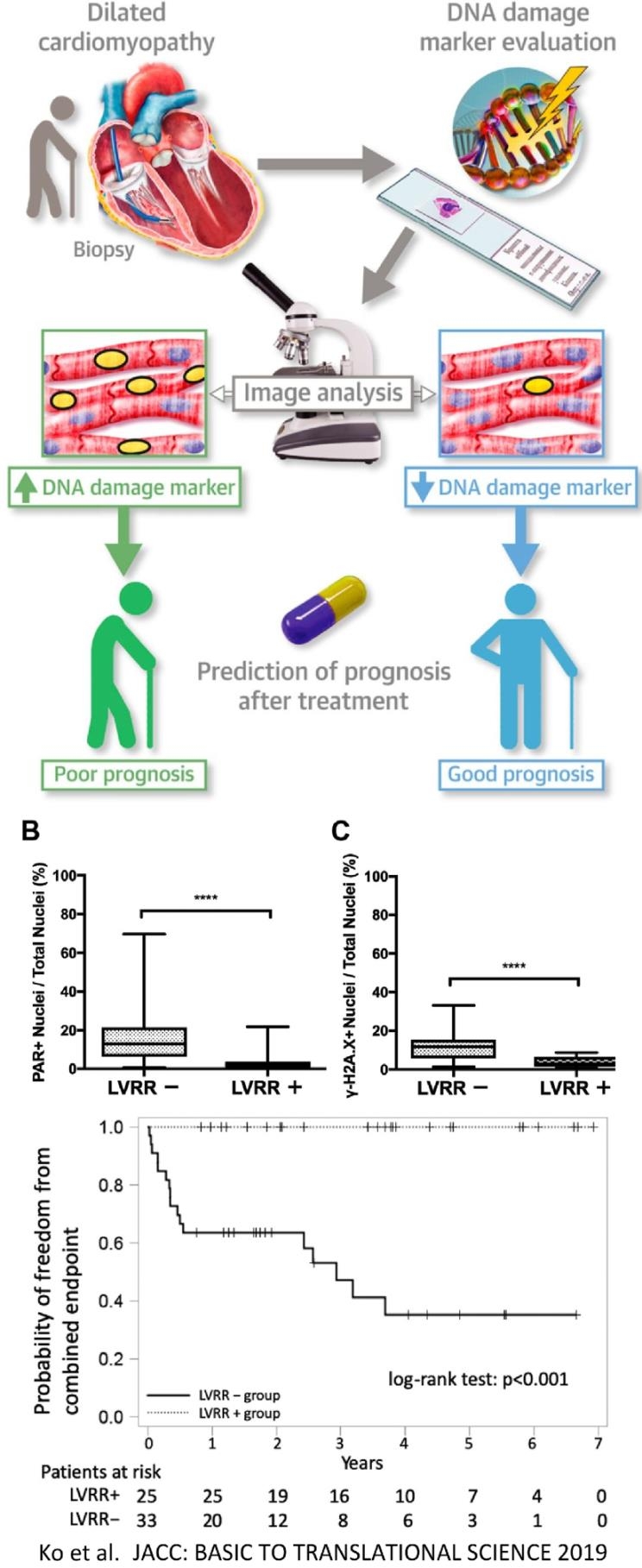
J Am Coll Cardiol Basic Trans Science 2019;4(6):670-80
これからの心不全の治療は、HFpEFについても治療できるように、腸内細菌の研究結果などを踏まえ、AIやICTを駆使し、ゲノム医療を中心とした医療の推進と、在宅医療の充実が必要であり、医師の働き方改革を含めた医師法の海棲も必要である。
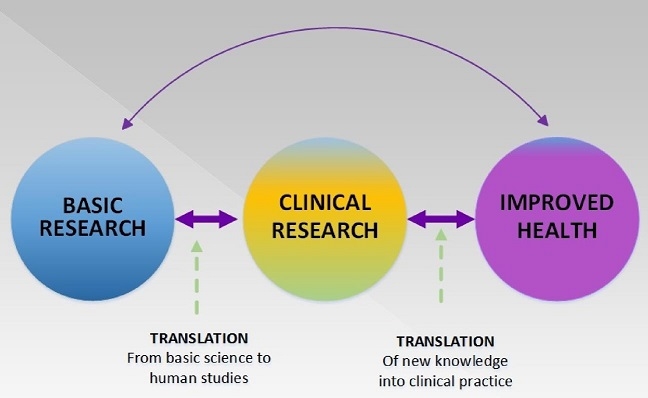
人に関する基礎研究結果と臨床に実践できる新しい知見を含んだ臨床研究の結果を健康の改善に生かすことが重要である。