クリニックからのお知らせ
2025.01.19
小児のアトピー性皮膚炎を考える 只木弘美先生
2024年11月28日
演題「小児のアトピー性皮膚炎を考える」~デュピルマブがもたらした新しい治療戦略~
演者:横浜医療センター 小児科 部長 只木 弘美 先生
場所: 横浜ベイホテル東急
内容及び補足「
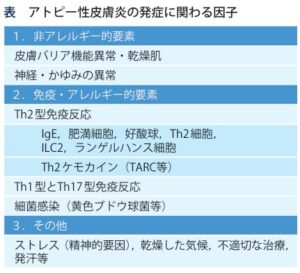
アトピー性皮膚炎の定義・診断基準
- 掻痒
- 特徴的皮疹と分布
- 慢性・反復性経過
の3基本項目を満たすものを、症状の軽重を問わずアトピー性皮膚炎と診断する。
疑診例では急性あるいは慢性の湿疹とし、年齢や経過を参考にして診断する。
除外すべき診断としてあげられた疾患を充分に鑑別でき、重要な合併症としてあげられた疾患について理解していることが重要である。

参:
皮膚の過敏
- 角質の異常:角質は皮膚の表面・最外層に存在する厚さ10~20μmの薄い膜状の構造物で、十数層の角質細胞とその間を埋める角質細胞間脂質により構成され、体液の漏出防止、角層内水分保持、および生体防御に貢献するバリアを形成している。
角層のバリア機能障害は
表皮でのサイトカイン産生を増強し、ランゲルハンス細胞を活性化させ、抗原感作や炎症を生じやすくさせ、比特異的な刺激に対する皮膚の非刺激性を亢進させる。
角質細胞間脂質の主成分は、セラミド、コレステロール、遊離脂肪酸であるが、アトピー性皮膚炎では、セラミド含有率の異常な低下により、角質細胞間脂質の機能が低下し、主に水分の保持能力が低下する。
ケラチンやフィラグリンを実質とする角質細胞は、周辺帯と呼ばれるタンパク質で細胞膜が裏打ちされているため構造的に頑丈であり、強固なバリアを形成している。フィラグリンの機能喪失型遺伝子変異や炎症に伴う発現の低下がアトピー性皮膚炎で確認されている。
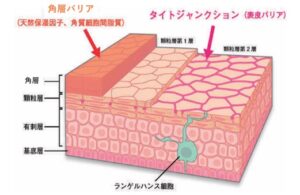
表皮細胞には間隙のないようにタイトジャンクションと呼ばれる細胞間接着構造がある。顆粒層に存在するタイトジャンクションは、泰内外の物質の移動を制御しており、その形成に重要な役割を持つclaudin-1の発現低下や一塩基多型の存在がアトピー性皮膚炎患者で確認されている。
炎症機構:
過敏な皮膚に様々な外的刺激が加わると、表皮角化細胞からinterleukin(IL)-33、IL-25、TSLPが産生・放出され、2型自然リンパ球やTh2細胞を活性化して2型炎症を誘導し、IL-4、IL-5、IL-13、IL-31が産生される。皮膚バリア機能の低下は抗原(アレルゲン)の皮膚への浸入しやすさが上昇する。非自己である抗原は免疫応答により排除され、過剰な免疫応答はアレルギー反応を引き起こす。
アレルゲンは、蛋白抗原としてのみならず、ダニ抗原のようにプロテアーゼ作用によっても2型炎症を誘導する。
2型炎症は、アレルゲン特異的IgEを誘導し、ランゲルハンス細胞、マスト細胞は、IgE高親和性受容体(FCERI)を発現し、アレルゲン特異的IgEを介して、 サイトカイン、ヒスタミンなどの化学伝達物質を放出し、炎症を惹起する。
さらにそのような炎症かにおいて、病変皮膚ではTARCが産生され、Th2細胞の病変部への浸潤が促される。Th22細胞は活性化した樹状細胞によって皮膚に遊走するとIL-22を産生し、表皮肥厚を誘導する。
掻痒:『掻きたい衝動を引き起こす不快な皮膚の感覚』
アトピー性皮膚炎の慢性の痒みは病態を形成する主要症状の一つであり、患者の生活の質を大きく損なう。痒みに対する掻爬は、皮膚バリアを障害し、炎症を助長する。
ヒスタミンは主に組織に常在するマスト細胞から放出される活性型アミンで、アトピー性皮膚炎病変部の組織中に高濃度のヒスタミンが存在する。ヒスタミンは、感覚ニューロン状のヒスタミン1型受容体(H1R)を活性化し急性の痒みを誘発する。
TSLPとIL-33は皮膚の乾燥、搔爬、または、化学的に刺激にさらされた表皮から放出されるサイトカイン、2型炎症の引き金となるほか、感覚ニューロンへ直接作用して痒みを誘発する。
IL-31は感覚ニューロンを直接刺激することで急性の痒みを引き起こす物質として同定され、痒みの免疫-神経相関に関する代表的なサイトカインである。
IL-31は皮膚の神経過敏現象も促進し、抗IL-31受容体Aモノクローナル抗体は中等度から重度のアトピー性皮膚炎患者の痒みの改善に有効である。
IL-4とIL-13は、いずれもIL-4受容体α(IL-4Rα)に作用するサイトカインで、抗IL-4Rαモノクローナル抗体治療で蓄積されたエビデンスにより、アトピー性皮膚炎におけるエフェクター分子としての重要性が確固たるものとなった。IL-4Rαは感覚ニューロンに発現しており、IL-4とIL-13の双方ともin vitroでこれらのニューロンを直接活性化する。IL-31、ヒスタミン、TSLPなどの起掻物質に対する感覚ニューロンの感受性を増強することで慢性の痒みにかかわる。
また、アトピー性皮膚炎の痒みの誘発には、中枢神経の関与も考えられていて、痒みを想起するような視覚的/聴覚適刺激により掻きたい衝動に駆られる痒みは、皮膚を介さず中枢神経で誘発されており、アトピー性皮膚炎患者は健常対照者に比べてこの反応が強く顕著である。
発症因子・悪化因子
悪化因子としては、治療へのアドヒアランス、職場および日常生活環境における抗原や刺激物の暴露、ライフスタイルと温度や湿度といった環境因子、皮膚の生理機能の変調がある。
アトピー性皮膚炎の痒みの誘発・悪化因子として、温熱、発汗、ウール繊維、精神的ストレス、食物、飲酒、感冒などが重要である。
疫学
1994~1996年に実施されたInternational Study of Asthma and Allergies in Childhood (ISAAC)による疫学調査では、56カ国を対象にしたもので、6~7歳は、イランの1.1%からスウェーデンの18.4%(平均で7.3%)で。13~14歳では、アルバニアの0.8%~ナイジェリアの17.7%(平均で7.4%)であった。
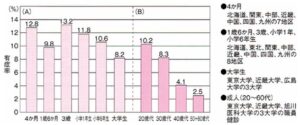
我が国のアトピー性皮膚炎が一般に乳幼児・小児期に発症し、加齢とともにその患者数は減少し、一部の患者が成人型アトピー性皮膚炎に移行すると考えられている。1992年から2002年の間の皮膚科医の健診によるアトピー性皮膚炎有症率調査に関する文献14編の解析によると、年齢別の有症率は、乳児で6~32%、幼児で5~27%、学童で5~15%、大学生で5~9%途方こく者により幅があるが、全体的には加齢とともに有症率は減少する。
2000~2002年度厚生労働科学研究の一環として、保健所および小学校検診での医師の診断による全国規模のアトピー性皮膚炎有症率調査では、4ヶ月児12.8%(351/2744)、1歳6ヶ月児9.88%(631/6424)、3歳児13.2%(906/6868)、小学校1年生11.8%(1479/12489)、小学校6年生10.6%(1185/11230)、大学生8.2%(684/8317)であった。
2006~2008年度厚生労働科学研究の、成人のアトピー性皮膚炎有症率を東京大学、近畿大学、旭川医科大学の大学職員4826名を対象に健診による有症率調査では、年代別有症率は、20歳代が10.2%、30歳代が8.3%、40歳代が4.1%、50+60歳代が2.5%であった。男性が5.4%、女性が8.4%と女性に高い傾向が見られた。
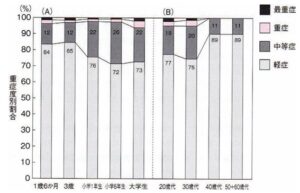
重症度
中等症以上の割合を年齢別で見ると、1歳6ヶ月児16%、3歳児15%、小学一年生24%、小学6年生28%、大学生27%で、有用時期よりも学童期において症状が悪化する傾向が見られた。また、重症以上の占める割合は年齢が上がるにつれて上昇する傾向が見られた。
成人では、20歳・30歳代に比べ40歳代以降では中朝症や重症以上の割合が減っていた。
アトピー性皮膚炎診療ガイドライン2024
https://www.jstage.jst.go.jp/article/dermatol/134/11/134_2741/_pdf/-char/ja
オーストリア、フィンランド、フランス、ドイツ、スイスの農村地域の子供を対象に2002年8月から、2005年3月までの妊娠中の妊婦にたいして募集した、1038例の小児(女性506例)の検討では、2歳未満で発症した早期一過性型(96例)、早期持続型(67例)、2歳以上で発症した後期発現型(50例)、および全くない/まれな表現型(825例)に分類できた。
早期持続型は、すべてのアレルギー疾患発症リスクが高く、早期一過性型は、食物アレルギーに有意なリスクがある。後期発現型はアレルギー性鼻炎のリスクが高かった。
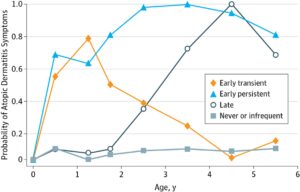
(AD:Atopic dermatitis、FA:Food allergy)
JAMA Pediatr 2017 171 655-662
https://jamanetwork.com/journals/jamapediatrics/fullarticle/2628743
https://www.zora.uzh.ch/id/eprint/145855/1/jamapediatrics_Roduit_2017_oi_170016.pdf
参:
ALSPACコホート試験:英国の小児9894例(A)、PIAMAコホート試験:オランダ小児3652例(B)の出生コホート研究の結果、アトピー性皮膚炎は6種類のフェノタイプに分けられるとした。
最も一般的なタイプは、早期発症-早期官界型で、男性に多い。
早期発症-持続型、早期発症-後期寛解型は、アトピー疾患や両親の病歴、アトピー性皮膚炎の遺伝的リスクと最も強く関連していた。
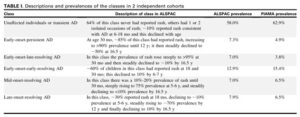
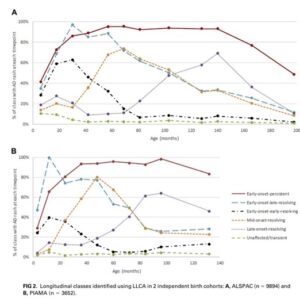
J Allergy Clin Immunol 2018;141:964-71.
https://www.jacionline.org/action/showPdf?pii=S0091-6749%2817%2931739-6
乳幼児のアトピー性皮膚炎の発症・経過については2006~2008年度厚生労働科学研究での、横浜市、千葉市、福岡市における乳幼児健診での生後4ヶ月から3歳までの追跡調査に基づく報告を見てみると、生後4ヶ月健診を受診した一般乳児の16.2%でアトピー性皮膚炎を発症していた。これらの児の70%が1歳6ヶ月で寛解していた。この調査では、3歳までの累積発症率が30%強であり、海外の報告と同様である。
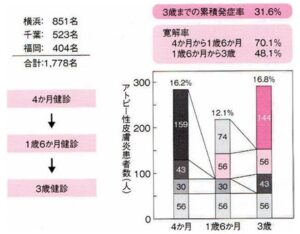
アトピー性皮膚炎診療ガイドライン2024
https://www.jstage.jst.go.jp/article/dermatol/134/11/134_2741/_pdf/-char/ja
参:Ohshimaらの報告では、1歳未満で小児アレルギー専門医によりアトピー性皮膚炎と診断された169例の乳児を4年間追跡したところ、症状は51%で改善、34%で消失していた。
渋谷らは、4歳までの出生コホート調査を行った結果、1歳時にはアトピー性皮膚炎と診断された患児40例中30例で4歳時にアトピー性皮膚炎が寛解していた。
Hamamoto-Handaらは一般集団の出生コホート調査(T-CHILD study)を行い、9年間経過を追ったところ、アトピー性皮膚炎は経過から4つの型(Never/infrequent:62.7%、Early-onset:17.8%、Late-onset:9.5%、Persistent:10.1%)に分けられることを明らかにした。彼らは他施設での一般集団コホート調査(JECS cohort)を行った結果、1歳時、2歳時、3歳時におけるアトピー性皮膚炎の有症率はそれぞれ4.0%、7.3%、6.0%であったと報告している。
阿南らは自然寛解に至っていると考えられる外来患者について家族に問診調査を行い、自然寛解は2~3歳頃から認められ、50%が自然寛解に到達する年齢は8~9歳、16歳を過ぎると全体の約90%が自然寛解すると報告している。
Katohらの成人期のアトピー性皮膚炎の予後に関する報告では、患者数は20歳代をピークに減少していき、40歳代までには約2/3が皮膚科を受診しなくてもよい程度に改善していたと報告している。
アトピー性皮膚炎診療ガイドライン2024
https://www.jstage.jst.go.jp/article/dermatol/134/11/134_2741/_pdf/-char/ja
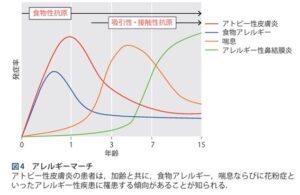
アトピー性皮膚炎の症状は食物アレルギーと相まってアレルギーマーチを生じ、児への心理的・社旗的負担・発達障害を生じるのみならず、家族へも心理的負担をかける
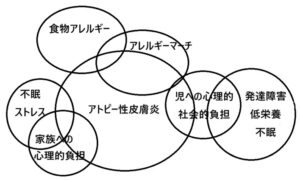
赤ちゃんの時にずっと皮膚の乾燥・湿疹が存在すると、乳児期にアトピー性皮膚炎や食持つアレルギーになる子が多く、小学校に入る前くらいから気管支ぜんそくが出てきて、中学校に入るころになるとアレルギー性鼻炎・結膜炎が増えてくる。年齢を重ねると食物アレルギーや喘息は減る症例が多いが、大人になってもこれらの症状が続く症例もいる。このように、アレルギーになりやすい体質の人が成長するにつれていろいろなアレルギー症状に悩まされることをアレルギーマーチと呼んでいる。
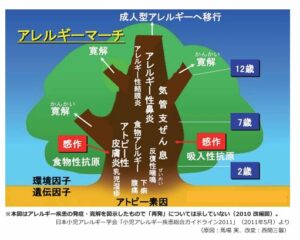
保育所におけるアレルギー対応ガイドライン(2019年改訂版)研修テキスト
二重抗原暴露仮説
従来、食物アレルギーは経口感作により成立すると考えられていたが、2008年英国小児科医Lackが二重抗原暴露仮説を提唱した(Allergy Clin Immunol 2008 121 1331-6)。食物の暴露経路には二つの経路が存在し、経口暴露は本来あるべき免疫寛容を誘導するのであって、アレルギー感作は経費暴露により生じると説いた。
皮膚炎に塗っていたピーナッツオイルがピーナッツアレルギーの発症リスクとなることがわかったことが背景にあり、表皮バリアをつかさどるフィラグリン遺伝子変異が、アレルギー疾患の発症リスクになるとの知見がこの仮説を病態面から指示している。
https://www.jstage.jst.go.jp/article/arerugi/65/9/65_1228/_pdf/-char/ja
羊水中や母乳中にも食物抗原が存在し、乳児アトピー性皮膚炎が母の食物除去で改善する例も存在し、妊娠中・授乳期の母親に食物除去を指導することで、アトピー性皮膚炎発症予防を試みられたが、その効果は、2014年に発表されたシステマティックレビューでは、妊娠中の母の抗原回避のリスク比は1.01、授乳中の抗原回避のリスク比は0.73で否定的であった(Evid Based Child Health 2014 9 447-83)。しかも、その後の検討で、妊娠中の抗原接種がこのアレルギー性疾患を抑制するという報告(J Allergy Clin Immunol 2014 133 1373-82)や、授乳中に母親が卵を摂取することで児の卵特異的IgG4交代が誘導されるという結果が報告(Clin Exp Allery 2016 46 1605-13)されるようになり、妊娠中・授乳中の食物除去はより慎重に指示する必要があると考えられるようになってきた。
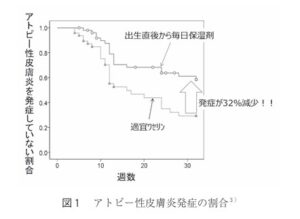
皮膚のバリア機能異常を保護する保湿剤を発症前より定期的に塗布し、アトピー性皮膚炎の発症予防を行う研究が行われるようになった。
両親もしくは兄弟にアトピー性皮膚炎の既往があるハイリスク新生児118例を、生後一週間以内に介入群59例(乳液タイプの保湿剤を毎日全身に一日一回以上塗布)と対象群59例(悪化部位のみにワセリンを塗布)にランダムに割り付け、生後32週までのアトピー性皮膚炎の発症を評価した。保湿剤を塗布した介入群でアトピー性皮膚炎の発症が32%有意に抑制された。
それ以外の大規模介入試験も進行している。
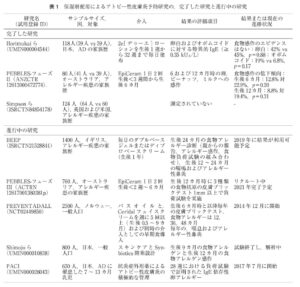
アレルギー 67 1405-1411 2018
https://www.jstage.jst.go.jp/article/arerugi/67/10/67_1405/_pdf/-char/ja
参:ダブルスイッチ数理モデル
元に戻りえる可逆スイッチ1と元に戻らない非可逆スイッチ2の二種類のスイッチで発症メカニズムを表現している。
炎症を発症させるスイッチ1が繰り返されることで非可逆スイッチ2がオンになり、アトピー性皮膚炎が増悪するとするモデルで、保湿剤などの治療で可逆スイッチ1の頻度を減らすこと非可逆スイッチ2がオンとならないようにすることと、非可逆スイッチ2がオンになる前の皮膚バリア・炎症/免疫系の異常を早期にスカムバイオマーカーも必要と考えられる。
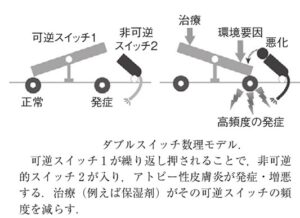
つまり、アトピー性皮膚炎や他のアレルギー性疾患の発症には、外部からの異物侵入を防ぎ、体内の水分蒸発を防ぐ「皮膚バリア機能」の低下が関係している。
国立成育医療研究センターでは、新生児期からの保湿剤の使用がアトピー性皮膚炎の発症を予防できるかもしれないという仮説を立て、ランダム化比較試験を行った。
両親もしくは兄弟に少なくとも一人以上のアトピー性皮膚炎の既往歴があり、アトピー性皮膚炎の発症リスクの高い新生児を対象に、1日1回保湿剤を全身に塗布するように指導した介入群と、乾燥した局所のみワセリンを塗布した非介入群に割り付け、アトピー性皮膚炎の累積発症率を比較した。
32週間におけるアトピー性皮膚炎の発症者数は、介入群が非介入群よりも有意に少なかった。
https://www.jschild.med-all.net/Contents/private/cx3child/2019/007806/023/0584-0587.pdf
参:アトピー性皮膚炎の病態の基本
アトピー性皮膚炎は皮膚の生理学的異常(バリア機能異常・乾燥)と炎症・免疫応答異常、さらには痒みと搔爬が複雑に絡み合って発症する。
皮膚ケラチノサイトから産生・放出されるThymic stromal lymphopoietin:TSLPやIL-33は、2型自然リンパ球やTh2細胞・樹状細胞の相互作用に働きかけ、2型自然リンパ球やTh2細胞からのIL-4やIL-13の産生を促し2型炎症を引き起こす。それらのIL-4やIL-13は逆に、表皮ケラチノサイトに働きかけてフィラグリンの発現を低下させて皮膚のバリア機能を傷害し、さらに末梢神経に働きかけて痒みを誘発する。おもにTh2細胞から産生されるIL-31はアトピー性皮膚炎の痒みを引き起こす主要なサイトカインであることがわかってきて、このIL-31も表皮ケラチノサイトのフィラグリン発現を低下させバリア機能を低下させる。また、2型炎症の引き金になる表皮からのTSLPやIL-33も、直接末梢神経に作用して痒みをひき起こす。
アトピー性皮膚炎の痒みには、ヒスタミン以外の多くの掻痒物質(IL-4、Il-13、IL-31、TSLP、エンドセリン-1、ペリオスチン)が関与しており、抗ヒスタミン薬の効果はあまり期待できない。
また、アトピー性皮膚炎では、通常痒みが生じない刺激でも痒みが引き起こされる「痒み過敏」が生じており、アトピー性皮膚炎患者の皮膚では、表皮の上層・
角質直下まで末梢知覚神経線維が枝を伸ばしており、このことが痒みの閾値を低下させ、痒み過敏状態が生じていると考えられている。神経の伸長はNerve Growth Factor:NGF等の神経伸長を促す因子とセマフォリン3A等の神経反発因子との発現バランスにより調整されているが、アトピー性皮膚炎の表皮ではNGFの発現が増加する一方、セマフォリン3Aの発現が減弱している。
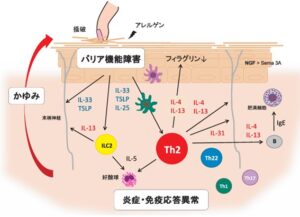
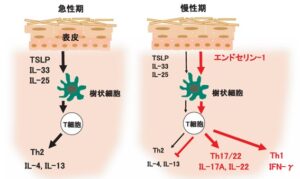
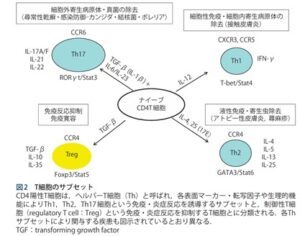
アトピー性皮膚炎の炎症は、2型炎症、Th2細胞が主体であり、Th1、TH17、Th22細胞も様々な程度で病変皮膚に浸潤し、炎症に関与している。
エンドセリン-1が直接樹状細胞を活性化すること、エンドセリン-1で刺激した樹状細胞は、T細胞からのIFN-γ、IL-17、IL-22産生を誘導する。
急性期のアトピー性皮膚炎皮膚では、TSLPやIL-22によるTh2細胞反応が中心であるが、慢性期にはエンドセリン-1の発現が増加し、樹状細胞を介してTh1、Th17、Th22細胞の反応を引き起こしている可能性がある。
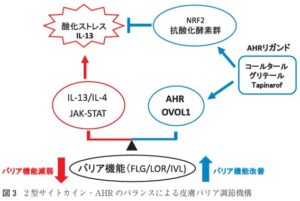
アトピー性皮膚炎では、Il-4/13などの2型サイトカインがJAK-STAT経路を介して表皮ケラチノサイトのフィラグリン発現を低下させ、皮膚バリア機能を障害している。
アトピー性皮膚炎の病態に重要なIL-4はフィラグリンを低下させ、皮膚バリア機能を傷害するが、その機序として、IL-4が転写因子OVOL1の核内移行を阻害することで皮膚バリア機能を障害していることが明らかになってきた。皮膚バリア機能の恒常性は、IL-4-JAK軸とAHR-OVOL1軸のバランスで制御されている。
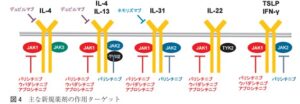
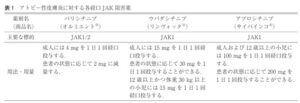
新規薬剤が多数開発されてきた。サイト間をターゲットにした生物学的製剤としては、IL-4/13をターゲットにした抗IL-4受容体抗体デュピルマブ、IL-31をターゲットにした抗IL31受容体抗体ネモリズマブがあり、低分子化合物としては、様々なアトピー性皮膚炎に関するサイトカインの主要なシグナル伝達経路JAK-STAT経路を標的とした経口JAK阻害薬が3種類、外用JAK阻害薬や外用PDE4阻害薬も発売されている。
https://api.lib.kyushu-u.ac.jp/opac_download_md/6770310/113-3_p045.pdf
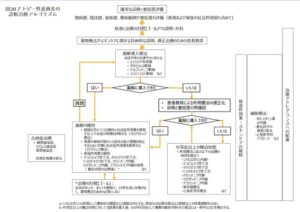
アトピー性皮膚炎診療ガイドライン2024年のアトピー性皮膚炎の診断治療アルゴリズムを下に示す。
除外すべき診断を確実に鑑別することが必要である。
確定診断後は、「アトピー性皮膚炎重症度の目安」などにしたがって、全体の重症度を評価する。
現病歴、既往歴、家族歴、罹病範囲や重症度の評価が重要となる。
患者に疾患と治療の目標を説明し、患者と治療の目標を共有することが大切である。
その後、薬物療法やスキンケアに関する具体的な説明を行い、適正治療のための患者教育を行う。
アトピー性皮膚炎の治療で大切なことは、現存する皮膚の炎症と痒みを速やかに抑える寛解導入であり、そのために抗炎症外用薬であるステロイド外用薬、タクロリムス軟膏、デルゴシチニブ軟膏、ジファミラスト軟膏などを用いる。
寛解に導入できない場合には、患者教育による外用療法の適正化を行う。皮疹の重症度に適したランクの抗炎症外用薬を充分な量外用することが重要である。また、アトピー性皮膚炎の診断と重症度の再確認を行う。必要に応じて皮膚生検を行い、皮膚リンパ腫などを除外する。外用療法の適正化を行っても寛解に導入できない中等症以上の難治状態に対しては、外用療法に加えて、シクロスポリン内服、生物学的製剤(デュピルマブ、ネモリズマブ、トラロキヌマブ)の皮下注、ヤヌスキナーゼJAK阻害内服薬(パリシチニブ、ウパダシチニブ、アプロシチニブ)の内服、紫外線療法、心身医学的療法などの併用を検討する。
薬物療法
- 抗炎症外用薬
ステロイド外用薬、タクロリムス軟膏(カルシニューリン阻害外用薬)、デルゴシチニブ軟膏(Januskinase inhibitor:JAK阻害外用薬)、ジファミラスト軟膏(phosphodiesterase 4 inhibitor:PDE4阻害外用薬)の4種類がある。
ステロイド外用薬はアトピー性皮膚炎治療の基本となる薬剤であり、ココの皮疹の重症度に応じて適切な強さ(ランク)のステロイド薬を選択し、さらに病変の性状、部位により剤型を使い分け、十分に炎症を抑制するように使用する。アドヒアランスをあげるよう、患者への十分な説明、指導を行う必要がある。患者と皮疹に適したステロイド外用薬を使用し、速やかに炎症や痒みを軽減する寛解導入療法を行い、さらに保湿剤なども併用し、その寛解状態を維持していくことが大切である。4週間程度外用を行っても皮疹の改善が見られない症例、重症例に関しては、皮膚科専門医への紹介が望ましい。
武田の分類を改変したステロイド外用薬のランク表をあげる。
日本では一般的にストロンゲスト(Ⅰ群)、ベリーストロング(Ⅱ群)、ストロング(Ⅲ群)、ミディアム(Ⅳ群)、ウィーク(Ⅴ群)に分類される。このランクを指標にして、個々の皮疹の重症度に見合ったランクの薬剤を適切に選択し、必要な量を必要な期間、的確に使用することが重要である。

重症、つまり急性、進行性の高度の炎症性病変がある場合や苔癬化、後半、丘疹の多発、多数の搔爬痕、掻疹結節など等難治性病変が主体の場合にはベリーストロング(Ⅱ群)のステロイド外用薬を第一選択とする。ベリーストロングでも十分な効果が得られない場合は、その部位に限定してストロンゲスト(Ⅰ群)を選択して使用することもある。
中等症、つまり通帳度までの紅斑、鱗屑、少数の丘疹などの炎症所見、搔爬痕などを主体とする場合にはストロング(Ⅲ群)ないしミディアム(Ⅳ群)のステロイド外用薬を第一選択とする。
軽症、つまり感想および軽度の紅斑、鱗屑などを主体とする場合には、ミディアム(Ⅳ群)以下のステロイド外用を第一選択とする。
幼児、小児においては、短期間で効果が現れやすいので使用期間に注意する。

剤形の選択:軟膏、クリーム、ローション、テープ座位などの剤形の選択は、病変の性状、部位などを考慮して選択する。感想を基盤とする本性の治療には軟膏を選択するのが基本である。頭の病変には一般的にはローションを使用し、痒疹や苔癬化皮疹にはテープ剤の使用も考慮する。
投与量:
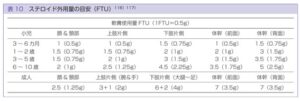
外用量 必要充分な量を外用することが重要であり、皮膚がしっとりする程度の外用が必要であり、一つの目安として、第二指の先端から第一関節部まで口径5mmのチューブから押し出された量(約0.5g:finger-tip unit FTU)が英国成人の手掌で2枚分すなわち成人の体表面積のおよそ2%に対する適量であることが示されている。使用量は皮膚の状態、外用薬の機材の種類などによっても変わりうる。
外用回数 急性増悪の場合には1日2回(朝、夕:入浴後)を原則とする。炎症が落ち着いてきたら1日1回に減らし、寛解導入を目指す。
外用部位の注意 部位によるステロイド外用薬の吸収率は前腕伸側を1とした場合に、頬は13.0,頭部は3.5、頸部は6.0、陰嚢は42とされる。
顔には原則としてミディアム(Ⅳ群)以下のステロイド外用約を使用するが、重症の皮膚炎に対しては、重症度に応じたランクの薬剤を用いて速やかに寛解させた後、前言あるいは間歇投与へ移行するように視、さらにタクロリムス軟膏、デルゴシチニブ軟膏、ジファミラスト軟膏の外用への移行に向けて努力する。
タクロリムス
タクロリムスは細胞内のカルシニューリンを阻害する薬剤であり、副腎皮質ステロイドとは全く異なった作用機序で炎症を抑制する。タクロリムス軟膏は、副作用の懸念などからステロイド外用薬では治療が困難であったアトピー性皮膚炎の皮疹に対しても高い有効性を期待できる。本剤の薬効は薬剤の吸収度に依存しており、塗布部位およびそのバリアの状態に大きく影響を受ける。特に顔面・頸部の皮疹に対して高い適応のある薬剤である。一方で、びらん、潰瘍面には使用できない。16歳以上に使用可能な0.1%軟膏と2~15歳の小児用の0.03%軟膏があり、2差未満の小児には安全性が確立していないため使用できない。
体重をもとに,0.03%軟膏の使用量は2~5歳(20 kg未満)で1 回1 gまで、6~12歳(20 kg~50 kg)では2~4 g、13 歳以上(50 kg以上)は5 gまでとされている。
デルゴシチニブ
デルゴシチニブは、種々のサイトカインのシグナル伝達に重要なヤヌスキナーゼ(JAK)阻害薬でJAK1、JAK2、JAK3およびTyrosine kinase 2すべてを阻害し、免疫細胞の活性化を抑制する。中等症以上の成人アトピー性皮膚炎患者を対象とした第3相試験でデルゴシチニブ0.5%と0.25%は機材と比べて皮疹を改善させる効果が高かった。副作用として、毛包炎や痤瘡、カポジ水痘様発疹症、単純疱疹、接触性皮膚炎が報告されている。2023年1月30日から6ヶ月以上の小児にも使用が可能となった。
ジファミラスト
ジファミラストはPDEファミリーのうち、PDE4に対して選択的な阻害作用を示す薬剤である。PDE4は多くの免疫細胞に存在しcAMPを特異的に分解する働きを持つ。PDE4を阻害することで炎症細胞や上皮細胞内cAMP濃度を高め、炎症性のサイトカインおよびケモカインの産生を抑制することにより皮膚の炎症を抑制する。副作用として、色素沈着障害、毛包炎、掻痒症、膿痂疹、痤瘡、接触性皮膚炎が報告されている。成人には1%製剤を1日2回、小児には0.3%製剤を1日2回、適量を患部に塗布する。塗布量は皮疹の面積0.1m2あたり1gをめやすとする。
非ステロイド性抗炎症薬(non-steroidal anti-inflammatory drugs:NSIDs)
アラキドン酸カスケードのシクロオキシゲナーゼを阻害し、プロスタグランジン産生を抑制することで抗炎症作用を示すが、NSAIDsの抗炎症効果はステロイド外用薬と比較すると極めて弱く、アトピー性皮膚炎に対して有効であるというエビデンスはない。
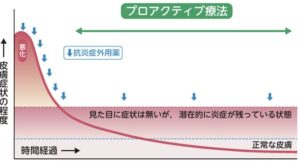
プロアクティブ療法
再燃を繰り返す皮疹に対して、急性期の治療により寛解導入した後に保湿外用薬によるスキンケアに加え、ステロイド外用薬やタクロリムス外用薬を間欠的(週2回など)に塗布し、寛解状態を維持する治療法である。
アトピー性皮膚炎では、炎症が軽快し一見正常に見える皮膚も、組織学的には炎症細胞が残存し、外的あるいは内的な要因により再び炎症を引き起こしやすい状態にあることが多い。そのような場合はTARC等の病勢を反映するマーカーが正常範囲まで低下していないことが多いが、この潜在的な炎症が残っている期間は、ステロイド外用薬やタクロリムス外用薬などの抗炎症外用薬によるプロアクティブ療法を行うことによって、炎症の再燃を予防できることが多い。
- 抗炎症内服薬
シクロスポリン
経口JAK阻害薬 パリシチニブ、ウパダシチニブ、アプロシチニブ
経口ステロイド薬
- 生物学的製剤
デュピルマブ
デュピルマブはIL-4受容体およびIL-13受容体を構成しているIL-4受容体αサブユニット(IL-4Rα)に結合し、リガンドであるIL-4およびIL-13を介したシグナル伝達を阻害する遺伝子組み換えヒトIgG4モノクローナル抗体である。
IL-4およびIL-13を介したシグナル伝達系は、2型炎症反応に寄与しアトピー性皮膚炎の病態に重要な役割を果たしている。
デュピルマブの投与は炎症を抑えるだけでなく、皮膚のバリア機能も改善する。主な副作用は、結膜炎と投与部位反応である。初回に600mg都費か投与し、その後は1回300mgを2週間隔で皮下投与する。生後6ヶ月以上の小児には体重に応じて投与量を調節する。
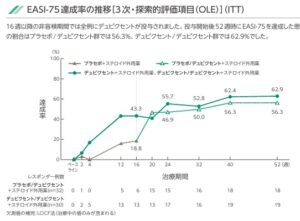
EFC16823試験:生後6ヶ月以上18歳未満の小児アトピー性皮膚炎患者を対象とした国内第3層検証的試験(ステロイド外用薬併用療法)
患者を正誤6か月以上6歳未満、6歳以上、12歳未満、12歳以上の3つの年齢層に分け、6歳以上の年齢層では、ベースラインのIGAスコアでさらに送別したうえで、デュピクセント群またはプラセボ群に1:1で無作為に割り付けし、ステロイド外用薬に上乗せして、ベースラインの体重に応じてデュピクセントまたはプラセボを16週間投与した。

16週時点においては、プラセボ群ではEASI(Eczema Area and Severity Index)-75の割合は19%であるのに対し、デュピクセント群では43%であり有意な差を認めた。
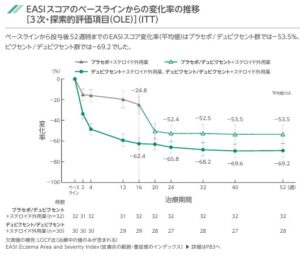
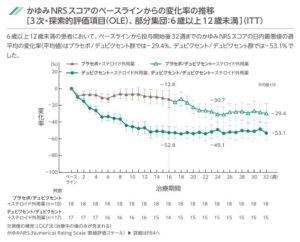
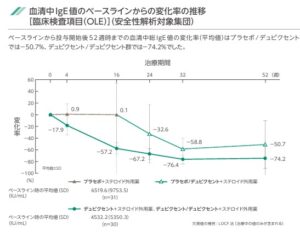
投与開始後16週までの痒みNRSスコアの日内最悪地の週平均の変化率は、プラセボ群で-12.8であるのに対し、デュピクセント群では-52.8と有意に低下していた。
血中IgE値の変化率も投与開始後16週の時点ではプラセボ群では0.1であるのに対し、デュピクセント群では-57.2と有意に低下していた。
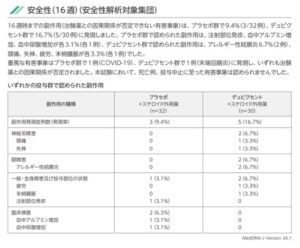
16週時までの副作用は、プラセボ群で9.4%、デュピクセント群では16.7%に発現していた。プラセボ群で認められた副作用は、注射部位発疹、血中アルブミン増加、血中尿酸増加が各1例、デュピクセント群で認められた副作用は、アレルギー性結膜炎2例、頭痛、湿疹、疲労、抹消腫脹が各1例であった。
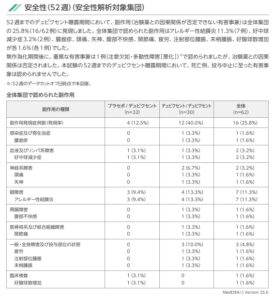
52週までのデュピクセント暴露機関において、副作用は全体集団の16例:25.8%に発現した。アレルギー性結膜炎が7例と多かった。この期間において、塩無礼、投与中止に至った有害事象は認められなかった。
https://www.e-mr.sanofi.co.jp/dam/jcr:eb72d2a0-c9d5-48c0-8371-9f972b424430/dup_summary.pdf
ネモリズマブ
ネモリズマブはIL-31受容体を構成しているIL-31受容体A(IL-31RA)に結合し、リガンドであるIL-31を介したシグナル伝達を阻害する遺伝子組み換えヒトIgG2モノクローナル抗体である。IL-31を介したシグナル伝達経路は、主に掻痒の誘発に寄与し、アトピー性皮膚炎の病態に重要な役割を果たしている。
ネモリズマブは臨床試験でプラセボに比較し掻痒を早期より有意に改善させるが、皮膚への効果発現は緩やかであった。また睡眠、労働生産性を服もQOLを早期に向上させることも示されている。副作用は皮膚感染症(ヘルペス感染、蜂巣炎、膿痂疹、二次感染など)、アトピー性皮膚炎を含む皮膚症状の悪化、上気道炎である。ただし、アトピー性皮膚炎の炎症症状とは一致しないTARC値の一過性上昇が見られ、アトピー性皮膚炎の短期病勢マーカーとしてTAECが使用できない点に留意する必要がある。
通常成人および13歳以上の小児に1回60mgを4週間隔で皮下投与する。
トラロキヌマブ
トラロキヌマブはIL-13を標的とした抗体製剤であり、IL-13とその受容体であるIL-13Rα1との相互作用を阻害することでIL-13の活性を中和する薬剤である。
臨床試験でプラセボと比較して優位に皮疹、痒み、睡眠障害、QOLを改善することが示されており、外用療法で寛解導入が困難な中等症から重症のアトピー性皮膚炎の寛解導入および寛解維持に有用である。主な副作用は結膜炎と投与部位反応である。
成人には初回600mgを皮下投与し、その後は1回300mgを2週間間隔で皮下投与する。
参:わかば皮膚科クリニックのサイトにわかりやすく表にしてくれていました。
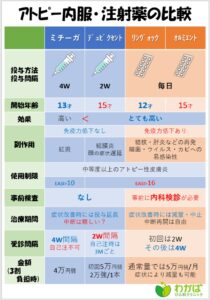
http://www.wakaba-hifuka.com/?attachment_id=7459
- その他の内服薬
抗ヒスタミン薬
非鎮静性第2世代抗ヒスタミン薬は、長期間安全に使用でき、アレルギー性鼻結膜炎や蕁麻疹など合併症の症状を緩和する効果も認められているが、抗ヒスタミン薬単剤での治療効果を検証しためた解析では信頼できるエビデンスはまだ存在していない。
抗ヒスタミン薬には、抗コリン作用や鎮静作用が比較的強い鎮静性抗ヒスタミン薬(第1世代)と、眠気・インベアードパフォーマンス(眠気の痔核を伴わない集中力・判断力・作業能率等の低下)・倦怠感などが少なく抗コリン作用のない非鎮静性抗ヒスタミン薬(第2世代)がある。中枢抑制作用に関して、脳内H1受容体占拠率の程度により、50%以上を鎮静性、50~0%を軽度鎮静性、20%以下を非鎮静性とⅢ群に分け、第2世代は概ね30%以下であることが示されている。
脳内H1受容体占拠率は臨床における薬理学的指標の一つになっている。

アトピー性皮膚炎の治療には鎮静性および非鎮静性とともに治療効果には差が見られないことから、非鎮静性第2世代効蛭田民約を選択する。
ケトチフェン(ザジテン)は癲癇またはその既往のある患者では禁忌
セチリジン(ジルテック)、レボセチリジン(ザイザル)は、転換等の痙攣性疾患またはこれらの既往のある患者では慎重投与とされている。
妊婦、妊娠の可能性のある女性ではオキサミド(セルテクト)は禁忌、メキタジン(ニポラジン、ゼスラン)、ロラタジン(クラリチン)、デスロラタジン(デザレックス)、ルパタジン(ルパフィン)投与を避けることが望ましい、

漢方薬
- 妊婦・授乳婦への配慮
妊婦、授乳中であってもアトピー性皮膚炎の適切なコントロールを行うことが重要である。まず、妊娠に気づく妊娠4週(受精から2週間)までは着床前、すなわち母体から胎児に薬物が直接移行することがない時期(All or Noneの時期)であり、基本的に薬物療法のリスクは少ない。したがって、妊娠の可能性のある患者には、妊娠を望むからといって治療を控える必要がないこと、きちんと治療を続けるべきであることを伝える。また、安全性を述べる際にも、バックグランドの奇形発生率(2~3%)があることを説明し、リスクはそれの比較であることを理解してもらうよう、インフォームドコンセントを行う。
妊娠中のステロイド外用薬の使用については、大規模な症例対対照研究または前向きコホート研究の報告やメタ解析報告では、分娩様式、先天奇形(口唇口蓋裂、尿道下裂を含む)、低修正体重、早期産、胎児死亡、分娩異常、低Apgar当について関連性はないとされている。強いステロイド外用薬の妊娠期間中の大量外用(300g以上)と低出生体重の傾向が報告されているが、そのような状態になる前に適切な皮膚炎のコントロールが重要である。
授乳中のステロイド外用薬使用は、全身への吸収が少ないという理論的根拠から安全と考えられる。ただし、乳房への外用は、授乳直前を避け、授乳前に清拭するなどの指導をする。
タクロリムスとシクロスポリンはこれまで禁忌であったが、2018年7月に添付文章が改訂され、「禁忌」の項から「妊婦または妊娠している可能性のある婦人」が削除、「妊婦」の項において『治療上の有益性が危険性を上回ると判断される場合のみ投与する』との記載となった。
- 紫外線療法
波長340~400nmのUVA1と311nmをピークとするナローバンドUVB療法の有効性を示す報告が多い。
- スキンケア
保湿外用薬
アトピー性皮膚炎では、皮膚バリア機能と保湿因子が低下している。角質層内の水分含有量は低下し、特徴的なドライスキンとなる。そのため人食い適刺激による皮膚の痒みを生じやすく、また、種々のアレルゲンの侵入が容易になり、皮膚炎を惹起しやすくなっている。保湿外用薬(保湿剤・保護剤)の使用は、アトピー性皮膚炎で低下している角質層の水分含有量を改善し、皮膚バリア機能を回復・維持することでアレルゲンの侵入予防と皮膚炎の再燃予防、痒みの抑制につながる。
ドライスキンに対するスキンケアの要点は、低下している表皮の保湿性を補うために保湿性の高い親水性軟膏(oil in water:O/W)や吸水性軟膏(water in oil:O/W)を外用することである。保湿性の高い親水性軟膏と吸水性軟膏としては、ヘパリン類似物質含有製剤や尿素製剤がある。障害された皮膚のバリア機能を補充・補強または代償するためには、白色ワセリンや亜鉛華軟膏などの皮膚に対して保護作用がある油脂性軟膏を外用する。
外用回数は1日1回の外用よりも1日2回の外用の方が保湿効果は高く、そのうち1回は入浴直後が望ましい。
アトピー性皮膚炎患者の皮膚は、病変部位だけでなく、正常に見える部分も経皮的水分喪失(transepidermal water loss:TEWL)が多く、ドライスキン状態にある。そのため、保湿外用薬は正常に見える部位も含めて全身に塗布することが望ましい。また、抗炎症作用のある外用薬などの治療で皮膚炎が寛解した後も保湿外用薬を継続して使用することは寛解状態の維持に有効である。保湿外用薬による維持療法中に皮膚炎の再燃が見られた部位には、炎症の程度に応じてステロイド外用薬やタクロリムス軟膏を使用し、炎症の早期沈静化と維持療法への回帰を目指す。まれに保湿外用薬の副作用による接触皮膚炎を生じることがあり、アトピー性皮膚炎の再燃との鑑別が重要である。

https://www.dermatol.or.jp/uploads/uploads/files/guideline/ADGL2024.pdf
「痛いの嫌よー」対策
注射液を室温にする
注射部位を冷やす
麻酔デプクリームの使用
押さえ方の工夫
ご褒美作戦
参:シンポジウム:アトピー性皮膚炎の病態と李陵の最前線:日本内科学会雑誌109巻9号
アトピー性皮膚炎は遺伝的素因も服も多因子生活慢性の疾患であるため、治療のゴールは「日常生活を不自由なく過ごせること」に主眼を置いている。
治療方針は、ステロイド外用薬やタクロリムス軟膏による抗炎症作用と、保湿剤による皮膚バリア機能の改善(スキンケア)が中心となる。
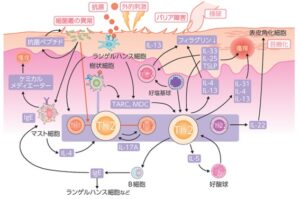
アトピー性皮膚炎の主な外来抗原(アレルゲン)は、花粉や埃等の蛋白抗原であり、蛋白抗原の暴露に対してランゲルハンス細胞をはじめとする樹状細胞が抗原を取り込み抗原特異的なヘルパーT細胞を活性化し、Th2型アレルギー反応を誘導する。
Th2環境下では、表皮角化細胞から抗菌ペプチドの産生が低下し、ブドウ球菌等の細菌やヘルペスウイルス等のウイルス皮膚感染症が合併しやすい。特にブドウ球菌は、筋そのものがアトピー性皮膚炎の症状の増悪にもつながる。
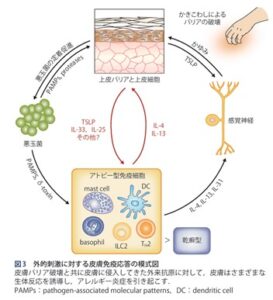
搔爬などにより表皮角化細胞より産生されたTSLPは、近傍に存在するランゲルハンス細胞に発現するTSLP受容体に作用してTh2誘導を介してIgE産生を促す。また、TSLPは、直接好塩基球に作用してIL-4の産生や増殖を促進させることにより、アレルギー発症を誘導する。
また、搔爬や物理的バリア障害により刺激された表皮角化細胞は、TSLP、IL-25、IL-33を発現する。これらのサイトカインはILC2やTh2細胞を誘導・活性化し、皮膚の免疫反応をTh2型へと誘導する。活性化したILC2+haIK-5やIL-13を分泌し、Th2が産生するIL-5とともに、好酸球を炎症局所で増殖させる。Th2細胞のケモカインであるTARCは、アトピー性皮膚炎の重症度と創刊誌、アトピー性皮膚炎の診断や病勢を把握する際の重要なバイオマーカーである。また、Th2細胞が産生するTh2サイトカインは、B細胞のクラススイッチや親和性成熟を助け、IgEを産生する形質細胞への分化誘導を促進する。
疫学的調査から、アトピー性皮膚炎の患者は、加齢とともに、食物アレルギー、喘息並びに花粉症と行ったアレルギー性疾患に罹患する傾向があることが知られており、これをアレルギーマーチまたはアトピーマーチという。
アトピー性皮膚炎の病態に関連するサイトカインと対応する生物製剤
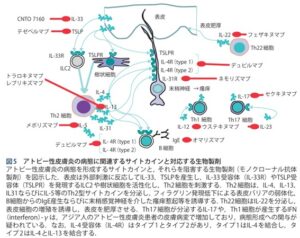
https://www.jstage.jst.go.jp/article/naika/109/9/109_1741/_pdf/-char/ja
























