川村所長の勉強会参加記録
2024.07.10
心臓再生研究を含めた心不全に対する新しい治療 家田真樹教授
2024年7月6日
演題「心臓再生研究を含めた心不全に対する新しい治療」
演者: 慶應義塾大学医学部循環器内科教授 家田 真樹先生
場所: TKPガーデンシティPREMIUM横浜ランドマークタワー
内容及び補足「
心筋細胞は再生能力が乏しいため、心疾患により心筋細胞が壊死し、線維芽細胞の増力により線維化が進行すると心臓のポンプ機能が低下して心不全に至る。心機能が著しく低下した患者に対する根本的な治療は現時点では心臓移植しかないが、ドナー不足の問題があり充分な治療が供給できていない。ES細胞やiPS細胞など多能性幹細胞を用いた再生医療が注目されている。
しかし、近年、心臓組織幹細胞から作成されると考えられていた心筋細胞が、実は心臓組織幹細胞と周囲の心筋細胞との融合によりできた、見かけ上再生していると見える心筋細胞であることが判明し、心臓組織幹細胞による心筋再生に大きな疑問が生じている。
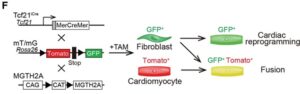
心臓再生医療を進める上で、心筋再生由来を明らかにすることは重要であり、二色の蛍光で細胞を標識できる遺伝子改変マウスを用いて心筋直接リプログラミング法において、マウス生体内で作成される心筋細胞が、真に心臓線維芽細胞由来の直接誘導により作成されたものか、あるいは心臓線維芽細胞が周囲の心筋細胞と融合してできたものかを検証した。
ホルモン剤であるタモキシフェン投与前はすべての細胞が赤で標識され、投与後には心臓線維芽細胞のみが赤色を消失して緑色に変化する遺伝子改変マウスを作成した。
タンパク質Creと変異エストロゲン受容体が融合したMerCreMerタンパク質は、通常細胞質に存在するが、エストロゲン誘導体であるタモキシフェンと結合することにより核内に移行し、特定のDNA配列であるloxP配列に対して組み替えを起こす。これを利用して、タモキシフェン投与によりCre-loxPシステムの働く細胞や時期を調節することが可能である。
Tcf21遺伝子を発現する心臓線維芽細胞のみがMerCreMerタンパク質を発現し、タモキシフェン投与によりloxP配列で挟まれたTomato(赤色蛍光タンパク質)が取り除かれてGFP(緑色蛍光タンパク質)を発現する。一方、心臓線維芽細胞以外の細胞はMerCreMerタンパク質を発現しないため、Cre-loxPシステムが働かず、Tomato陽性(赤色)のままである。これにより心筋リプログラミングによる真の心筋再生と心臓線維芽細胞と心筋細胞の融合による見かけ上の再生心筋を区別できる。
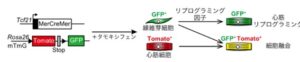
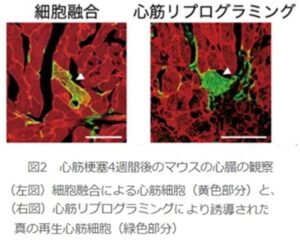
このようにして心筋梗塞4週間後のマウス心臓を観察すると、心筋リプログラミング遺伝子を導入しないコントロール群では、細胞融合を示す黄色の心筋細胞が約0.3%観察され、緑色の再生心筋細胞は全く見られなかった(下図左)。一方、仙台ウイルスベクターをもちいて心筋リプログラミング遺伝子を導入したマウスでは、心筋線維芽細胞から直接誘導された緑色の心筋細胞が約1.5%認められた(下図右)。また、細胞融合の頻度に関して、心筋リプログラミング遺伝子導入による変化はみられなかった。これらの結果から、心筋直接リプログラミング法により新しく作成された心筋細胞の大部分が心臓線維芽細胞からの直接誘導による真の再生心筋細胞であることが証明された。
生体内心筋リプログラミング効率の改善やリプログラミング遺伝子の導入法などの検討が必要である。iPS細胞を用いた心臓再生では、開胸手術が必要であり、工程が複雑で時間がかかり、移植後の心筋細胞の生着率が低いという問題点を心筋リプログラミングによる心臓再生では、心臓カテーテルを用いて遺伝子が注入でき、工程が単純で時間も短くてすみ、移植を必要とせず心筋細胞の生着率が高いというメリットがある。
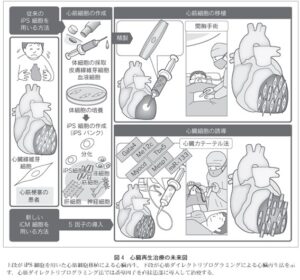
https://www.amed.go.jp/news/release_20210525-03.html
参:心筋ダイレクトリプログラミング法を用いた再生医療
1987年に骨格筋のマスター因子としてMyoDが発見され、MyoDを導入することで終末分化細胞である線維芽細胞を骨格筋細胞へ分化させることに成功した。この発見以降、各臓器における細胞の分化転換を目指した研究が盛んに行われた。心筋細胞を誘導する単一のマスター因子は特定されなかったが、2006年に山名からは4つの転写因子の導入によって、線維芽細胞から、分化・複製能を持つ未分化細胞であるiPS細胞が誘導されることを示した(Cell 2006; 126: 663-676)。このことにより、ほかの細胞腫への直接リプログラミングにおいても、単一ではなく複数の臓器特異的な転写因子を導入することが必要であると考えられるようになった。
心筋細胞のみGFPを発現せず、成熟分化した心筋で特異的にGFPを発現するため、もしリプログラミングによって心筋細胞が誘導されるとGFP陽性細胞として判別することができる。心筋リプログラミングの候補因子として、胎児期心筋細胞に特異的かつ心臓掲載に関わる遺伝子14個をピックアップし、レトロウイルスベクターを用いて心臓線維芽細胞に導入した。すべての遺伝子を同時に導入すると、1週間後に約1.7%のGFP陽性細胞を認め、心筋リプログラミング因子の存在が示唆された。14個の因子から1因子ずつ減らして絞り込んだところ最終的にGata4、Metf2c、Tbx5(以下GMT)の3つの心筋特異的転写因子が心筋リプログラミングに必須であることがわかった。この3因子を心臓線維芽細胞に導入することで約17%の線維芽細胞がGFP陽性の細胞となり、この細胞を誘導心筋細胞(induced Cardiomyocyte:iCM細胞)と名付けた。
誘導された心筋細胞はαアクチニン、心筋トロポニンT(cTnT)といった心筋特異的タンパク質や横紋構造(サルコメア構造)を有し、マイクロアレイによる遺伝子発現パターンにおいても心筋細胞との類似性が確認された。
2012年には転写因子を用いず心筋特異的なマイクロRNA(miR-1、miR-133、miR-208、miR-499)を導入することでも心筋リプログラミングが達成できることが示された。miRNAは導入した細胞の染色体に組み込まれることなく、一過性の発現にとどまるため、より安全な心筋リプログラミングが期待できる。さらに、培養液にJAK阻害剤を加えることで誘導効率の改善が示されており、液性因子や性分子化合物による培養条件の検討が心筋誘導の効率改善に重要であることが示唆された。
冠動脈を結紮しマウス急性心筋梗塞モデルを作成し、レトロウイルスベクターを用いて心臓内の線維芽細胞に遺伝子導入を行った。3因子を一つのベクターから効率よく発現できるポリシストロニックベクター(3F2A)を作成し、マウス心筋梗塞部に注入した。その結果高速そうにおいて誘導心筋細胞を認め、その約30%において横紋構造も見られた。成熟心筋の誘導効率は、別々のウイルスベクターで導入した場合の2倍まで改善し、生体内においても心筋が直接誘導できることがわかった。
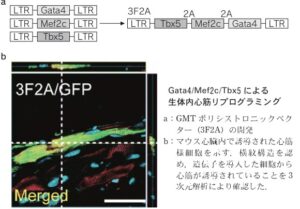
GMTに4つの心筋特異的miRNA(miR-1、miR-133、miR-208、miR-499)を単一もしくは複数同時に加えたところ、miR-133を加えることでGMTのみと比べて短時間かつ効率的(約10倍)に心筋が誘導できることが明らかになった。この誘導効率改善のメカニズムを調べたところ、miR-133が誘導早期より線維芽細胞関連遺伝子を抑制しており、その鍵遺伝子として上皮間葉転換のマスター因子であるSnailがmiR-133のターゲットであることを発見した。これにより、線維芽細胞の特性が消失することで心筋への転換が促進する可能性が示された。
無血清培地条件で心筋誘導効率を解析した結果、GMT3因子導入後に、線維芽細胞増殖因子FGF2、FGF10、血管内皮細胞増殖因子VEGFを培養液に添加することで、従来の牛血清を用いた方法と比べ約50倍の効率で拍動する心筋が誘導されることがわかった。
この分子メカニズムを調べたところ、細胞増殖因子よる刺激がPI3K/Akt、p38MAPK経路を活性化することで、心筋機能に関わる遺伝子群を上昇させていることが示された。さらに、FGF10、FGF2、VEGFはGata4の発現を誘導し、
Mef2c、Tbx5の2つの遺伝子のみでも心筋リプログラミングが可能であることが明らかになった。
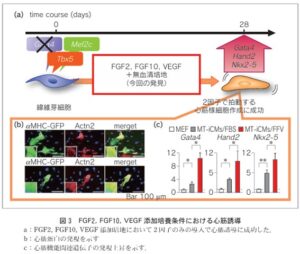
日本循環器学会専門医師2016 24 211-217
https://www.jstage.jst.go.jp/article/jjcsc/24/2/24_211/_pdf/-char/ja
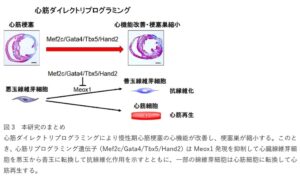
心筋ダイレクトリプログラミング法が慢性心不全治療にも適用可能であることを明らかにするために、心筋梗塞作成1ヵ月後の慢性心不全状態である心筋リプログラミング遺伝子を発現した改変マウスにタモキシフェンを投与したところ、心臓線維芽細胞から直接誘導された心筋細胞が約2%認められ、2ヶ月後には、心臓のポンプ機能が回復した。また、心筋梗塞慢性期の梗塞巣が約半分に縮小していた。

心臓組織の網羅的遺伝子発現解析を行ったところ、心筋ダイレクトリプログラミングにより心不全マーカーの改善に加え、線維化や炎症に関する遺伝子の発現が低下していた。
抗線維化作用のメカニズム解明のため、心筋細胞へ転換しなかった心臓線維芽細胞の遺伝子発現を1細胞レベルで明らかにするシングルセル解析を行った。
これにより、心筋梗塞慢性期の心臓線維芽細胞は7種類の異なる細胞集団から構成されており、さらにその中の繊維組織形成を誘導する線維芽細胞(悪玉線維芽細胞)の集団が顕著に増加していた。一方、心筋ダイレクトリプログラミングを行うと、悪玉線維芽細胞は、線維化関連遺伝子の発現が低い健常線維芽細胞(善玉線維芽細胞)の状態に変化することが明らかになった。マウス心臓組織切片においても、心臓線維化に特徴的な細胞外基質の沈着が減少していた。これらの結果から、心筋ダイレクトリプログラミングには心筋再生効果に加えて、線維芽細胞を悪玉から善玉に転換して梗塞巣を縮小する抗線維化作用があることが示された。
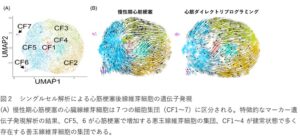
さらに、線維芽細胞が善玉化する機序として、心不全における線維芽細胞の活性化を誘導する鍵遺伝子Meox1の発現が抑制されていた。
https://www.keio.ac.jp/ja/press-releases/files/2022/12/13/221213-1.pdf
以前の研究では心臓リプログラミング因子を発現するウイルスベクターを心筋に直接注入することにより、急性心筋梗塞におけるin vivoリプログラミングを実証した。しかし、このアプローチでは、マウスに対して開胸術や瘢痕領域へのベクターの直接注入は技術的に困難であるから、慢性心筋梗塞においては適さない。
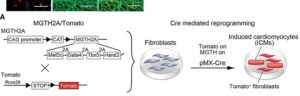
2Aペプチド(MGTH2A)で分離したMef2c/Gata4/Tbx5/Hand2(MGTH)を、CAGプロモーターの制御下でCre発現させたコンディショナルトランスジェニックマウスを作成した。MGTH2AマウスとR26-Tomatoレポーターマウスを交配し、MGTH2A/Tomatoダブルトランスジェニックマウスを作成した。Creを介した心臓のリプログラミングをテストするためpMX-Creレトロウイルスベクターをin vitroでMGTH2A/Tomatoマウス胚性線維芽細胞(MEF)に形質導入した。
A:MGTH2A/TomatoマウスにおけるCre媒介線維芽細胞組み替えによる直接心臓リプログラミングを示す。
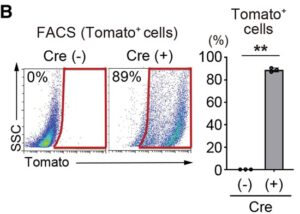
B: pMX-Cre形質導入の有無にかかわらず、MGTH2A/Tomato線維芽細胞におけるTomato発現の蛍光活性化セルソーティング(FACS)解析の定量的データをしめす。pMX-Cre形質導入した線維芽細胞は、Mef2c、Gata4、Tbx5、Hand2(MGTH)、およびTomatoを約90%発現したが、対照群では発現しなかった。
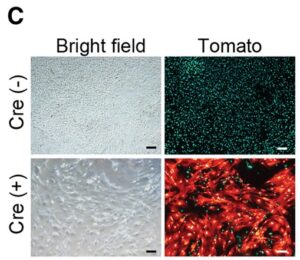
C:形質導入1週間後のTomatoおよびDAP1(核)の免疫細胞化学。
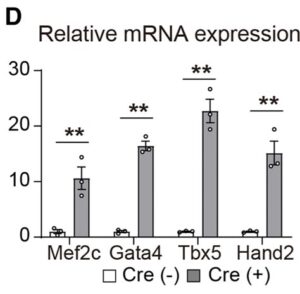
D:pMX-Cre形質導入の有無にかかわらず、MGTH2A/Tomato線維芽細胞におけるMef2c、Gata4、Tbx5およびHand2の相対mRNA発現。
E:pMX-Cre形質導入の有無にかかわらず、MGTH2A/Tomato線維芽細胞における心臓および線維芽細胞関連遺伝子の相対mRNA発現は、1週間の予備4週間後の定量的リアルタイム逆転写ポリメラーゼ連鎖反応によって決定された。

qRT-PCR法によりサルコメア遺伝子(Acta1、Myh6、Myl2、Tnnt2、およびTtn)、イオンチャネル遺伝子(Ryr2)、転写因子(Myocd)など様々な心臓機能に関連する心臓遺伝子は、pMX-Cre軽震導入一週間後に有意に誘導されたのに対し、線維芽細胞関連遺伝子(Col1a1およびCol3a1)は有意にダウンレギュレーションされた。
F:7日後および28日後のpMX-Cre形質導入の有無にかかわらず、MGTH2A/Tomato線維芽細胞におけるcTnT(心筋トロポニンT)発現のFACS分析。
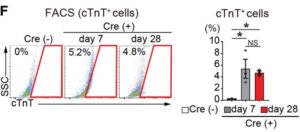
FACS解析では1週間後および4週間後に心臓リプログラミングの効率が約5%であった。免疫組織化学ではTomato陽性細胞のサブセットが心筋細胞のマーカーであるcTnTを発現していた。
G:7日後および28日後のpMX-Cre形質導入の有無にかかわらず、MGTH2A/Tomato線維芽細胞におけるTomato、cTnT、およびDAP1の免疫細胞化学。pMX-Cre形質導入は、28日後にのみサルコメア構造が誘導された。
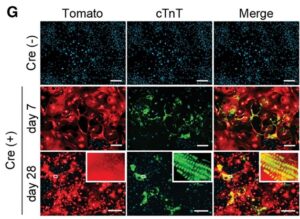
H、I:pMX-Cre形質導入後28日におけるiCMにおけるカルシウム過渡現象。Ca2+シグナルの最大濃度と最小濃度は、上部パネルHに示され、Fluo-4強度トレースは下部パネルHに示されている。ウェル毎にランダムに選択された5つのフィールドにおけるCa2+振動+細胞の数が示されている。
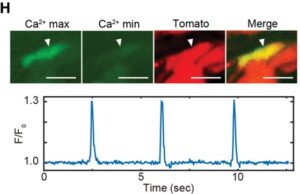
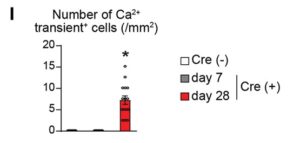
したがってCre媒介MGTH発現はin vitroで心臓のリプログラミングを誘導した。
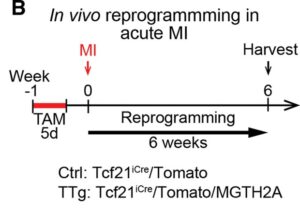
A:Tcf21iCreマウスとMGTH2A/Tomatoマウスを交配して作成したトリプルトランスジェニック(TTg)マウスを用いたin vivo心臓リプログラミング戦略の概略図。タモキシフェン(TAM)投与は、Tcf21を発現する常在性心筋芽細胞(CF)を人工心筋細胞(iCM)に変換する可能性がある。
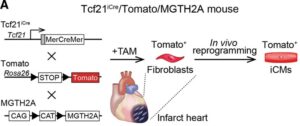
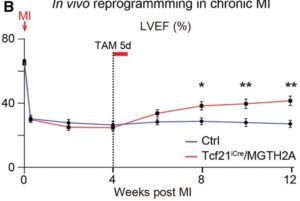
B:急性心筋梗塞(MI)におけるin vivo心臓リプログラミングの経時変化。対照群(Ctrl、Tcf21iCre/Tomato)および、TTgマウスにタモキシフェンを5日間毎日投与し、心筋梗塞を発生させ、6週間後に分析した。
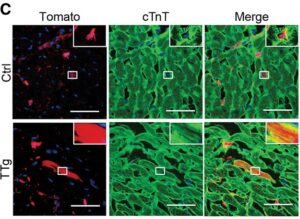
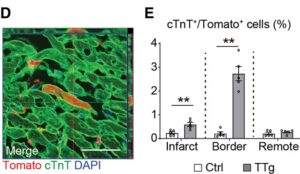
C-E:境界梗塞域には、多数のTomato陽性細胞が存在していた。qRT-PCR解析により、TTgマウスのFACSソートされたTomato陽性細胞では、対象マウスと比較してMGTHが有意にアップレギュレーションされていた。免疫組織化学の結果、Tomato陽性細胞の約3%が心筋細胞マーカーであるcTnTおよびα-アクチニンがTTgマウスの境界領域に発現しており、iCMのサブセットが成熟し、以前の研究と一致する、明確な交差線条を示した。心臓のリプログラミング効率は、梗塞や遠隔域では、境界域よりも低かった。3次元解析によりTomatoと心臓のタンパク質が同じ細胞で発現していることが示され、急性心筋梗塞におけるiCM
の生成が示された。
心筋梗塞の6週間後には境界梗塞領域に多数のTomato陽性細胞が存在し、qRT-PCR解析によりTTgマウスのFACSソートされたTomato陽性細胞では、対照マウスと比較し、MGTHが有意にアップレギュレーションされていた。免疫組織化学の結果、Tomato陽性細胞の約3%が心筋細胞のマーカーであるcTnTおよびα-アクチニンをTTgマウスの境界域に発現しており、iCMのサブセットが成熟し、交差線条を示した。
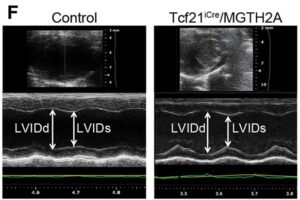
F:心エコー検査:矢印は拡張期(LVIDd)および収縮期(LVIDs)の左室内径を示す。
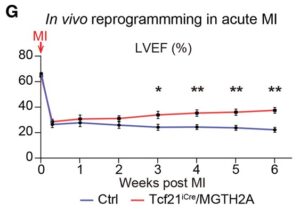
G:左心室駆出率(LVEF)は、コントロール(青線 n=19)およびTcf21iCre/MGTH2Aマウス(赤線 n=14)で6週間、心筋梗塞後2日目から連続的に測定した。
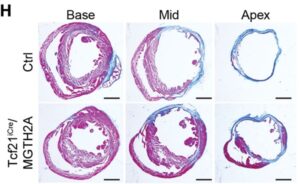
H:心筋梗塞の6週間後における対照群とTcf21iCre/MGTH2Aマウスの犯行領域の比較。線維化はアザン染色により、心基部、中部、心尖部で評価した。代表的な画像を示す。心臓のリプログラミング効率は、梗塞領域や遠隔域では境界地域よりも低かった。三次元解析により急性心筋梗塞におけるiCMの生成が示唆された。
I:生存率は心筋梗塞後6週間監視され、統計的有意性はログランク(Mantel-Cox)検定で決定した。コントロール(青線 n=19)とTcf21iCre/MGTH2Aマウス(赤線 n=14)を示す。
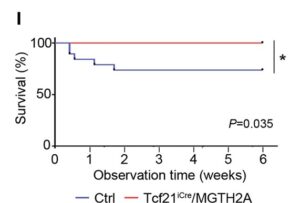
すべてのデータは平均±SEMである。 ★P<0.05、★★P<0.01
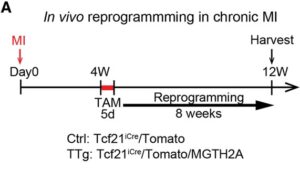
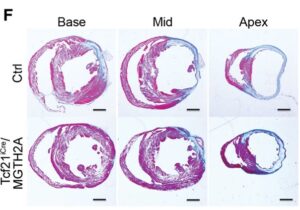
A:慢性心筋梗塞(MI)におけるTcf21発現心線維芽細胞(CF)におけるタモキシフェン(TAM)誘導Mef2c、Gata4、Tbx5、およびHand2(MGTH)の過剰発現のプロトコルの概略図
B:心筋梗塞の3ヶ月後の対照心臓の切片。遠隔域、境界部、および梗塞領域の高倍率。多くのTomato陽性細胞は境界梗塞領域に残存。
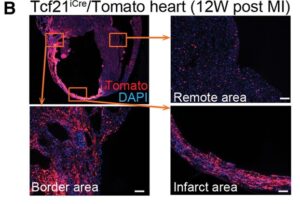
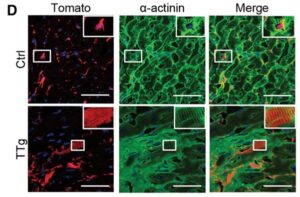
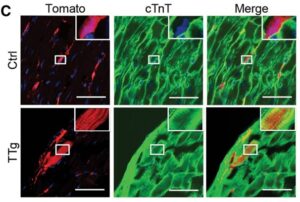
C-E:トマト、cTnT、α-アクチニン、およびDAPIを対照およびTTgマウスの心筋梗塞の3ヶ月後の免疫組織化学標本。
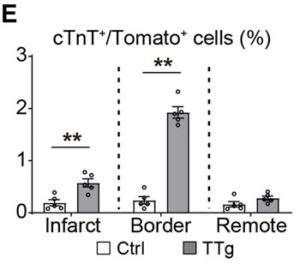
TTgマウスの心臓ではα-アクチニンやcTnTなどの心臓マーカーを発現し、境界領域に明確なサルコメア構造を示すTomato陽性細胞は約2%であったのに対し、対照群では0.3%であり、有意に増加していた。
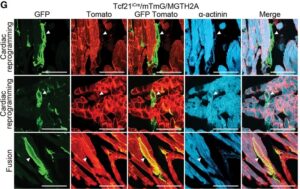
F:Tcf21iCre/MGTH2AマウスとmTmGマウスを交配して作成したTTgマウスを用いて、真正な心臓リプログラミングおよび融合イベントを決定するための模式図。
in vivoリプログラミングの実験プロトコルはAと同じ。GFP+(緑色蛍光タンパク質)心筋細胞は真正な誘導心筋細胞(iCM)をしめし、GFP+/Tomato+心筋細胞はCFと心筋細胞の融合を示す。
G-H:Tcf21iCre/mTmG/MGTH2Aマウス心臓における心筋梗塞3ヶ月のGFP、Tomato、およびα-アクチニンの免疫組織化学。iCMはGFPを発現したが、上部と中央のパネルではTomatoを発現しなかった。対照的に、心筋細胞はGFPとTomatoの両方を底部パネル(融合)で発現していた。定量分析を示す。
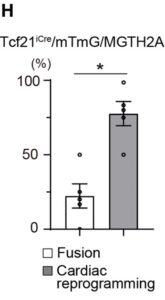
すべてのデータは平均±SEMである。 ★P<0.05、★★P<0.01
内因性心筋細胞におけるiCMの割合を定量化したところ、心筋細胞の約2%が損傷部位にトマトレポーターを発現している。iCMはギャップ結合タンパク質Cx43を発現し、周囲の心筋細胞に結合している。心室心筋から単一のiCMを単離したところ、Tomato陽性iCM細胞は内因性心筋細胞と同様にcTnTを発現している。免疫組織化学的な検討により腎臓、肝臓、杯、秘蔵などのほかの臓器ではcTnT+iCM細胞が観察されないことが明らかになっており、qRT-PCRにより、TTgマウスのほかの臓器ではTnnt2mRNAの発現が誘導されないことが確認された。これらの結果は、iCMが心臓以外のほかの臓器で産生されていないことを示唆している。
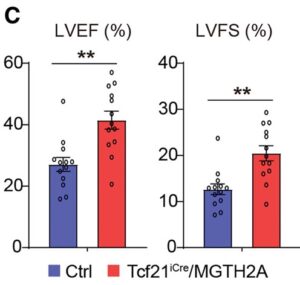
A-B:対照(Ctrl、Tcf21iCre)およびTcf21iCre/MGTH2Aマウス(n=15)の慢性心筋梗塞(MI)におけるin vivo心臓リプログラミン。Mモード心エコー図。矢印は拡張期(LVIDd)および収縮期(LVIDs)左室径、左室駆出率(LVEF)を示す。心筋梗塞後2日目から3ヶ月間2週間毎に連続的に測定。
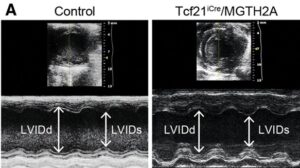
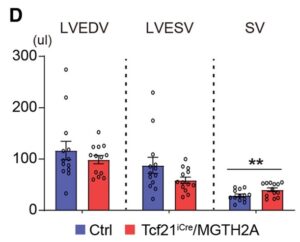
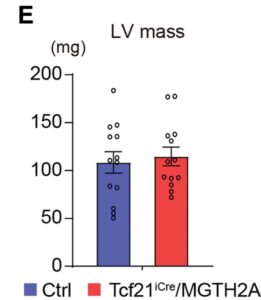
C-E:対照群とTcf21iCre/MGTH2Aマウス(n=15)のMIの3ヶ月後に心エコー検査でLVEF、LVFS(left ventricular fraction shortening)、LVEDV(left ventricular early diastolic volume)、Stroke volume(SV)、left ventricular(LV) massを測定した。
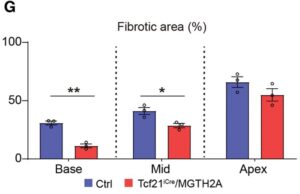
F-G:対照群とTcf21iCre/MGTH2Aマウス(n=15)のMIの3ヶ月後の組織標本の比較。線維化はアザン染色により、心基部、中部、心尖部で評価した。
Tcf21iCre/MGTH2Aマウスでは対照群よりも線維化領域が有意に減少していた。
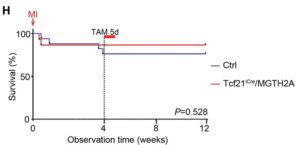
H:生存率は対照群とTcf21iCre/MGTH2Aマウスの心筋梗塞後3ヶ月間監視した。
Tcf21iCre/MGTH2Aマウスは心室壁破裂や突然死を示さず、すべてのマウスはタモキシフェン投与後少なくとも2ヶ月間は生存した。
したがって、in vivo心臓リプログラミングは、慢性心筋梗塞における新機能を改善し、線維化を減少していた。
A:慢性心筋梗塞(MI)におけるin vivo心臓のリプログラミング。心筋梗塞の3ヶ月後に、マイクロアレイ、定量的リアルタイム逆転写ポリメラーゼ連鎖反応(qRT-PCR)およびシングルセルRNAシーケンシング(scRNA-seq)解析のため、Ctrl-MIおよびトリプルトランスジェニック(TTg)MIから心臓を採取。
ボルケーノプロットはマイクロアレイ解析において、Ctrl-MI心臓とTTg-MI心臓の間で発現差が2倍以上変化した遺伝子を示している。
遺伝子発現のさじ的解析によりTTg-MIでは117個の遺伝子が、アップレグレーションされたのに対し、260個の遺伝子はCtrl-MIマウスと比較して2倍以上ダウンレギュレーションされた。
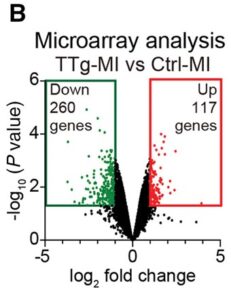
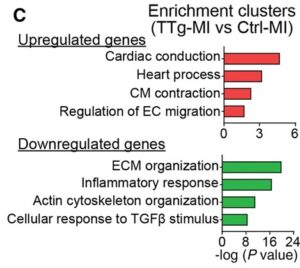
C:TTg-MIとCtrl-MIにおける有意なアップレギュレーションおよびダウンレギュレーション遺伝子のエンリッチメントクラスタ解析。
遺伝子セット濃縮解析により、TTg-MI心臓でアップレギュレーションされた遺伝子は線維芽細胞シグネーチャー(ECM組織、アクチン細胞骨格組織、トランスフォーミング成長因子β1:TGFβ1刺激に対する応答)および炎症反応が濃縮されることが示された。
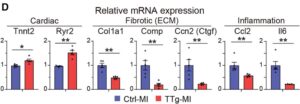
D:Ctrl-MIおよびTTg-MI心臓における、心臓、線維化(細胞外マトリックス:ECM)、および炎症関連遺伝子のmRNA発現は、qRT-PCRによって決定された。
qRT-PCRの結果、TTg-MIでは、Tnnt2やRyr2などの心臓関連遺伝子の発現がCtrl-MIと比較してアップレギュレーションさせているのに対し、Col1a1、Comp、Ccn2(結合組織因子:Ctgf)、Meox1、Postnなどの線維芽細胞関連遺伝子、および炎症性遺伝子(Ccl2、Il6)は、TTg-MI心臓で有意に抑制されていることが示された。
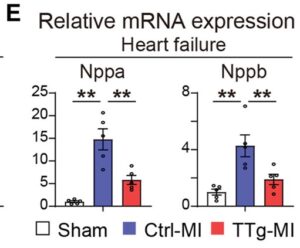
E:偽心臓、Ctrl-MI心臓、TTg-MI心臓における心不全関連遺伝子のmRNA発現はqRT-PCRによって決定された。
NppaとNppbの発現は、偽と比較して、Ctrl-MIではアップレギュレーションされていたが、TTg-MIでは有意に抑制されていた。
したがって、in vivo心臓リプログラミングは、心臓遺伝子発現をアップレギュレートし、同時に慢性心筋梗塞における線維芽細胞および炎症性シグネチャーを抑制して、心機能を回復させる。
F:scRNA-seqによる非心筋細胞の単利および分析のための実験手順の概略
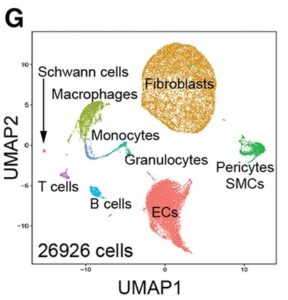
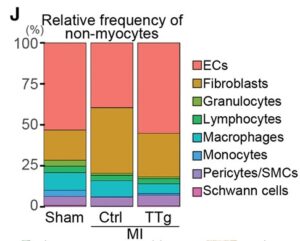
G:偽心室、Ctrl-MI心室、TTg-MI心室からの26962個の単一間質細胞を統合する均一多様体近似および投影(UMAP)。色で示された8つのクラスターは、推定される細胞タイプでマークされる。
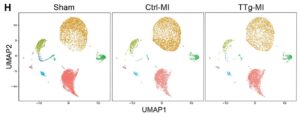
H:偽(n=2つの心室)、Ctrl-MI(n=3つの心室)、TTg-MI(n=2つの心室)のクラスターによって着色された非心筋細胞のUMAP。
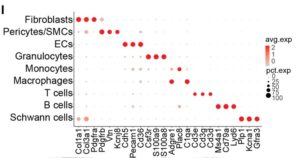
I:クラスターの道程に使用されるトップマーカー遺伝子のドッドプロットの四角化。ドットと色とサイズは各集団における相対的な平均発現レベルと遺伝子を発現する細胞の割合をそれぞれ示している。
J:各scRNA-seqサンプルにおけるクラスターキヨの割合の棒グラフ。リンパ球にはT細胞とB細胞のクラスターが含まれている。
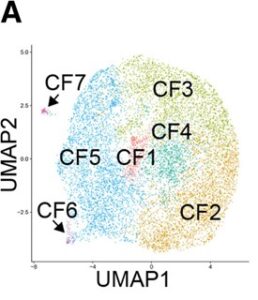
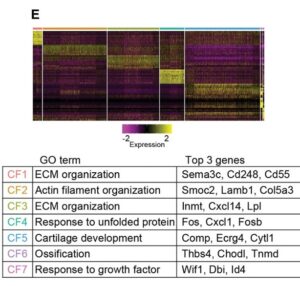
A:偽心筋梗塞(MI)、TTg-MI心室からの10487個の心線維芽細胞CFを埋め込んだ均一多様体近似および投影(UMAP)。7つのクラスター(CF1-7)が識別される。
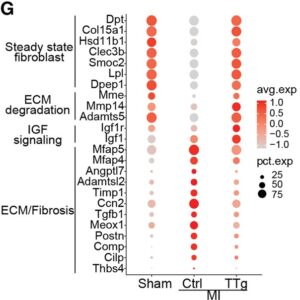
CF1、CF2、CF3、CF4クラスターは静止状態/定常状態の線維芽細胞(Hsd11b1、Lpl、Dpt)およびECM分解(Adamats5、Mme)、CF7クラスターは、心内膜線維芽細胞(以前F-Wnt-Xと呼ばれていた)のマーカーであるWig1を発現していた。CF5およびCF6はAngptl7,Clip、Comp、Erg、Food、Postn、Meox1およびThisを含む活性化線維芽細胞、軟骨発生、およびこつかに関連する遺伝子を発現していた。古典的な線維芽細胞マーカーActa2(αSMALL)およびCthrc1は発現していなかった。
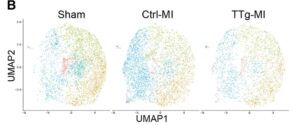
B:偽(n=2つの心室)、Ctrl-MI(n=3つの心室)、TTg-MI(n=2つの心室)のクラスターによって色づけされたCFのUME。
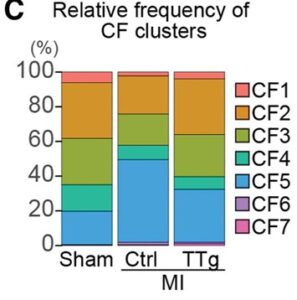
C:各シングルセルRNAシーケンシング(scRNA-seq)サンプルにおけるCFクラスターの寄与率の棒グラフ。
CF5とCF6の相対比は、シャムマウスに比較しCtrl-MIマウスで増加し、TTg-MIマウスでは減少していた。
D:UMAPプロットで可視化されたCF関連遺伝子とTomatoの発現。
![]()
E:scRNA-seqデータのクラスター毎の上位10個のマーカーを示すヒートマップ。代表的な遺伝子オントロジー用語と各CFクラスターの上位3つのマーカー遺伝子を右の表に示す。
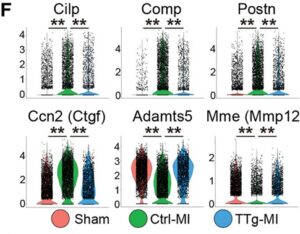
F:各グループのCF1-7集団におけるプロフィブロティック(Clip、Comp、Postnなどの線維芽細胞関連遺伝子、および炎症性遺伝子Ccl2およびCcn2)および細胞外マトリックス分解遺伝子(Adams、Mme)の発現を示すバイオリンプロット。
G:各サブクラスターのシグネチャー遺伝子はドットプロットで表現。ドットの色とサイズは、各集団における相対的な平均発現レベルと遺伝子を発現する細胞の割合をそれぞれ示している。
H:偽。Ctrl-MI、TTg-MIのCF集団のUMAPプロットへのRNA速度の投影。→月の線は、速度の主な変化と予想される将来の状態を示している。Ctrl-MIの法の線の→は出たり入ったりしているが、TTg-MIの矢印は一定方向のように見える。

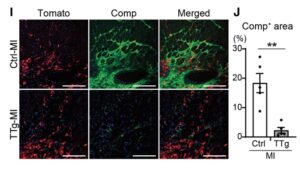
I-J:MIの3ヶ月後のCtrl-MIおよびTTg-MIマウス心臓におけるTomato、CompおよびDAPIの免疫組織化学。境界梗塞領域のComp+領域の定量分析を示す。
A-B:心臓線維芽細胞における心筋細胞関連遺伝子(Actc1、Myocd、NppaおよびRyr2)、線維形成転写因子(Meox1、Snai1およびSox9)の発現を示すバイオリンプロット。TTg-MIのCFではCtrl-MIのCFと比較して複数のプロフィブロティック遺伝有意に抑制されていた。scRNA-seq解析により、Acta1、Myocd、Nppb、Ryr2などの心臓遺伝子が、TTg-MIのCFで誘導されていないことが明らかになり、抗線維化効果が部分的なリプログラミングに起因する可能性が低いことが示唆された。転写因子のMeox1は、HFの進行におけるCF活性化の中心的な調節因子であることが報告されているが、心臓のリプログラミングにおけるMeox1の役割は不明である。慢性心筋梗塞のCFでMeox1の発現が亢進し、線維化遺伝子の発現変化に伴ってTTg-MIでは有意に抑制されていることがわかった。対照的に、Snai1やSox9などほかの線維形成転写因子の発現は変化しておらず、心臓のリプログラミングがMeox1の抑制を通じて、抗線維化効果を誘導する可能性が示唆された。

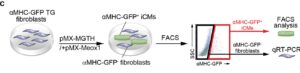
C:心臓リプログラミングにおけるMeox1の役割を分析するための模式図。蛍光活性化細胞選別(FACS)は、α-ミオシン重鎖(αMHC)-GFP(緑色蛍光タンパク質)TG線維芽細胞において、Meox1の有無にかかわらず、Mef2c、Gata4、Tbx5およびHand2(MGTH)形質導入の1週間後に実施。αMHC-GFP+誘導のFACS解析とFACSソートされたαMHC-GFP+線維芽細胞の定量的リアルタイム逆転写ポリメラーゼ連鎖反応(qRT-PCR)を実施。
in vitro実験では、複数の線維芽細胞遺伝子発現の抑制に伴ってpMX-MGTHを形質導入した線維芽細胞において、Meox1が有意にダウンレギュレーションされていることが明らかとなった。
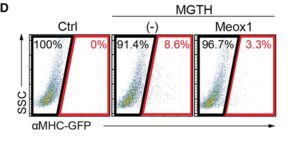
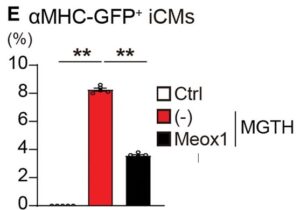
D-E:αMHC-GFP+発現のFACS分析。定量的データを示す。
次に、心臓のリプログラミングにおけるMeox1の役割を決定するために、Meox1の回復が線維芽細胞におけるMGTHの過剰発現の影響を打ち消すことができるかどうかを調べた。心筋細胞のみがGFPを発現するMGTH形質導入α-ミオシン重鎖(αMHC)-GFP TG線維芽細胞において、pMX-Meox1を過剰発現させた。
FACS解析により、心臓リプログラミング中のMeox1の過剰発現によりαMHC-GFP+iCMの誘導が有意に抑制された。
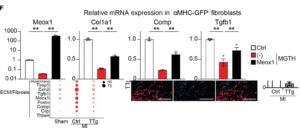
F:αMHC-GFP+線維芽細胞におけるMeox1および線維芽細胞関連遺伝子(Col1a1、Comp、Tgfb1)の相対的mRNA発現。
次にαMHC-GFP+線維芽細胞をFACSで単離し、qRT-PCRで遺伝し発現を解析した。Col1a1、Comp、Tgfb1などの原線維化遺伝子の発現は、pMX-MGTHで形質導入された線維芽細胞では強く抑制されていたが、Meox1の補給では有意にアップレギュレーションされた。
これらの結果は心臓のリプログラミングが、Meox1の抑制を通じて、少なくとも部分的に抗線維化効果を誘導する可能性があることを示唆している。
in vivo心臓リプログラミングが、慢性心筋梗塞の新機能を改善し、戦士かを逆転させることを示しており、マイクロアレイおよびscRNA-seq解析により、CFにおけるMGTHの過剰発現はiCMを誘導するだけでなく、線維化促進CFを静止抗線維化状態に変換することにより線維芽細胞遺伝子シグネチャーを抑制した。これらの新しい知見は、虚血性心筋症に対する再生促進および抗線維化療法の開発の機会を提供する。
Circulation Volume 147, Number 3
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.121.058655
























