川村所長の勉強会参加記録
2024.06.30
尿酸と炎症を考える 高尿酸血症治療 佐野元昭教授
2024年6月18日
演題「時間軸で見る高尿酸血症治療 ~尿酸と炎症を考える~」
演者: 山口大学大学院医学系研究科 期間病態内科学講座教授 佐野元昭先生
場所: TKPガーデンシティPREMIUM横浜西口
内容及び補足「
栄養系の過剰摂取が引き金となり発症する生活習慣病
自然免疫機構は従来病原微生物を排除する反応である。
痛風は、尿酸6.8mg/dL 37℃ Na 140mMを超えると溶けきれなくなり析出して尿酸塩の結晶を形成する。沈着した尿酸血症が異物として認識され炎症が起こるこれがinflammasomeの活性化が関与
参:inflammasomeは細胞質に位置する多タンパク質オリゴマーであり、自然免疫系に関与し、炎症応答の活性化を担う。inflammasomeの活性化と組み立ては、炎症性サイトカインであるIL-1βとIL-18の切断、成熟、分泌、そしてガスターミンDの切断を促進する。ガスターミンDの切断によって生じたN末端断片は、ピロトーシスと呼ばれるアポトーシスとは異なる炎症促進性のプログラム細胞死を誘導し、またおそらく細胞膜でポアの形成を介して成熟型サイトカインの分泌を担う。inflammasomeの活性化の調節異常によって、癌、自己免疫疾患、代謝疾患、神経変性疾患などの多くの主要な疾患が引き起こされる可能性がある。
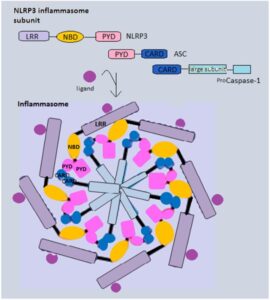
従来inflammasomeは、主にマクロファージなど自然免疫系の専門細胞で研究が行われてきた。しかし、近年の研究では、上皮バリア組織においてもinflammasomeの構成要素の発現レベルが高いことが示されており、そこで重要な防御の最前線となっていることが示されている。inflammasomeの活性化は、様々な種類ノンパターン認識受容体PRRによって開始され、これらは微生物由来の病原体関連分子パターンPAMPまたは宿主細胞によって産生されるダメージ関連分子パターンDAMPのいずれかに応答する。inflammasomeに関与するPRPとしてはNOD様受容体(NLR)やabsent in melanoma2(AIM2)、IFN-inducible protein 16(INF16)やパイリン(Pyrin)などがある。
Inflammasomeの受容体はcaspase activation and recruitment domain(CARD)またはpyrin domain(PYD)を介してアダプタータンパク質ASCと相互作用する。ASCは自身のCARDドメインを介してカスパーゼ-1前駆体をリクルートし、タンパク質の分解切断によってエフェクターカスパーゼを活性化する。活性化されたカスパーゼ-1は最終的に、未熟な炎症性サイトカインであるIL-1β前駆体とIL-18前駆体、そしてガスダーミンDを切断する。これらはそれぞれ炎症シグナル伝達とピロトーシスによって細胞死を担う。
カスパーゼ-1トは独立して作用する非古典的インフラマソーム(non- canonical inflammasome)はマウスにおいては、カスパーゼ-11による細胞質に存在する細胞由来のリポ多糖(LPS)の検知によって直接活性化され、その後ピロトーシスによる細胞死を誘導する。ヒト細胞では、非古典的インフラマソームのカスパーゼはカスパーゼ-4とカスパーゼ-5である。
インフラマソームとはプロテアーゼCaspase-1を活性化し、炎暑旺盛サイトカインであるIL-1βやIL-18の産生を制御するタンパク質複合体の総称である。Nod-like receptorファミリーに属するパターン認識受容体NLRP3は、下流のアダプター分子であるapoptosis-associated speck-like protein containing a CARD(ASC)およびCaspase-1とともにNLRP3インフラマソームを形成する。
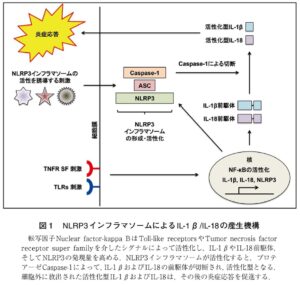
NRRP3インフラマソームは多種多様な刺激によって活性化する。

NLRP3インフラマソームの本来の役割は、病原体からの生体防御であると考えられるが、一方でNLRP3インフラマソームには過栄養に伴い体内に蓄積した代謝産物(尿酸塩血症、コレステロール結晶、そして遊離脂肪酸等)に反応して過度に活性化し、痛風関節炎や糖尿病といった様々な炎症性疾患の発症に大きく寄与してしまう負の側面も存在する。
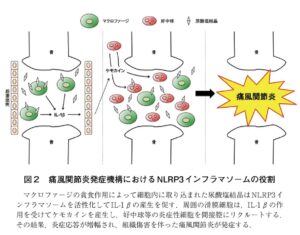
痛風関節炎の発症メカニズム
マクロファージの貪食作用によって細胞内に取り込まれた尿酸塩結晶は、NLRP3インフラマソームを活性化し、IL-1βの産生を促進する。IL-1βは周囲の滑膜細胞に作用してケモカインの産生を誘導する。ケモカインの働きによって、好中球などの炎症性細胞が関節空にリクルートされると炎症応答が過剰に惹起され、関節組織障害を伴う痛風関節炎症状が引き起こされる。
痛風の治療薬として用いられているコルヒチンがNLRP3インフラマソームの活性化を特異的に抑制する。
コルヒチンは微小管重合阻害剤として広く知られている。
微小管はαおよびβチューブリンにより構成される管状構造体であり、細胞骨格の維持あるいはミトコンドリアや小胞体といったオルガネラの局在を規定する役割を担っている。
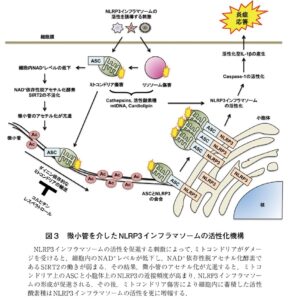
未刺激条件下のマクロファージにおいて、主にNLRP3およびASCはそれぞれ小胞体とミトコンドリア上に局在している。尿酸塩結晶でマクロファージを刺激すると、ミトコンドリアの局在が微小管中心方向に大きく変化する。その結果、小胞体とミトコンドリアの接触頻度が高まり、NLRP3とASCが近接する。一方、コルヒチン処理によって微小管構造を破壊すると、尿酸塩結晶の刺激に応じたミトコンドリアの局在変化が抑制され、それと一致するように、NLRP3-ASCの近接頻度も減少する。これらのことから、微小管はミトコンドリアの局在を制御することで、NLRP3インフラマソームの活性化を促進していることが考えられる。
ダイニンは、微小管中心方向へ向けた細胞内物質輸送を制御する分子モータータンパク質である。ダイニン特異的な阻害剤を用いてマクロファージを処理すると、尿酸塩結晶の刺激に応じたミトコンドリアの局在変化、NLRP3-ASCの近接、そしてIL-1βの産生量が有意に低下する。つまり、微小管を介したダイニン依存的なミトコンドリアの局在変化は、NLRP3インフラマソームの活性化を促進している。
微小管の構成因子である、αチューブリンは、様々な翻訳後修飾を受けることで細胞内の物質輸送を制御している。アセチル化されたαチューブリンはミトコンドリア-小胞体間の相互作用を高める。
αチューブリンに対する特異的なアセチル基転換酵素MEC17の発現量をRNAiにより低下させると、αチューブリンのアセチル化が減少し、尿酸塩結晶の刺激に応じたミトコンドリアの局在変化と、それに起因するNLRP3インフラマソームの形成が抑制される。つまり、アセチル化αチューブリンはNLRP3インフラマソームの活性化を促進している。
NAD+依存性脱アセチル化酵素SIRT2に対する特異的な阻害剤でマクロファージを処理すると、αチューブリンのアセチル化が亢進し、ミトコンドリアの局在変化が強く誘導される。さらに、尿酸塩結晶でマクロファージを刺激するとミトコンドリア障害に起因して、SIRT2の補酵素であるNAD+の量が大幅に減少する。これらの結果から、NLRP3インフラマソームの活性化機構は下図のように説明できる。
まず、マクロファージの貪食作用によって、細胞内に尿酸塩結晶が取り込まれると、ミトコンドリアが障害を受ける。ミトコンドリア障害によって細胞内のNAD+レベルが減少すると、SIRT2の酵素活性が低下し、αチューブリンのアセチル化が亢進する。アセチル化αチューブリンは、ダイニン依存的なミトコンドリアの局在変化を促進することで、NLRP3とASCの近接頻度を高め、その後のNLRP3インフラマソームの形成を誘導する。ミトコンドリア障害により細胞内に蓄積した活性酸素種はNLRP3インフラマソームの活性化を増幅し、その後の炎症応を惹起する。
NLRP3インフラマソームと痛風関節炎
https://www.jstage.jst.go.jp/article/gnam/39/1/39_1/_pdf/-char/ja
高尿酸血症の治療のアルゴリズムを下記に示す。
赤線で囲ってある痛風発作のある症例においての対応は世界共通である。尿酸結晶を体組織から消失させるためには、尿酸の体液中での溶解度限界と考えられる6.4mg/dLよりも低い6.0 mg/dL未満に血清尿酸値を維持することが重要であるとされている。
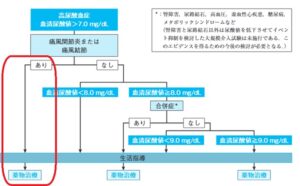
しかし、日本のガイドラインは、無症候性高尿酸血症の治療にも言及している。
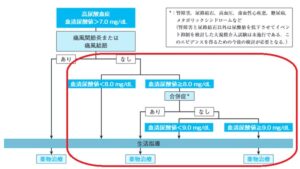
それは、CKDの進展に対する高尿酸血症の治療介入研究結果ですべての報告ではないが、いくつかの高尿酸血症の治療により、CKD診療ガイドライン2012の進展が抑制されているRCTが報告されているからである。
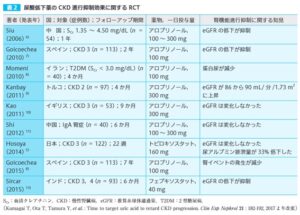
他国が、無症候性の高尿酸血症治療について言及していない理由は、これらのRCTが50-100例という少ない対象例での研究結果であるからである。
高尿酸血症・痛風の治療相戸ライン第3版
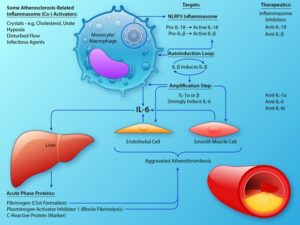
痛風発作の場合、関節腔内で尿酸塩結晶が形成され、マクロファージの貪食作用によってNLRP3インフラマソームが活性化され、preIL-1βをcaspase-1依存性変換により成熟IL-1βを分泌させる。分泌されたIL-1βがIL-1受容体に結合し、転写因子核因子κBの活性化につながるシグナル伝達経路を活性化する。最終的にこの炎症カスケードは、様々な炎症性サイトカイン、走化性因子、リソソーム酵素、英子佐野イド、および活性酸素種の放出につながり、単各色細胞、好中球および肥満細胞などの炎症性細胞に影響を与える。
ASCVDではLDL粒子が動脈壁に蓄積し、LDL粒子が酸化などの修飾が起こり、免疫学的および炎症反応が誘発され、局所的なコレステロールの蓄積とともに、アテローム性動脈硬化性プラークが発生する病巣となる。LDL粒子から除去された遊離コレステロールが動脈壁で結晶化する可能性があり、この結晶の取り込みもNLRP3インフラマソームを活性化し、IL-1β分泌を誘発し、それに続く局所的な炎症を引き起こす。
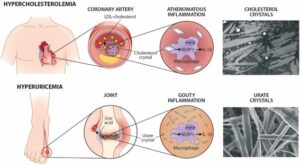
Eur Heart J. 2021 Jul 21;42(28):2761-2764.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8845033/
アテローム性動脈硬化症の治療として、LDLコレステロール低下治療を行っても。他のリスク因子(残余リスク:residual risk)が残っている。
NLRP3インフラマソームは、コレステロール結晶による共活性化、低酸素、流れの乱れなど多くのアテローム性動脈硬化関連刺激によって活性化される。活性化されたインフラマソームは、プロIL-1βとプロIL-18を成熟した炎症誘発型に変換するCaspase-1の活性化を惹起する。IL-1βは、急性期反応の主要なメディエーターであるIL-6の酸性を強く誘導する。肝細胞のカノニカル受容体を介したIL-6シグナル伝達は、急性期反応物質であるフィブリノーゲン、プラスミノーゲンアクチベーターインヒビター1を増加させる。
臨床的に使用されている抗IL-6抗体であるトシリズマブは、患者の血漿トリグリセリドを増加させる。
Arterioscler Thromb Vasc Biol. 2019 Apr;39(4):538-545.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6436984/
参:トシリズマブ(アクテムラ)
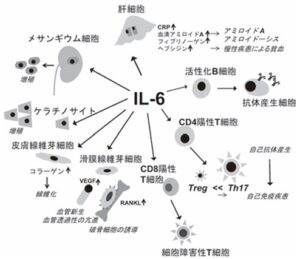
IL-6は活性化B細胞の抗体産生細胞への分化を促進するB細胞分化因子として、遺伝子がクローニングされたが、その後下図に示すような多彩な作用を有するサイトカインであることが明らかとなった。
肝細胞に作用すると、急性期タンパク質であるCRP、血清アミロイドA、フィブリノーゲンやヘプシジンなどの産生を誘導する。IL-6の持続的な産生は、アミロイドAアミロイドーシスや慢性疾患に伴う貧血の責任蛋白である血清アミロイドやヘプシジンの過剰産生を誘導し、続発性アミロイドーシスや貧血を惹起する。IL-6は獲得免疫系において、活性化B細胞に働き、免疫風呂ブリンの賛成を増強するが、ナイーブCD4陽性T細胞のエフェクターT細胞への分化にも関与している。トランスフォーミング増殖因子β(TGF-β)とともにナイーブT細胞に作用するとTh17細胞への分化を促進し、一方でTGF-βにより誘導される制御性T細胞(regulatory T cell:Treg)の分化を抑制する。
また滑膜線維芽細胞や皮膚線維芽細胞に作用し、それぞれ血管内皮細胞増殖因子(vascular endothelial growth factor:VEGF)やコラーゲンの産生を促す。IL-6は、メサンギウム細胞やケラチノサイトの増殖因子でもある。
感染や組織障害などのストレス時に、IL-6母屋やかに産生され、急性期タンパク質の合成や免疫系細胞の活性化や分化を誘導し、ストレスの排除に寄与する。病生物の排除や組織障害が治癒するとIL-6の産生は収束する。
しかし、何らかの原因により、IL-6が過剰に産生されると、サイトカインストームと呼ばれる重篤な急性全身性の臓器不全を惹起する。また、ある細胞からの持続的な産生は、様々な慢性の自己免疫性、炎症性疾患の発症や進展に関与する。
IL-6は膜貫通型、もしくは可溶型IL-6受容体と結合し、gp130のホモ2量体化を惹起し、細胞内へシグナル伝達を誘導する。膜型IL-6受容体は、肝細胞や白血球などの一部の細胞に発現が限られているが、可溶型IL-6受容体は血液や組織液に存在し、IL-6と可溶型IL-6受容体複合体が、ほとんどの細胞に発現しているgp130を活性化することでIL-6は多彩な作用を誘導する。この2受容体を介するシグナル伝達経路は、それぞれ古典的シグナル、トランスシグナル伝達経路と呼ばれる。
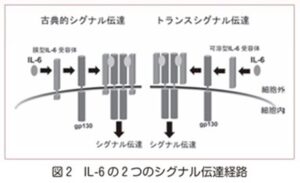
トシリズマブは両タイプの受容体と結合し、IL-6の作用を阻害する。
https://www.jstage.jst.go.jp/article/faruawpsj/51/5/51_408/_pdf/-char/ja
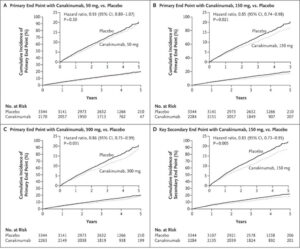
アテローム血栓症に炎症が関与していると考えられている。その検証試験として、心筋梗塞既往者で高感度CRP 2mg/dL以上の患者10061例を対象に、IL-1βを標的とするモノクローナル抗体治療薬カナキヌマブを50mg、150mg、300mgとプラセボの比較試験CANTOS Studyがある。
48ヶ月時点で高感度CRPのベースラインからの低下率の中央値は、プラセボと比較して、カナキヌマブ50mg投与群では26%大きく、150mg群では37%大きく、300mg群では41%大きかった。カナキヌマブ群では、脂質をベースラインからの低下は見られていない。追跡期間中央値3.7年の時点で、主要エンドポイントの発生率は、プラセボ群では、100人年あたり4.50件、50mg群では4.11件、150mg群では3.86件、300mg群では3.90件であった。プラセボ群に対するハザード比は、それぞれ0.93、0.85、0.86であった。IL-1β自然免疫経路を標的とするカナキヌマブ150mgの3ヶ月ごと投与による抗免疫療法は、資質を低下させることなく、再発性心血管イベントの発生率をプラセボと比較して有意に低下させた。
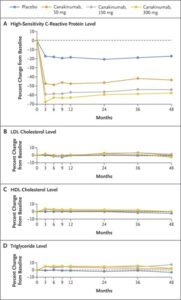
NEJM 2017;377:1119-1131
https://www.nejm.org/doi/full/10.1056/NEJMoa1707914
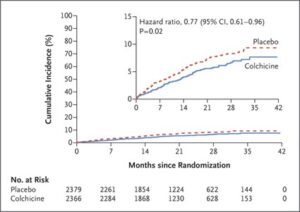
心筋梗塞発症後30日以内に登録された対象者を低用量コルヒチン(0.5mg1日1回)投与群2366例とプラセボを投与する群2379例を比較検討したCOLCOT試験は、追跡中央値22.6ヶ月で主要エンドポイントは、コルヒチン群で5.5%、プラセボ群では7.1%に発生した。HRは0.77であり、心血管系死亡のHRは0.84、蘇生された心停止のHRは0.83、心筋梗塞のHRは0.91、脳卒中のHRは0.26、冠血行再建に至った狭心症による緊急入院のHRは0.50であった。
最近心筋梗塞を発症した患者では、1日0.5mgのコルヒチンにより、虚血性心血管イベントのリスクがプラセボと比較して有意に低下したことが示された。
NEJM 2019;381:2497-2505
https://www.nejm.org/doi/full/10.1056/NEJMoa1912388
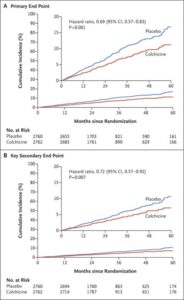
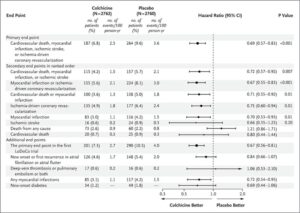
慢性冠動脈疾患患者に対してコルヒチン0.5mg/日投与群2762例、プラセボ群2760例を追跡期間中央値28.6ヶ月で比較検討すると、主要エンドポイントイベントは、コルヒチン群で187例6.8%、プラセボ群で264例6.9%発生した(HR 0.69)。主要な副次的エンドポイントイベントは、コルヒチン群で115例4.2%、プラセボ群で157例5.7%に発生した(HR 0.72)。自然心筋梗塞または虚血による冠血行再建術、心血管し、自然心筋梗塞、虚血による冠血行再建術、および自然心筋梗塞の発生率も、プラセボ群よりもコルヒチン群で有意に低かった。心血管以外の原因による死亡の発生はプラセボ群よりもコルヒチン群で高かった。
NEJM 2020;383:1838-1847
https://www.nejm.org/doi/full/10.1056/NEJMoa2021372
この研究はLDLが低下している症例においての研究である。インフラマソームの活性化の因子はLDL以外のものを考えるべきで、その候補として、尿酸塩結晶があげられる。
移植された冠動脈55個、弁置換術からの大動脈75件、癌手術中に切除された前立腺40個の標本で尿酸結晶の有病率を評価した研究がある。
55個の冠動脈のうち6個10.9%、75個の大動脈弁のうち1個1.4%、40個の前立腺のうち19個47.5%に結晶が認められた。
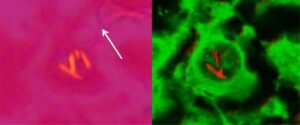
偏光顕微鏡で見た左前下行動脈(左)の内膜における細胞内負複屈折結晶。白い矢印は、1次の赤いプレート軸を示します。細胞内結晶を示す同じ細胞のデコンボリューション共焦点顕微鏡画像(右)。
BMJ Open. 2014; 4(7): e005308.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4120371/
痛風患者31例と対照者18例の腹部のDECTスキャンを行い尿酸ナトリウム血症(MSU)の沈着量を比較検討した。大動脈内のMSU量は痛風患者においては43.9に対して対照群では2.9と有意な差を認めた。しかし、年齢、性別、心血管疾患の既往、糖尿病の調整後、その差は有意ではなかった。年齢の増加に伴いMSUは増加した。
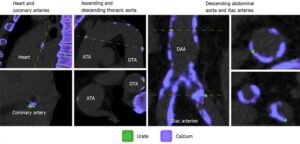
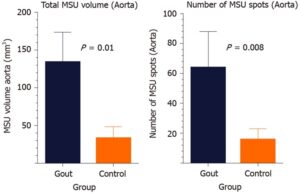
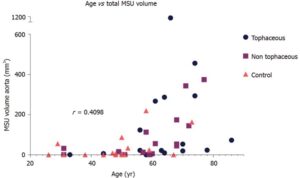
World J Radiol. 2020 Aug 28;12(8):184-194
https://www.wjgnet.com/1949-8470/full/v12/i8/184.htm
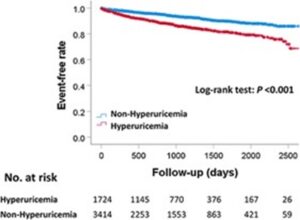
2013年4月から2019年3月までのPCI後の慢性冠症候群患者をClinical Deep Data Accumulation System(CLIDAS)のデータベースに登録し、心血管し、心筋梗塞、心不全による入院の複合MACEの発生率を高尿酸血症群1724例と非高尿酸血症群3414例で比較した。
MACEの発生率は、高尿酸血症群13.1%に対して非高尿酸血症群では6.4%と有意差を認めた。
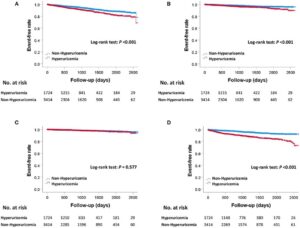
多変量Cox回帰分析により、年齢、性別、肥満度指数、推定糸球体濾過率、左主病変または三枝病変、高血圧、糖尿病、脂質異常症、心筋梗塞の既往、および心不全による入院歴について複数の調節後でも高尿酸血症はMACEの増加と有意な関連を認めた(HR1.52)。心不全による入院の増加はHR 2.19で有意な関連を認めたが、心血管死または心筋梗塞は関連していなかった。
Front. Cardiovasc. Med., 10 January 2023 Sec. Coronary Artery Disease
Volume 9 – 2022 | https://doi.org/10.3389/fcvm.2022.1062894
https://www.frontiersin.org/journals/cardiovascular-medicine/articles/10.3389/fcvm.2022.1062894/full
無症候成功尿酸結晶に対する治療介入が腎臓を始め臓器保護効果を示したとする介入研究
クレアチニンが1.35mg/dLを超えているCKD診療ガイドライン2012患者におけるRCT(randomized controlled trial)研究において、アロプリノールによる高尿酸血症治療群とコントロール群での1年後の血清クレアチニン値の上昇を比較すると、血清クレアチニン値はアロプリノール群では有意な上昇を示さず、コントロール群では有意な上昇を示し、アロプリノールによる高尿酸血症の治療はCKD患者の血清クレアチニン値の上昇を抑制した。
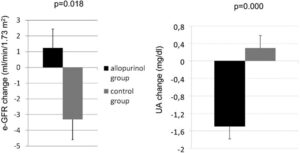
J Am Soc Nephrol 2010 5 1388-1393
アロプリノールの副作用:皮疹、かゆみ、関節痛、貧血、紫斑、リンパ節症、腎機能異常、食欲不振、胃部不快感、何遍、下痢、全身倦怠感、脱毛などが報告されているが、重篤な副作用として中毒性表皮壊死融解症、皮膚粘膜眼症候群Stevens-Johnson syndrome、剥離性皮膚炎があり、やや使いづらい薬である。
薬理作用としてはキサンチンオキシダーゼを阻害することにより尿酸の生成を抑制し、血中および尿中の尿酸量を低下させる。
参:
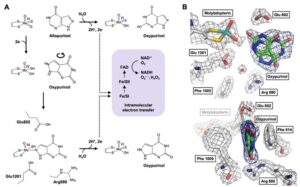
オキシプリノールを高尿酸血症モデルマウスに直接投与すると、アロプリノールよりも弱い尿酸降下作用が得られる。XORが触媒するアロ婦リールからオキシプリノールへの反応は、酵素活性部位でのオキシプリノールの回転とモリブデンMo(VI)活性中心のMo(IV)への還元をもたらし、強固な配位結合の形成と尿酸生成抑制効果をもたらす(図1A)。Mo(VI)へ再酸化されるとオキシプリノールの結合は大きく弱まり(図1B)、阻害剤-酵素複合体の再構築にはヒポキサンチン、キサンチン、アロプリノールによる還元が必要である。
A:アロプリノールはXORのモリブデン中心でオキシプリノールに変換され、水分子から酸素を受け取る(上)。
電子は2つの鉄硫黄クラスターを経由してFADに渡り、NAD+(XDH)またはO2(XO)を還元する。反応の過程でモリブデンは、基質としてのプリン、すなわちアロプリノール(中)から電子を受け取ることによって、Mo(VI)からMo(IV)に還元される。こうして形成されたMo(IV)は一過性にしか生じないが、オキシプリノールが適切に配向すると、阻害剤-酵素複合体を形成する(下)。
還元型XORのモリブデン中心-オキシプリノール複合体は徐々に再酸化され、オキシプリノールは解離する。
B:遊離のオキシプリノールはモリブデンと明確な結合を示さず、その阻害効果は著しく減弱する。再結合にはほかの基質(ヒポキサンチン、キサンチン、アロプリノール)が必要である。
また、XORのモリブデン中心が触媒する二段階反応(ヒポキサンチン→キサンチン→尿酸)に対し、オキシプリノールはヒポキサンチンからキサンチンへの変換を弱く阻害するだけで、プリン新輝合成をフィードバック阻害する可能性が低い(図2)。さらに、オキシプリノールによるプリンヌクレオシドホスホリラーゼ(PNP)の弱いアロステリック阻害が観察された。PNPの欠損は主にTGF-β細胞の機能障害を通して免疫不全を誘発することがわかっている。
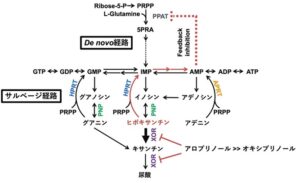
尿酸はXORが触媒する二段階反応(ヒポキサンチン→キサンチン→尿酸)によって生成され、ヒポキサンチンの方がXORの基質として優れている。アロプリノールはヒポキサンチンからキサンチンへの変換を阻害でき、ヒポキサンチンを蓄積させる。ヒポキサンチンはヒポキサンチンホスホリボシルトランスフェラーゼ(HPRT)が触媒するサルベージ経路を介してde novo経路の律速酵素であるホスホリボシルピロリン酸アミドトランスフェラーゼ(PPAT)を阻害し、プリン体合成を抑制する。したがって、尿酸を効果的に低下させるには、ヒポキサンチンからキサンチンへの段階を強く阻害することが不可欠であるが、XORのモリブデン中心から遊離したオキシプリノールはこの段階に対する阻害は極めて弱い。
https://www.a.u-tokyo.ac.jp/topics/topics_20230901-2.html
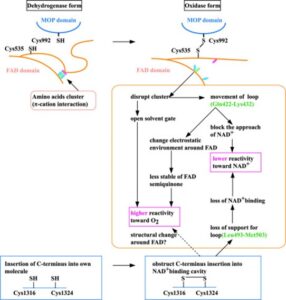
J Biol Chem 2005 280 24888-24894
https://www.jbc.org/article/S0021-9258(20)65640-X/fulltext
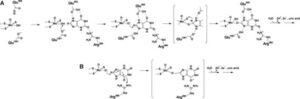
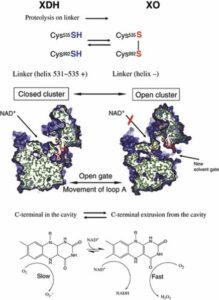
FEBSJ 2008 275 3278-3289
https://febs.onlinelibrary.wiley.com/doi/10.1111/j.1742-4658.2008.06489.x
ALL-Heart(Allopurinol versus usual care in UK patients with ischaemic heart disease)試験
イングランドとスコットランドの18地域施設で424のプライマリケア診療所から募集された60歳以上で虚血性心疾患を患っているが痛風の病歴のない症例に対して、アロプリノールを1日600mgに増量した経口アロプリノールを投与するか、通常のケアを継続する二群に分け、主要アウトカムとして、非致死性心筋梗塞、非致死性脳卒中、または心血管死の複合エンドポイントを見る研究である。
2014年2月7日から20147年10月2日の間に5937例が登録された。アロプリノール群2853例、通常ケア群2868例で4.8年の平均追跡期間で主要評価項目の発現率に有意差を認めなかった。
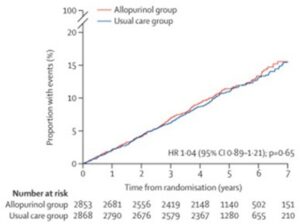
Lancet. 2022 Oct 8;400(10359):1195-1205.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(22)01657-9/fulltext
この研究の登録者のベースラインの血清尿酸値は5.7mg/dLであり、アロプリノール治療群の尿酸値は平均3.7mg/dLとなっており、痛風発作のない、尿酸値5.7mg/dLからの尿酸低下作用以外のアロプリノールの効果、すなわちXORからの活性酸素の生成を抑制することが主要エンドポイント抑制につながるかを検討した試験と解することもできる研究である。
つまり、尿酸値が低い症例においては、アロプリノールによるXORからの活性酸素を抑制しても、有効性は見られなかった研究と解釈することもできる。
ヒトのプリン代謝最終生成物である尿酸は、痛風の原因となるだけでなく、高血圧、心房細動、慢性腎臓病、心不全、冠動脈疾患、心血管死などの血管疾患の発症にも関与している可能性がある。
ヒト以外の動物はウリカーゼがあり、尿酸をさらに代謝するので血清尿酸値は低い。ヒポキサンチン→キサンチン→尿酸の二段階反応にXORが触媒として作用し活性酸素種を作り出すことにより、酸化ストレスや炎症を増加させ、NOや血管内皮機能を低下させ、心血管疾患を発生・増悪させる可能性がある。
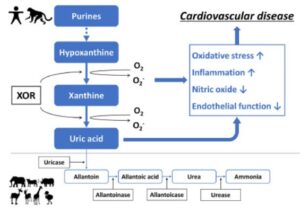
J Cardiol. 2021 Jul;78(1):51-57.
https://www.journal-of-cardiology.com/article/S0914-5087(20)30415-9/fulltext
高尿酸血症の原因を考え治療することが重要となってくる。
高尿酸血症はメタボリックシンドロームの診断基準には含まれていないが、血清尿酸値が高いほどメタボリックシンドロームの頻度は高く、逆にメタボリックシンドロームの因子数が多いほど血清尿酸値は高い。
高尿酸血症・痛風患者ではメタボリックシンドロームを高頻度に合併し、血清尿酸値とメタボリックシンドロームの構成要素である、内臓肥満、高血圧、抗中性脂肪血症、インスリン抵抗性の間にも関連がある。
内臓脂肪の蓄積により、遊離脂肪酸FFAが門脈を介して肝臓に流入し、中性脂肪および超低比重リポ蛋白VLDLの合成が亢進し、高中性脂肪血症を来すとともにインスリン抵抗性、高インスリン血症が引き起こされる。インスリン抵抗性、高インスリン血症と血症尿酸値には正の相関を示す。
痛風患者ではメタボリックシンドロームの頻度が健常者に比べ有意に高い(37%vs21%:J Clin Rheumatol 2010 16 109-112)。
内臓脂肪の蓄積に伴って尿酸クリアランスは低下し、血清尿酸値は上昇する。高インスリン血症は、腎尿細管における尿酸の再吸収を促進し、血清尿酸値を上昇させる。

ヒトの体内尿酸プールは、成人男性でおよそ1200mg、成人女性でおよそ600mgである。食事由来のプリン体摂取、生体内のプリン体合成や細胞崩壊の結果、1日あたり700~800mgのプリン体が尿酸プールに入ってくるが、ほぼ同僚の尿酸が体外に排泄されるので尿酸プールは一定量に維持されている。
尿酸の薬2/3は腎臓から、残りのほとんどは腸管から排泄される。
腎臓において、尿酸は糸球体で濾過された後、尿酸上皮細胞の尿酸トランスポーターを介して再吸収と分泌が行われ、最終的には糸球体で濾過された尿酸の7~10%が尿中に排泄される。したがって、尿酸の産生が増加した場合や尿酸の排泄が低下した場合に尿酸プールが増大し高尿酸血症を来す。
高尿酸血症は、尿酸排泄低下型(約60%)、尿酸産生過剰型(約10%)そして両者の混合型(約30%)に分類されてきた。
尿酸排泄低下型は、尿酸クリアランス(CUA)または尿酸クリアランス/クレアチニンクリアランス比(CUA/CCr)の低値により判定される。

尿酸産生過剰型は、尿中への尿酸排泄量が増加していることにより判定される。
日常臨床で尿酸の産生量を測定することは困難であるが、尿酸産生量に応じて尿中尿酸排泄量が増減することから、尿中尿酸排泄量を尿酸産生量の指標とし、尿中尿酸排泄増加を持って尿酸産生過剰と見なしてきた。

近年、尿酸排泄に働くトランスポーターであるABCG2が腎臓や腸管からの尿酸排泄に関与し、ABCG2機能低下により尿酸の腸管排泄が減少する結果、腎臓からの尿酸排泄が増加しやすくなることが明らかになった。つまり、尿中の尿酸排泄量からは、見かけ上、尿酸産生過剰の所見を呈する。そこで、この尿酸の腸管排泄減少による高尿酸血症は、腎外排泄低下高尿酸血症として病系に新たに追加された。
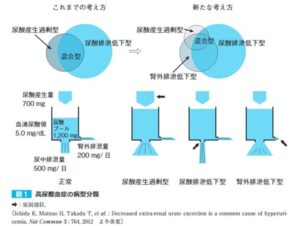
高尿酸血症患者にABCG2機能低下型一塩基多型の頻度が高いことから、高尿酸血症全体において、腎外排泄低下が関与している高尿酸血症が多いと推定される。しかし、臨床検査上、真の尿酸産生過剰型と腎外排泄低下型の高尿酸血症の区別はつかず、それぞれの頻度は不明である。
現時点では、ABCG2遺伝子の機能低下型一塩基多型などからABCG2機能低下の存在を証明することが腎機能排泄低下形鋼尿酸結晶と判定する根拠となる。
腎外排泄低下形鋼尿酸結晶の存在が明らかとなったため、尿中尿酸排泄量の増加を認める高尿酸血症をすべて尿酸産生過剰型と呼ぶことは誤解を招くため「腎負荷型高尿酸血症」という呼称が提唱されている。
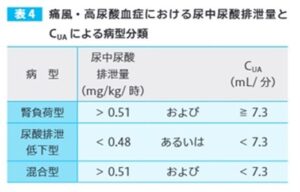
高尿酸血症の診断時、尿酸の産生と排泄のバランスは定常状態にあるので、治療開始前に数回、尿酸排泄量とCUAを測定することにより病型分類が可能である。

この際、腎機能について補正するためにクレアチニンクリアランス(CCr)を合わせて測定する。これらの測定は、一日尿量で行うが、数時間の尿量の測定でも可能である。
尿酸産生量および腸管からの尿酸排泄量の定量は困難なので、尿中尿酸排泄量により腎負荷の判定を行う。高プリン食制限下絶食飲水負荷時の尿中尿酸排泄量が0.51mg/kg/時より多いときに腎負荷型(尿酸産生過剰型と腎外排泄低下型)としている。尿酸排泄低下型はCUAまたはCUA/ CCrにより判定する。
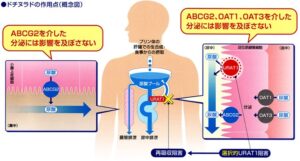
腎臓の近位尿細管において、尿酸輸送はトランスポーターを介して行われ、再吸収にはURART1が、分泌にはABCG2、OAT1、OAT3などが関与している。
腸管では、尿酸はABCG2を介して糞中に分泌される。
https://med.mochida.co.jp/medicaldomain/circulatory/urece/pick/clinicalstudy07.html
アルコール:
アルコールは体内で代謝される際に肝臓でATPを消費し、過剰摂取では肝臓での代謝時に内因性プリン分解を亢進することにより血清尿酸値を上昇させる。
また、アルコール飲料に含まれるプリン体の影響も重要で、酵母、麦芽由来のプリン体を多く含むビールが蒸留酒やワインよりも血清尿酸値を上昇させる。また、アルコールを含まないビール凍結乾燥水溶液は血清尿酸値を上昇させ、プリン体カット発泡酒は通常の発泡酒と比べ血清尿酸値を上昇させない。
アルコール飲料の際の血清尿酸値には、尿酸排泄量の上昇時、体内に乳酸が蓄積されURAT1が亢進する影響や、アルコールによる利尿作用による尿酸の濃縮も影響すると考えられる。
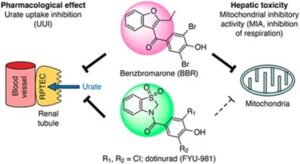
ベンズブロマロン(BBR)の構造的特徴に起因する欠点を克服するために、新規フェノール誘導体を合成したドチヌラド(ユリス)を作成した。
ACS Med. Chem. Lett. 2020, 11, 10, 2017–2023
https://pubs.acs.org/doi/10.1021/acsmedchemlett.0c00176
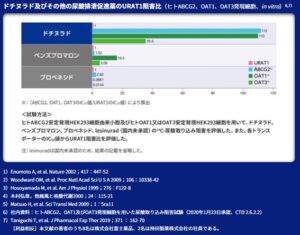
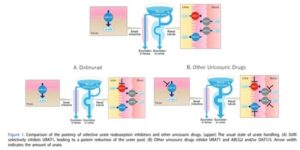
ドチヌラド(ユリス)のURAT1やABCG2、OAT1、OAT3の阻害作用を尿酸排泄促進薬と比較したものを下図に示す。湯リスのURAT1の選択性が高いことがわかる(選択的尿酸吸収阻害薬Selective Urate Reabsorption Inhibitor:SURI)。
https://med.mochida.co.jp/medicaldomain/circulatory/urece/pick/clinicalstudy07.html
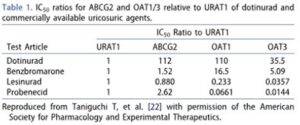
この阻害作用の選択制を図示すると下図のようになる。
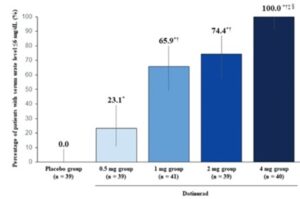
ユリスは投与量依存性に血清尿酸値の6mg/dL以下の症例数が増加している。
副作用も多剤に比べて多くなく、安全に使用できる薬剤といえる。

EXPERT OPINION ON PHARMACOTHERAPY2021, VOL. 22, NO. 11, 1397–1406
https://www.tandfonline.com/doi/full/10.1080/14656566.2021.1918102
25種類の血清尿酸作用薬がABCG2の輸送活性に及ぼす影響を調べた。
フェブキソスタットがin vitroでABCG2を阻害することが示された。
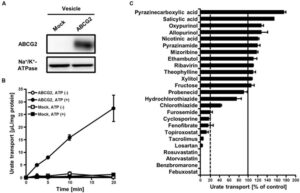
in vivoのデータとしてマウスの腸においてもフェブキソスタットはABCG2を阻害することが示された。
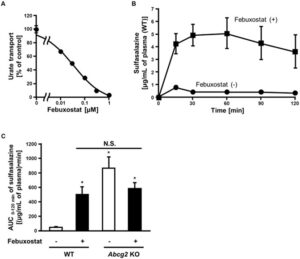
フェブキソスタットを投与するとABCG2基質薬物の薬物動態及び有効性を改善する可能性がある(A)。
尿酸低下薬としてのベンゾブロマロン(Ben)、フェブキソスタット(Feb)、トピロキソスタット(Top)の相殺メカニズムを図示する(B)。
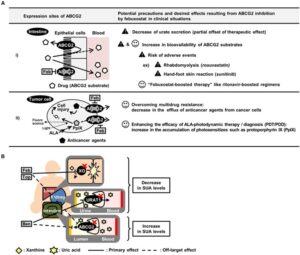
Front Pharmacol. 2016 Dec 27:7:518.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5187494/
2016年4月から2017年3月までの日本のレセプトとデータと健康診断データを用いて、高尿酸血症と痛風の有病率および患者の特徴と治療を分析した。
データベースに登録された2531383例のうち、1.1%(男性1.9%、女性0.09%)が痛風、2.6%(男性4.1%、女性0.4%)が無症候性高尿酸血症と診断された。健康診断613097例のデータでは、血清尿酸値が7.0mg/dlを超える高尿酸血症と診断されたのは、13.4%(男性19.6%、女性1.0%)であった。
これらの高尿酸血症患者のうち、痛風は全体で4.6%(男性4.7%、女性0.9%)が診断された。無症候性高尿酸血症は、全体で10.2%(男性10.3%、女性7.5%)デ診断された。この割合は、特に若年者で低かった。
痛風と特定された患者の80.7%と無症候性高尿酸血症と特定された患者の72.4%に尿酸低下薬(ULT)が処方された。
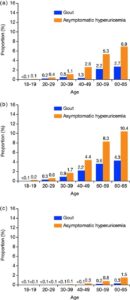
Prevalence of diagnosed gout and asymptomatic hyperuricemia. (a) Overall, (b) Male, (c) Female.
痛風または無症候性高尿酸血症の患者のうち、健診データから血清尿酸値が得られた患者30013例のうち、血清尿酸値が6.0mg/dlを達成した患者の割合を算出したのが下図である。ULTが処方されなかった患者の19.0%、ULTによる治療を受けている患者の44.3%、フェブキソスタットの46.8%、アロプリノールの35.4%、ベンズブロマロンの70.0%、トピロキソスタットの36.7%、プロベネシドの44.0%で目標を達成した。
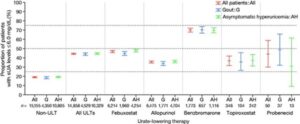
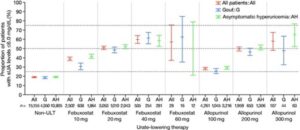
フェブキソスタットまたはアロプリノールのいずれかによるULTによる治療について、処方用量で層別化してみると、用量依存的に目標の達成率は増加する傾向があった。
研究期間中に診断された痛風20744例における痛風フレアの発生率は47.8%で0.74フレア/人年であった。
Modern Rheumatology, Volume 31, Issue 1, 2 January 2021, Pages 261–269,
https://academic.oup.com/mr/article/31/1/261/6299627?login=false
ユリスの血清尿酸低下率は用量依存的に増加している。

血清尿酸値6.0mg/dl以下の達成率は尿量依存的に増加している。
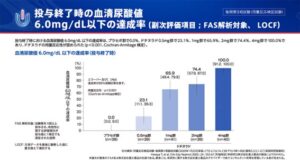
https://med.mochida.co.jp/medicaldomain/circulatory/urece/pick/clinicalstudy04.html
日本人500例、白人200例、アフリカ系アメリカ人100例でABCG2機能障害を検討した研究がある。
ABCG2の機能障害の重症度はQ126XとQ141Kの二つの機能不全バリアントの単純なジェノタイピングによって推定できる。日本人のQ126XとQ141Kのマイナーアレル頻度(0.025と0.275)は、白人(0.005と0.085)とアフリカ系アメリカ人(0と0.090)の頻度よりも優位に高かった。日本人の経度、中等度、重度のABCG2機能障害の割合(35.4%、12.4%、1.6%)は、白人(14.0%、2.5%、0%)およびアフリカ系アメリカ人(14.0%、2.0%、0%)よりも高かった。
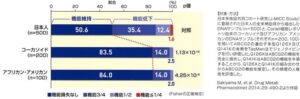
Drug Metab Pharmacokinet. 2014;29(6):490-2.
日本人は白人やアフリカ系アメリカ人に比べABCG2の推定機能低下の頻度がより高いと考えられる。
https://www.sciencedirect.com/science/article/abs/pii/S1347436715303700?via%3Dihub
ABCG2機能低下によって高尿酸血症となっている頻度が高いと考えられる日本人においては、ABCG2機能を低下させる作用が弱いユリスの使用を考慮する必要性が他の民族よりも高いと言える。
参:90人の高尿酸血症患者におけるABCG2遺伝子の塩基配列決定によりQ126Xを含むいくつかの非機能的ABCG2変異が明らかになった。739人の定量的形質遺伝子座解析により、ABCD2の一般的な機能不全変異体であるA141Kが血清尿酸値を上昇させることが示された。Q126XはQ41Kとは異なる疾患ハプロタイプに割り当てられ、痛風リスクを増加させ、オッズ比は5.97であった。さらに、痛風患者の10%で遺伝子型の組み合わせが認められ、ABCG2機能が75%以上低下した(オッズ比25.8)。

Sci Transl Med. 2009 Nov 4;1(5):5ra11.
https://www.science.org/doi/10.1126/scitranslmed.3000237
参:ABCG2の推定機能が1/4に低下することによる血清尿酸値の上昇は、身長170㎝の人で体重の5.7㎏増加、ウイスキー1.7L/週の飲酒量、47.6歳の加齢と同じ程度であると推計される。

参考文献:
高尿酸血症・痛風の治療ガイドライン第3版
高尿酸血症・痛風の治療ガイドライン 第3版 2022年追補版
https://minds.jcqhc.or.jp/common/summary/pdf/c00476_supplementary.pdf
























