川村所長の勉強会参加記録
2018.07.19
メタボと動脈硬化の接点 鍵はTG 平野勉教授
2018年7月17日
演題「メタボと動脈硬化の接点 ―その鍵は中性脂肪にある―」
演者:昭和大学医学部内科学講座糖尿病・代謝・内分泌内科部門教授 平野勉先生
場所:青葉台フォーラム
内容及び補足「
Stiner G先生の下で留学していた時に
『北米の2型糖尿病の70%は、ハートアタックで死亡する』、『2型糖尿病のハートアタックの最大の原因は中性脂肪である』と言い切られたため、自分の中性脂肪研究が始まった。
動脈硬化性心血管疾患(ASCVD: Atherosclerotic Cardiovascular Disease)の最大のリスク因子はLDLコレステロールと言われていた。1990年代後半からHDLがもてはやされるようになってくるとともにTGへの関心は薄れてきていた。しかし、HDLを上昇させる薬の研究がことごとく失敗したこと、HDL濃度に寄与する遺伝子がASCVDへの関与がほとんどないことから、HDLへの注目は減少し、再びTGが注目されるようになってきた。
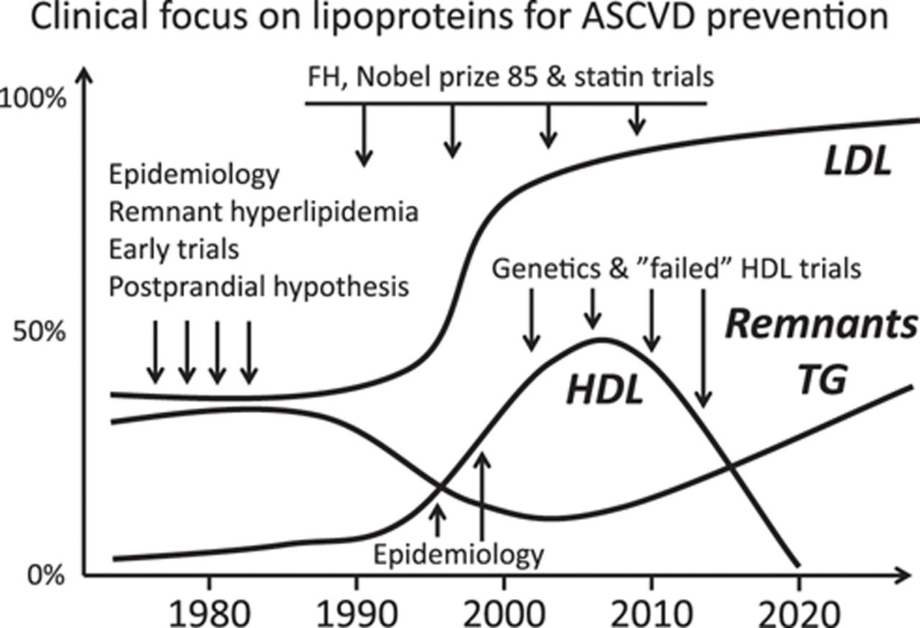
http://circres.ahajournals.org/content/118/4/547.figures-only
動脈硬化性疾患予防ガイドライン2017年版が出され、2018年7月12日~14日にかけて行われた第50回日本動脈硬化学会総会で『ガイドライン2017の総括と次期改訂へ向けた提言』の演者に選ばれ、中性脂肪について担当することになった。
問題点は高TG血症や食後高脂血症をガイドラインでどう扱うかである。
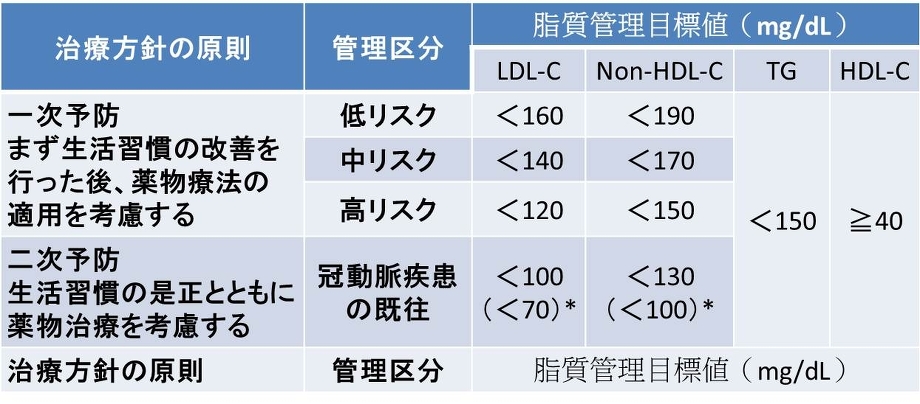
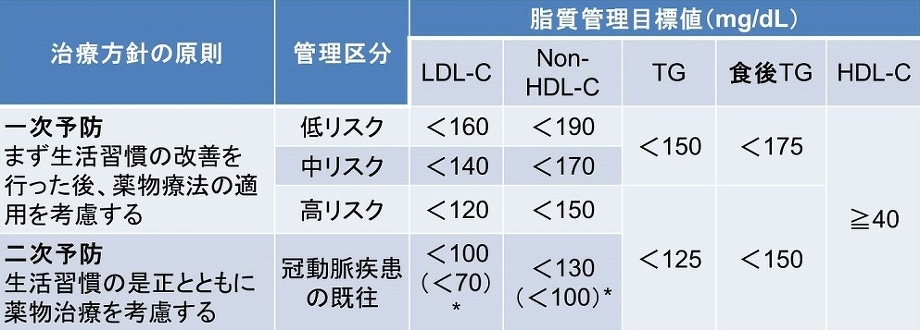
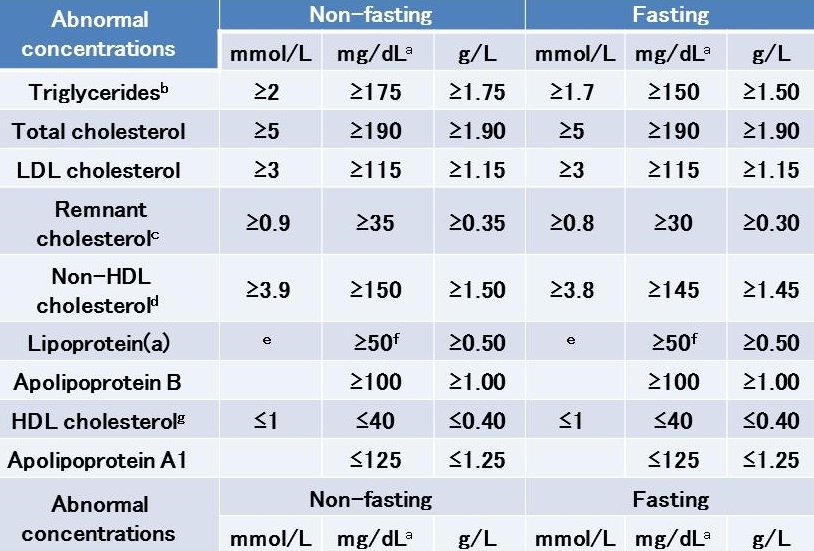
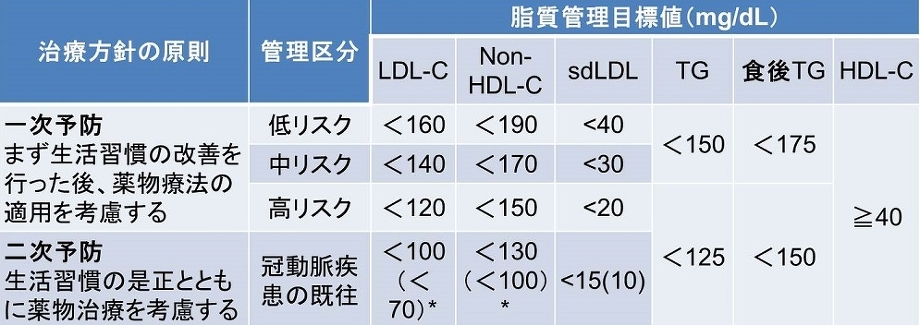
ガイドラインのリスク区分別脂質管理目標値は以下の表のようになっており、TGは150を超える値という一つの指標しかない。
CQ5:TGは日本人の動脈硬化性疾患の発症・死亡を予測するか?
2017年のガイドラインP25の記載は『レムナントの上昇やsmall dense LDLの増加など他の因子を十分考慮する必要がある』と記載されている。
TGの血清レベルでMI、Ischemic Stroke、Revascularization、Cardiovascular death、All vascular eventsをみてみても有意さは出てこないが、食後のTG値で評価してみるとIschemic strokeやAll cardiovascular eventsでは有意なデータとなっている。
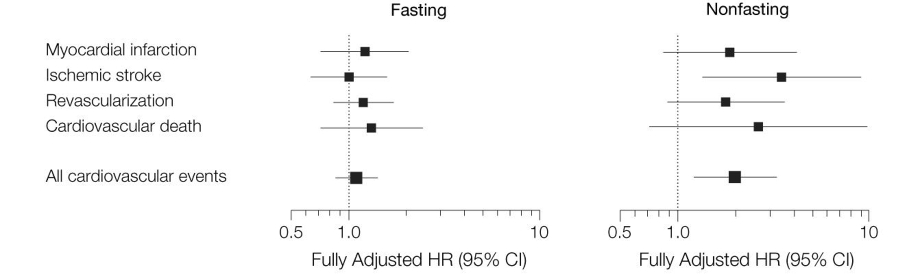
https://jamanetwork.com/journals/jama/fullarticle/208018
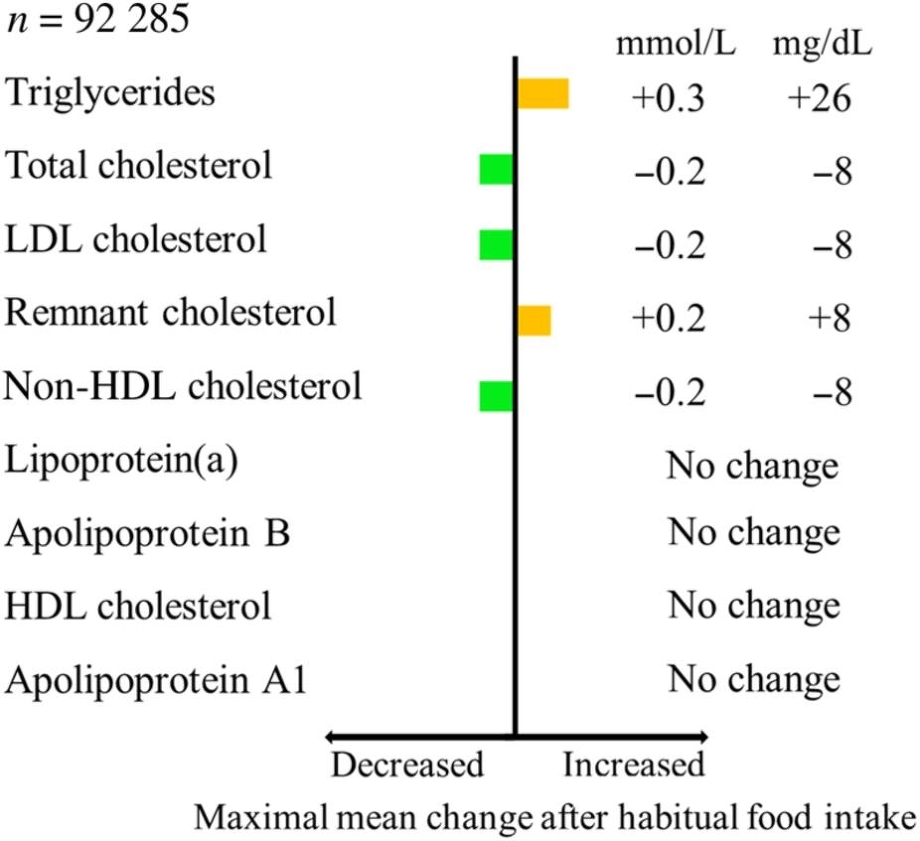
食後の脂質の変化をBorge G. Nordestgaardらは、アメリカの一般人の男性98132名、女性111048名で測定した。TGは食後6時間ほどしないと低下しない。
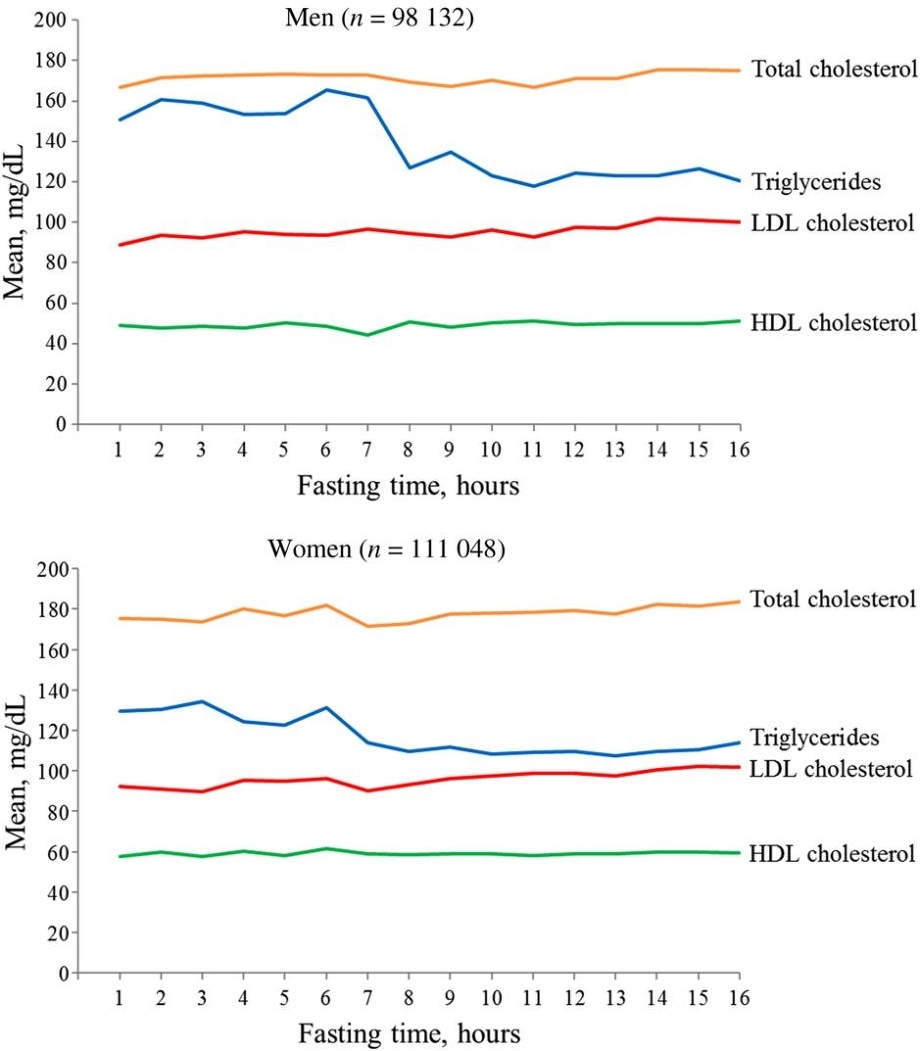
空腹時と食後値での平均の差を見てみると、TGでは+26となる。食後にかなりの高値例を臨床上経験することが多いが、一般事人口の多数例で平均値をとるとこの値になることに驚いた。
https://academic.oup.com/eurheartj/article/37/25/1944/1749006
自分の教室でも63名の2型糖尿病患者で、ある程度治療で安定したところにおいてエネルギー制限食27kcal/㎏:脂肪分15g/食の食事を投与し時間変化を見てみたが、最大TG変化量は33㎎/dL、平均TG変化量は11mg/dLであり、糖尿病がある患者のデータではあるが、ほぼほぼ近い値と言える。
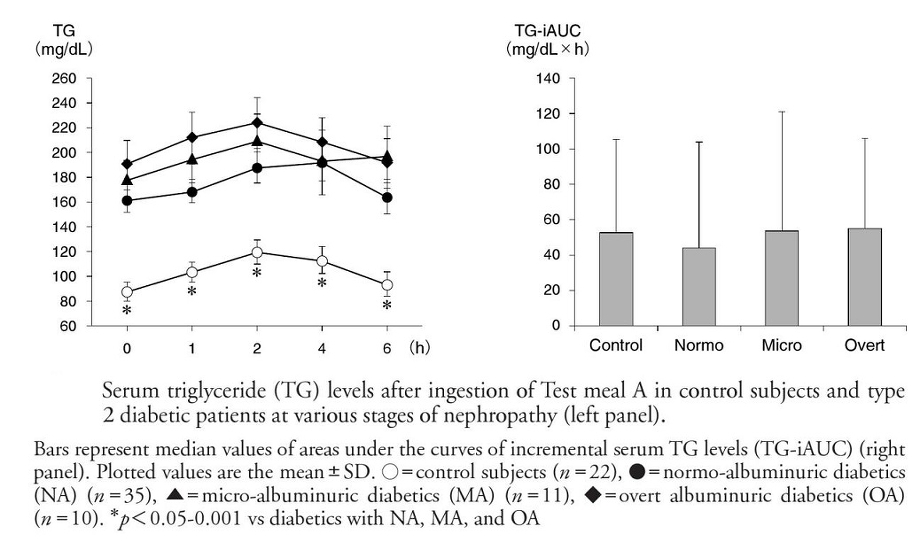
22人の健康なコントロールと56名の2型糖尿病患者にTest Meal A(460Kcal、18gfat)を投与し6時間にわたり血清TG値の変化を見てみた。コントロールに比べトウニョブヨウ患者では40%TGが高値であった。TGの変化量は糖尿病群で25mg/dL、コントロールで28mg/dLであった。
https://www.jstage.jst.go.jp/article/jat/15/4/15_E558/_pdf
脂肪を66g含むオフトクリーム投与し食後のTG値の変化を見てみたが、空腹時TG>150食後TG>230mg/dLが24例、空腹時TG>150食後TG≦230㎎/dLが4例、空腹時TG≦150、食後TG>230mg/dLが12例、空腹時TGTG≦150、食後TG≦230mg/dLが31例と食後の変化を予測することは困難であった。つまり、脂肪負荷により脂質管理目標値を設定することは困難と言える。
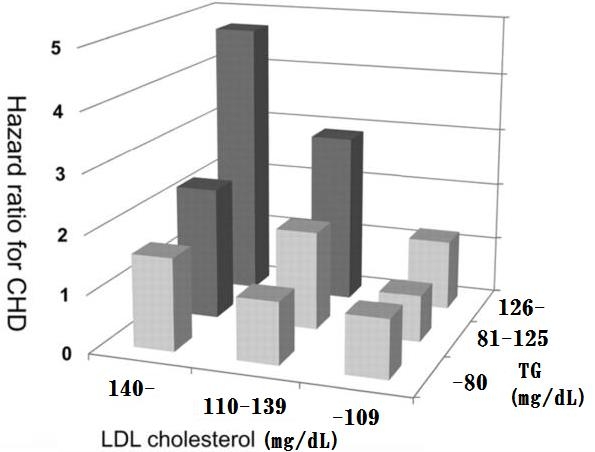
日本人糖尿病患者におけるCHDのリスクを検討するため、心疾患の既往が無い男性940名、女性831名(平均年齢58.2歳)の2型糖尿病患者で7.86年経過を見た。
LDLコレステロールが低い所ではTGの値での変化はないが、LDLコレステロールが110-139mg/dLにおいては、TGが126mg/dL以上において、LDLコレステロールが140mg/dL以上においては、TGが81-125mg/dLにおいてもリスクが上昇している。
このグラフを見ているとTGは80mg/dLが理想的に思える。
https://academic.oup.com/jcem/article/96/11/3448/2834535
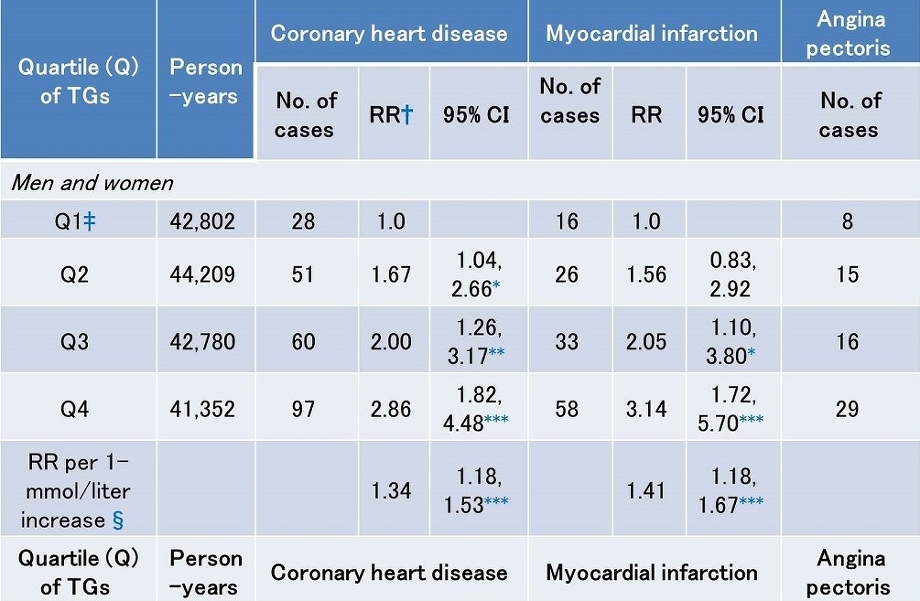
11068人の日本人で冠動脈疾患におけるTGの関係を検討した研究では、15.5年で133人の心筋梗塞、68人の狭心症、44人の突然死があった。これらの対象者のTG値を4分位で分けてみるとQ3でCHDリスクは2.00、MIは2.05、Q4では、それぞれ2.86、31.4と上昇している。食後高TG血症は冠動脈の強いリスク因子である。
https://academic.oup.com/aje/article/153/5/490/149843
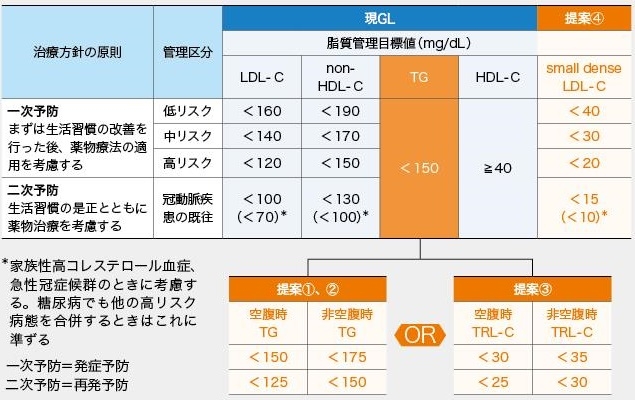
そこで高リスクの一次予防と二次予防はTG値をより厳しくし、食後TG値による目標値を設けてみた。
TG>2000㎎/dl、TG 250mg/dL、TG 150mg/dLの3つの血清のうち心筋梗塞になりやすいTG値は250/dLであり、TG>2000以上の人は心筋梗塞にはならない。

1型の高脂血症症例において、146㎝43㎏TG 1939mg/dL、TC 245mg/dL、HDL-C 20mg/dL、LDL-C 34mg/dLであった。この症例に於てい動脈壁には動脈硬化は認められなかった。1型の高脂血症を見つけるためのマーカーとしては、非常に低いLDL-CとHDL-Cが挙げられる。
https://www.atherosclerosis-journal.com/article/S0021-9150(01)00510-X/abstract
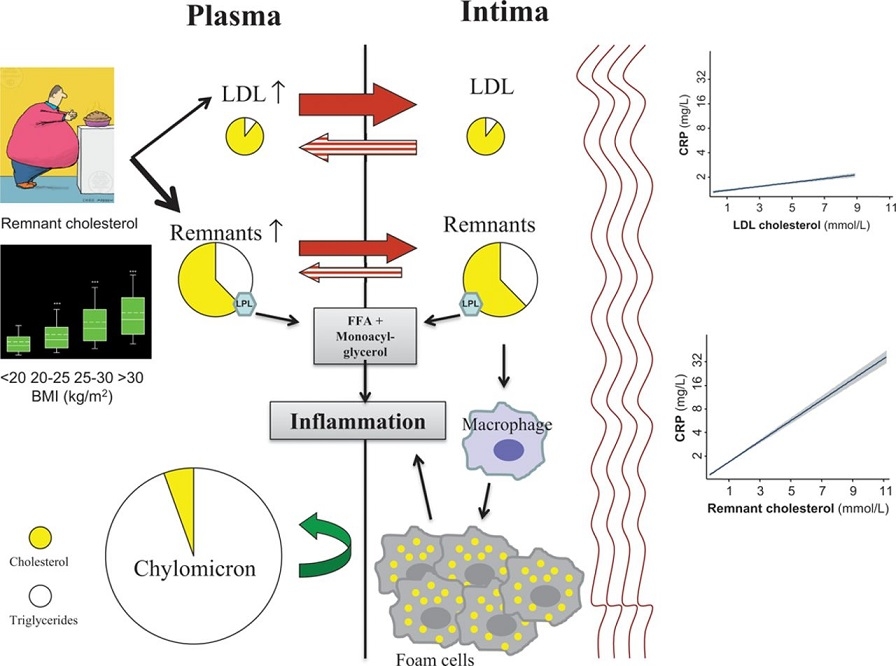
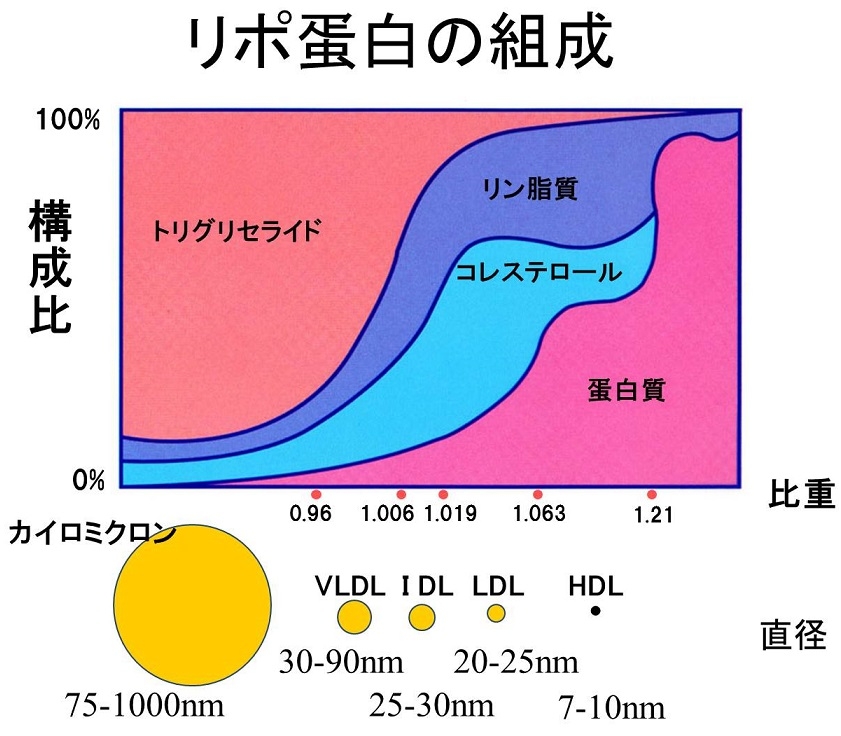
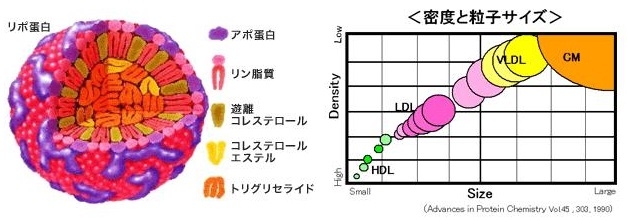
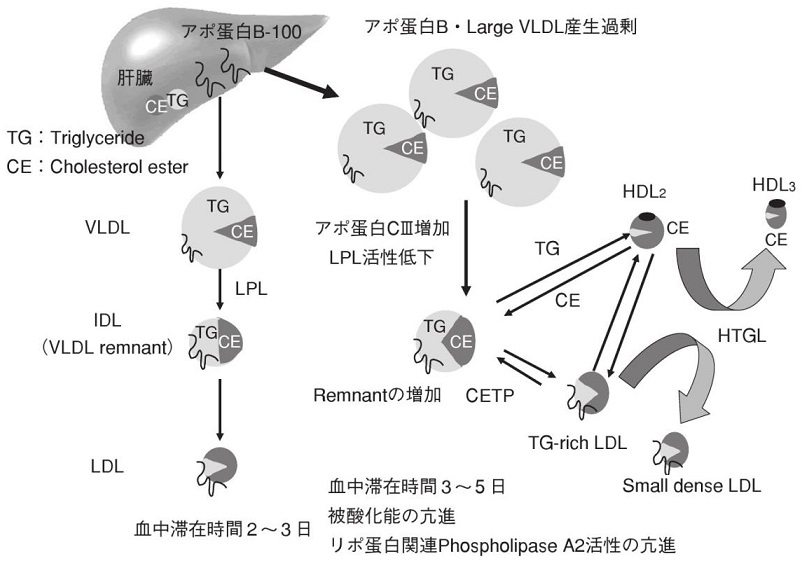
血中にはリポ蛋白の形で脂質は溶けている。カイロミクロンや大きなサイズのVLDLは血管壁を通過できないために、動脈硬化巣の発生には関係しない。
http://circres.ahajournals.org/content/118/4/547.figures-only
http://www.lipo-search.com/liposearch/subclass.html
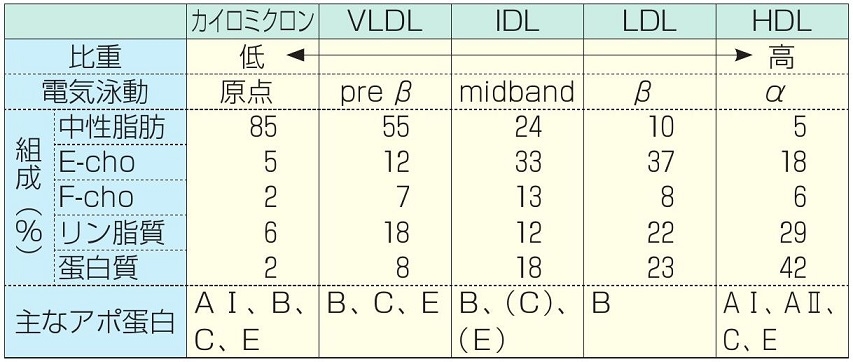
http://www.medic-grp.co.jp/images/sikkanbt/06a.pdf
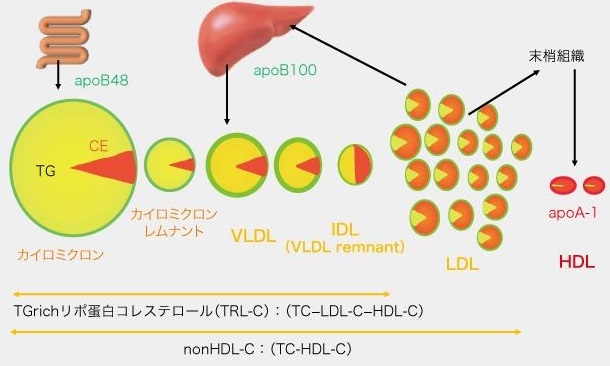
消化管から吸収されたTGはカイロミクロンの形で血管内に放出され、血管壁に存在するLipoprotein Lipase(LPL)により代謝され、カイロミクロンレムナント(CMR)に変化し、3型の高脂血症と腎不全患者以外の症例においては、短時間のうちに肝臓に取り込まれる。その際一部が血管内皮を通過する。その後、食事由来のカイロミクロンの供給が途絶えてくると、肝臓で合成されたVLDLが放出され、各臓器・細胞にエネルギーを供給することになる。VLDLも血管内皮にあるLPLにより代謝され、IDL、LDLに変化していく。
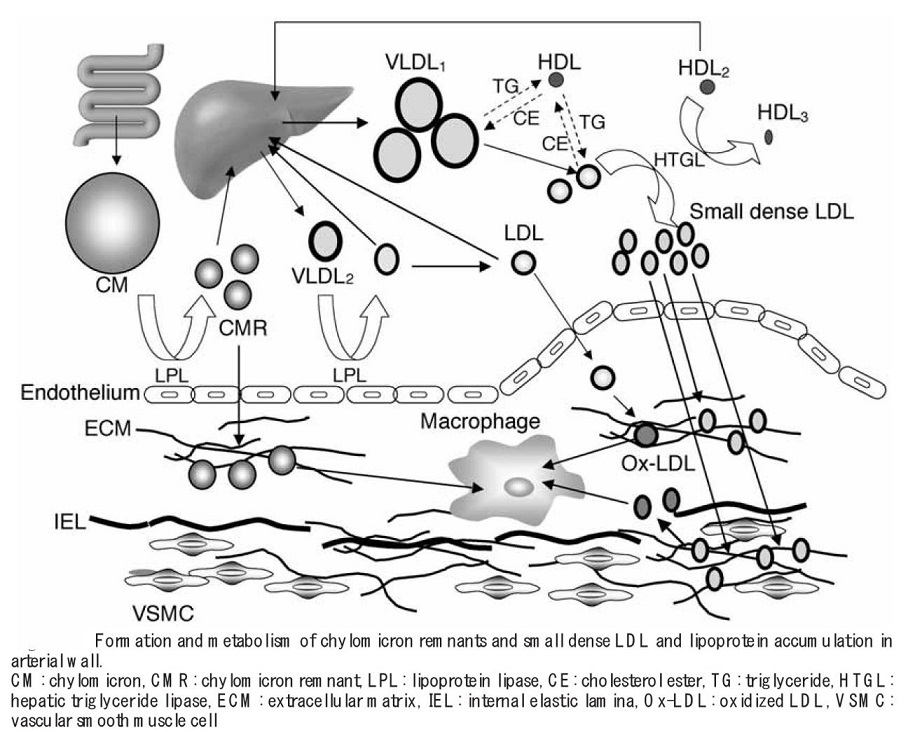
http://j-ca.org/wp/wp-content/uploads/2016/04/4608_5.pdf
Borge G. Nordestgaardがレムナントコレステロールという概念を提唱した。
レムナントコレステロール=TG rich lipoprotein Choesterol(TRL-C)=TC-HDL-C-LDL-CでLDLコレステロールは含まないものである。非空腹時の採血の場合には、この中にはカイロミクロンのコレステロールも含まれていることになる。最近動脈硬化学会で提唱されているnonHDL-CはTC-HDLでその値が示しているものは、ほぼほぼLDL-C量であるので異なるものである。
LDLコレステロール値で心筋梗塞の発症リスクでは有意にリスクが上昇しているが、全死亡を見てみるとリスクの上昇は見られないが、レムナントコレステロールでみると両者ともに優位であることがわかる。
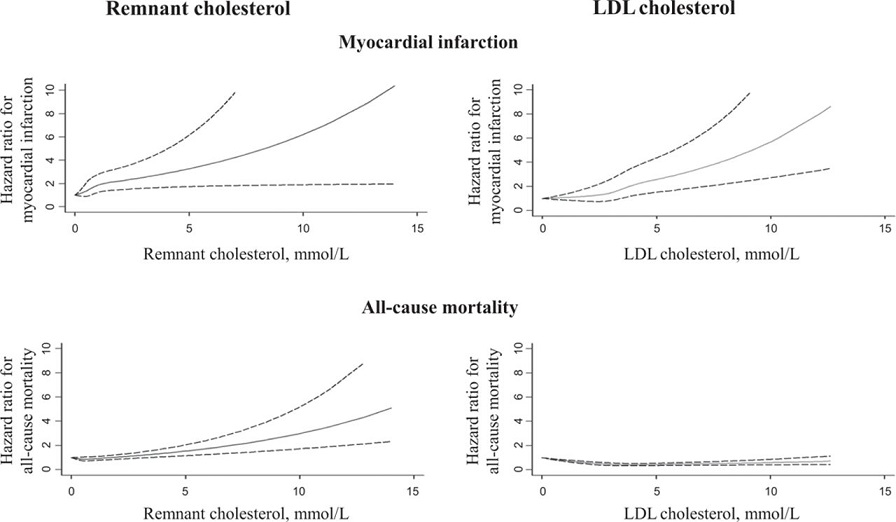
http://circres.ahajournals.org/content/118/4/547.figures-only
TGの分布を見てみると2mmol/L(176mg/dL)未満に3/4近くの症例が分布している。10mmol/L(880mg/dL)を超えるような症例は珍しく、おそらく単一遺伝子の異常だといえる。レムナントコレステロールの測定値も、TGとほぼ同様の分布を示している。
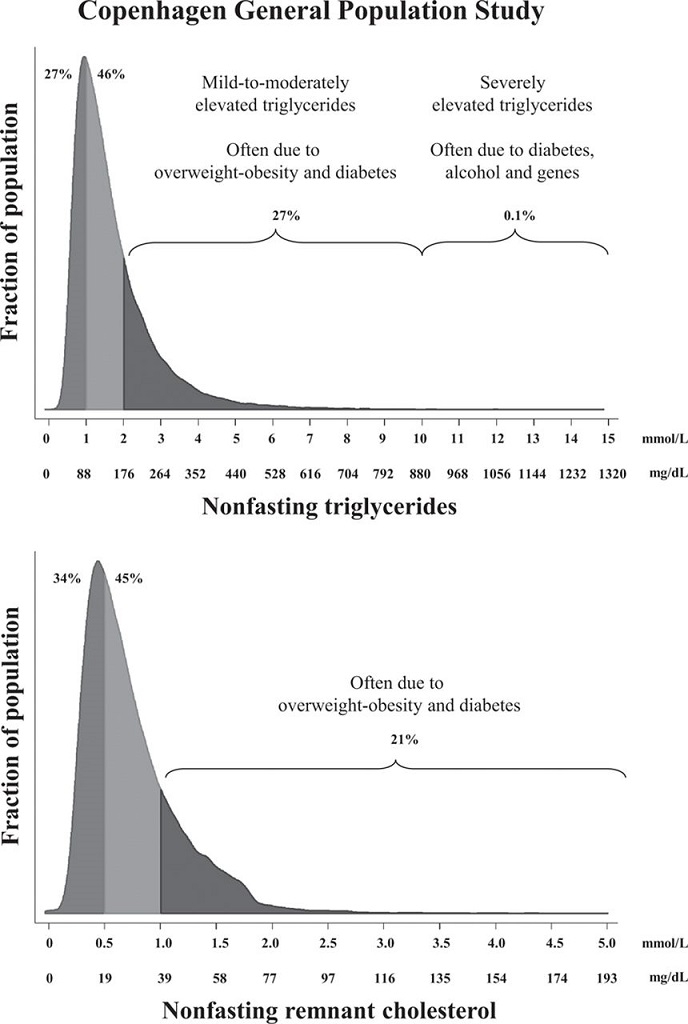
http://circres.ahajournals.org/content/118/4/547.figures-only
非空腹時の基準値を採用するほうがより有用な情報だといえる。ただし注意しておかなければならないのは、TG>400以上では使用すべきではないという点である。
https://academic.oup.com/eurheartj/article/37/25/1944/1749006
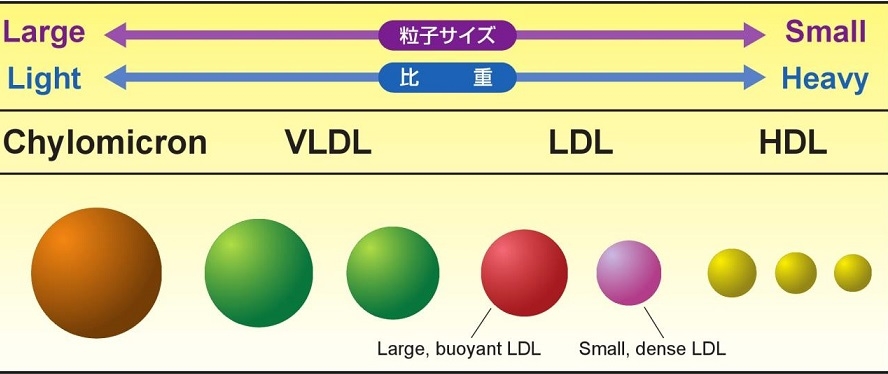
血管壁の中に動脈硬化を惹起するものはコレステロールであり、そのほとんどはLDL粒子のものである。動脈硬化巣にはTGは存在しない。しかし、TGはLDLを小型であるsmall dense LDLにして、より動脈硬化巣をきたしやすくしている。
LDLのサイズで分類するとLarge buoyant LDLとSmall dense LDLに分けられる。
http://denka-seiken.jp/jp/content/files/pdf/lipid_journal/LipidJournal-small_dense_LDL_all.pdf#search=’Lage+Buoxant+LDL’
それぞれのリポ蛋白の特徴を見てみると

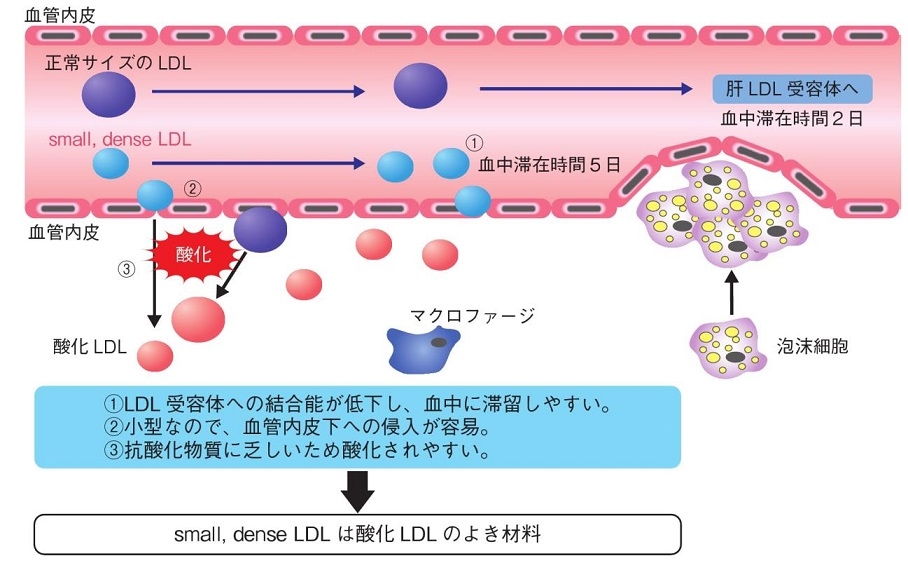
Small dense LDLは以下の特徴があるため、超悪玉コレステロールと言われている。
① 血液中に滞在する時間が、通常のLDLの場合は平均2日なのに比べ、5日と長いこと
② 血管壁のプロテオグリカンに付着しやすいこと
③ 小型の粒子なので血管内皮下に侵入しやすいこと
④ Small dense LDL粒子には、通常のLDL粒子に比較してコレステロール含有量が少ないが、それ以外にも脂溶性の抗酸化ビタミンなどの抗酸化物質が乏しいため酸化されやすい
⑤ 酸化されるとマクロファージに取り込まれ、泡沫化し、動脈硬化巣へと進展していく
http://denka-seiken.jp/jp/content/files/pdf/lipid_journal/LipidJournal-small_dense_LDL_all.pdf#search=’Lage+Buoxant+LDL’
血中で酸化されたLDL粒子は、即座にマクロファージなどに取り込まれたりするため、動脈硬化への関与は少ない。
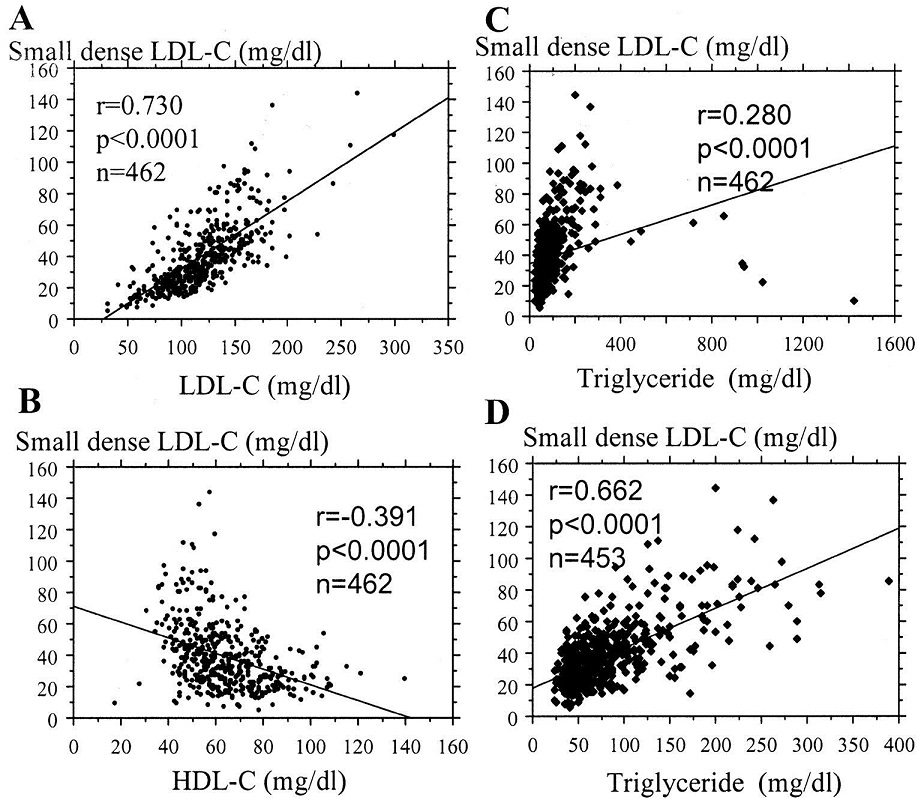
血清TG濃度とLDL粒子径を検討した研究を見てみると、TGが150以下だとLDL直径は25.5nmを超えており、大型のLDLだといえる。計算上LDL粒子径の説明寄与度はTG濃度が50%を占めていることになる。

http://denka-seiken.jp/jp/content/files/pdf/lipid_journal/LipidJournal-small_dense_LDL_all.pdf#search=’%E5%B9%B3%E9%87%8E%E5%8B%89+Apo+B’
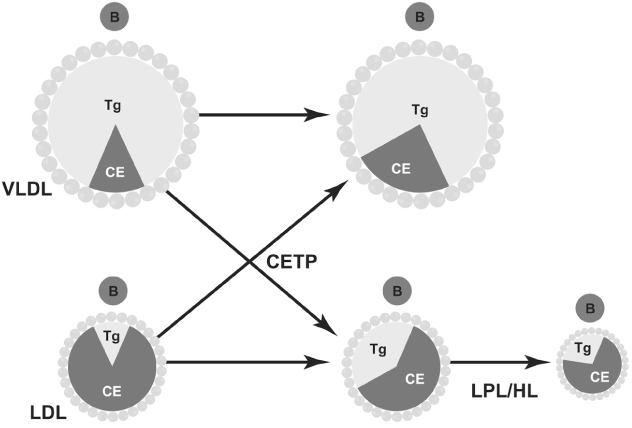
TGが多く含まれているカイロミクロンやVLDLとLDLの間でコレステロールと中性脂肪一対一でCETPにより交感されておりVLDLはコレステロールリッチに、LDLはTGリッチに変化していく。TGリッチになったLDLは血管内皮のLPLは肝臓にあるヘパテッィクリパーゼ(HL)によりTGはすぐに水解されてより小さく重い粒子であるSmall dense LDLやVery Small LDLに代謝されていく。
http://synapse.koreamed.org/DOIx.php?id=10.12997/jla.2012.1.1.1
https://www.jstage.jst.go.jp/article/shinzo/43/4/43_444/_pdf
https://medical-tribune.co.jp/news/2018/0725515186/
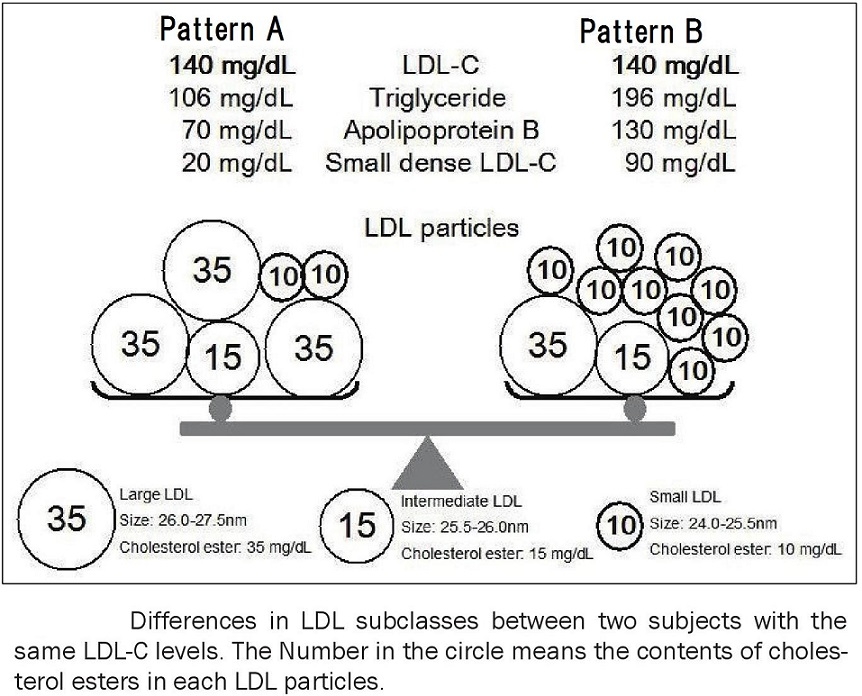
LDL-Cがともに140mg/dLでTG 106mg/dLのPattern Aの健常者とTG 196mg/dLのPattern Bのメタボの人の脂質プロファイルを見てみよう。Pattern Aの人はLarge LDLが多く、Small LDLが少ない。しかし、Pattern Bの人はLarge LDLが減少し、その代わりに数多くのSmall LDLが増加している状態となっている。
Small dense LDL-CとTGの値を見てみると400以上で除外する必要があることがわかる。
LDL-CとSmall dense LDL-Cは強い相関があるがLDL-Cの1/5程度の値であることがわかる。
http://atvb.ahajournals.org/content/24/3/558
メタボリックシンドロームの診断基準の中にLDLコレステロールが含まれていないのは、LDLコレステロールの値が上昇しないからである。高TG血症と低HDL血症があると、LDL-Cは上昇していない。しかし、LDL粒子数は増加している。
フラミンガム研究による、メタボリックシンドロームの構成員指数の増加とともにLDL-C濃度は軽度上昇したが、NMRで測定したLDL粒子数は著明に増加した。特にLarge LDLが減少し、Small LDLが増加した。
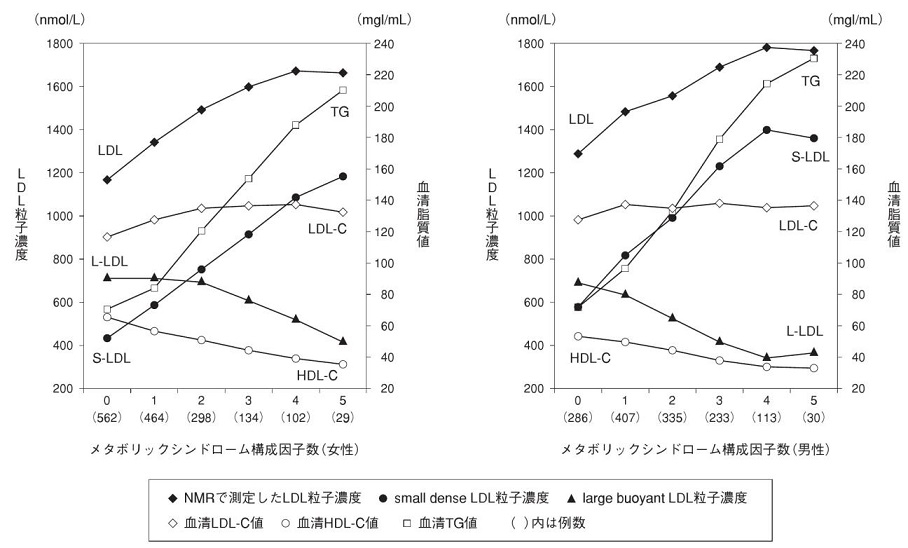
https://www.jstage.jst.go.jp/article/shinzo/43/4/43_444/_pdf
内臓脂肪面積が増加するとLarge LDLが減少し、Small LDLが増加した。Very small LDLはより顕著に増加した。
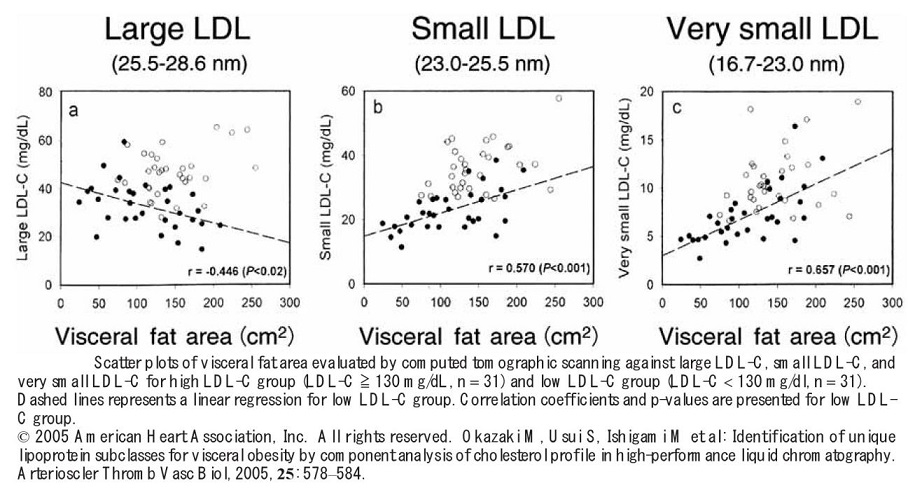
http://atvb.ahajournals.org/content/25/3/578
つまりSmall dense LDLはメタボリックLDLといえる。
家族性高脂血症の親子で検討したデータがある。娘はLDL-Cが300と高値であるがそのほとんどがLarge LDLであり、現時点での動脈硬化惹起性は低い。しかし、母親は閉経の影響か、LDL-Cの値に比してsdLDL-C濃度が高く、危険な状態である。
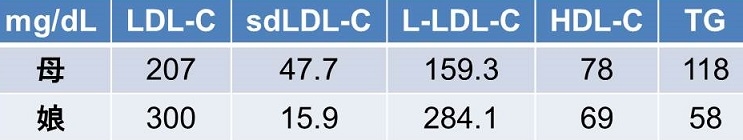
The Atherosclerosis Risk in Communities(ARIC) Studyにエントリーされていた11419人のsdLDL-C脳を祖測定した。
CHDのリスクをLarge LDLの4分位でみた場合とSmall dense LDLの4分位でみた場合、大型のLDLは有意な差はなく、Small dense LDLの濃度上昇に伴いRiskが増加していることがわかる。
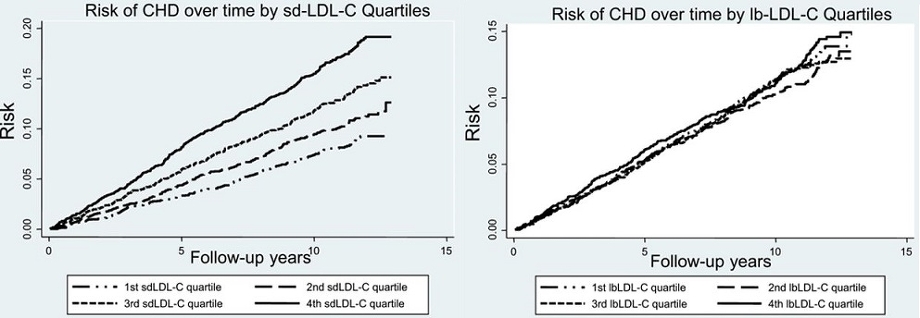
LDL-Cが100未満の群よりは100以上の分においてsdLDL-Cの上昇がHRを上昇させる。
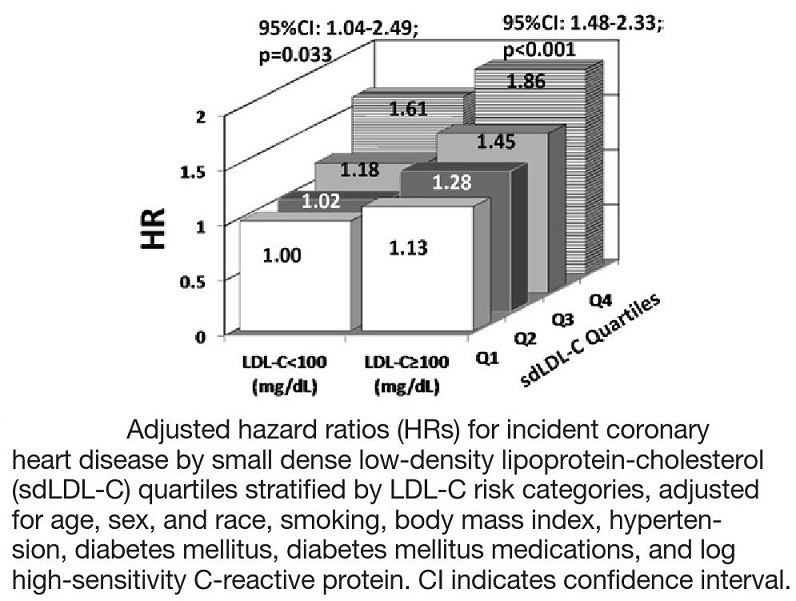
http://atvb.ahajournals.org/content/34/5/1069
sdLDL-Cの値を加味したガイドラインの案として以下のものを考えた。
https://www.jstage.jst.go.jp/article/jat/14/3/14_3_128/_pdf
https://medical-tribune.co.jp/news/2018/0725515186/
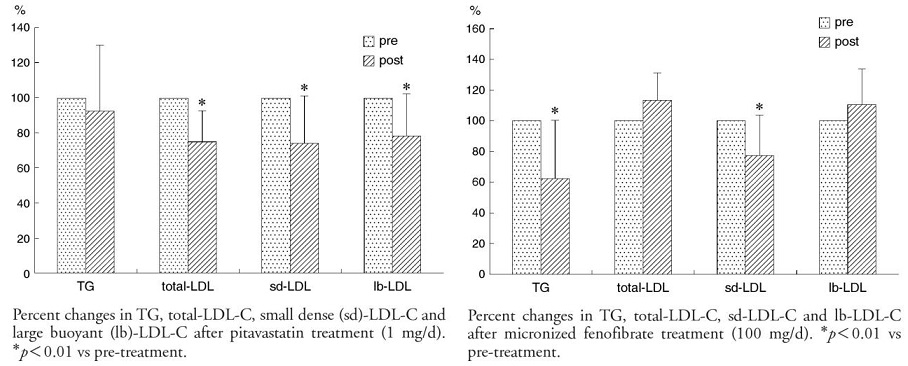
72人の2型糖尿病(平均年齢60.2歳)にPitavastatinとFenofibrateを投与して脂質のプロファイル変化を見た。
PitavastatinではLDL-Cは25%、TGは8%減少した。Sd-LDL-Cは26%、lb-LDL-Cも22%ともに低下した。一方Fenofibrateは、TGは38%減少し、HDL-Cが14%増加した。Sd-LDL-Cは23%減少したが、lb-LDL-Cが増加し、LDL-C値は変化なかった。
http://circres.ahajournals.org/content/118/4/547.figures-only
理論上、この両薬剤の併用投与が望ましいが、副作用の問題から、腎機能障害者においては、原則併用投与禁忌となっており、腎機能障害が無い対象者においては、厳重注意投与となっている。
K-877(ぺマフィブラート:パルモディア)投与による脂質変化を見てみると容量依存的にsd-LDL-C及びvery small LDL-Cも低下させている。
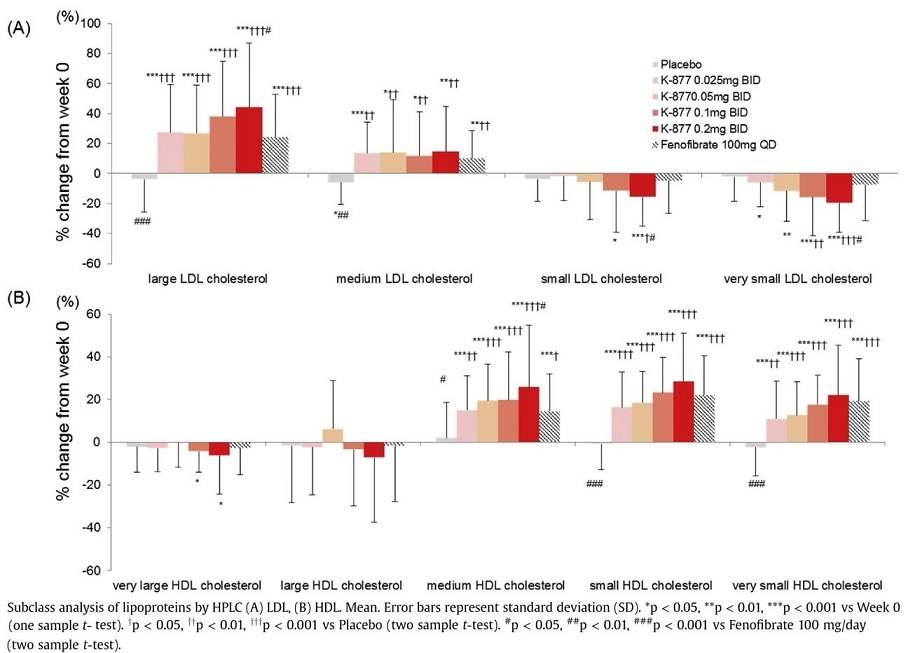
https://www.atherosclerosis-journal.com/article/S0021-9150(16)30072-7/pdf
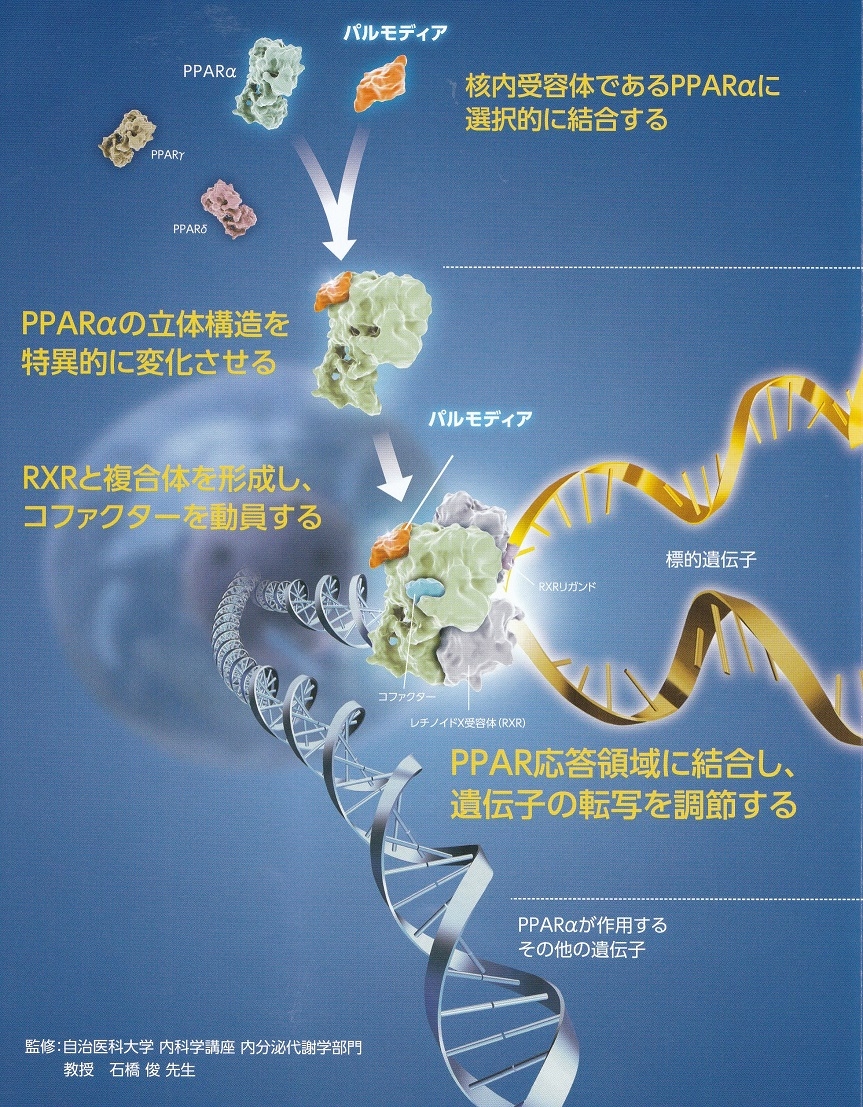
パルモディアはPPARγやPPARδに比べ、それぞれ5000倍、10000倍以上PPARαへの選択的な活性化が示されている。

作用機序としては核内授与対であるPPARαに選択的に結合し、PPARαの立体構造を特異的に変化させ、レチノイドX受容体(RXR)と複合体を形成し、コファクターを動員してPPARα転写を促進させ、LPLの活性化遊離脂肪酸からのTG合成を阻害する。
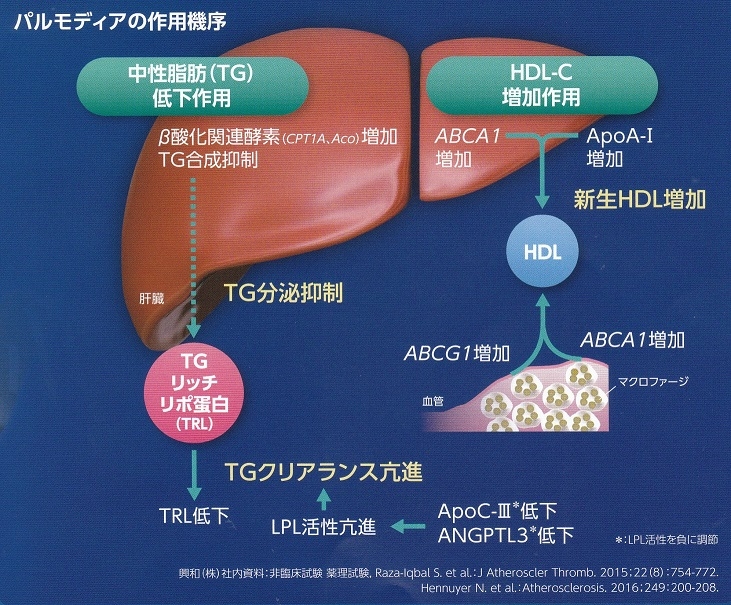
このパルモディアはスタチンとの併用試験を行っており、近い将来、スタチンとフィブラート薬剤の併用が心置きなく投与できる時が来ると信じている。
























