川村所長の勉強会参加記録
2016.05.30
CKDを考慮した血糖管理 豊田雅夫 先生
2016年5月26日
演題「CKDを考慮した血糖管理」
演者: 東海大学医学部 腎内分泌代謝内科助教授 豊田雅夫 先生
場所:横浜ベイシェラトン ホテル&タワーズ
内容及び補足「
CKD慢性腎臓病があると心血管疾患や死亡リスクが高いことがわかっている。1120295人の成人(平均年齢52歳、女性55%)をeGFRに着目して、2.84年経過を見た研究がある。
eGFRが45よりも低下したころから死亡や心血管イベントが増加しているのがわかる。
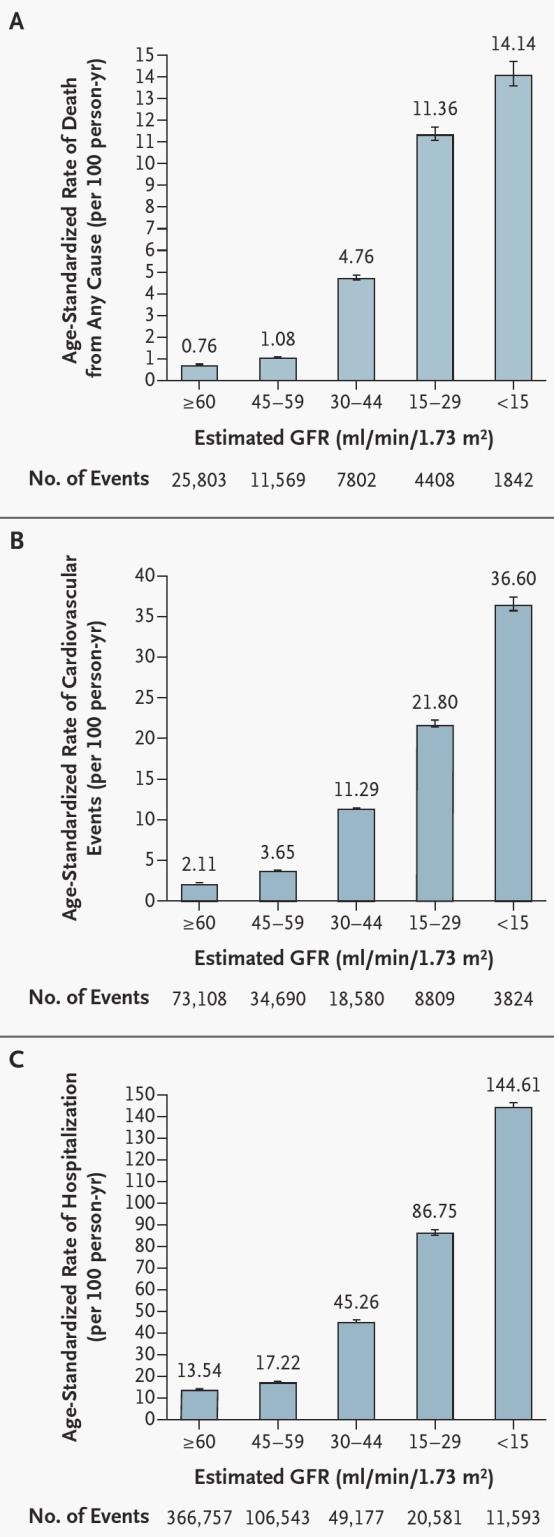

http://www.nejm.org/doi/pdf/10.1056/NEJMoa041031
日本人の心血管疾患(CVD)、脳卒中(stroke)、死亡の相対危険度はCKDの基礎疾患によって変わってくる。
脳卒中や死亡リスクは、高血圧性腎疾患が高いが、心血管疾患は糖尿病性腎症の群で危険度が高い。
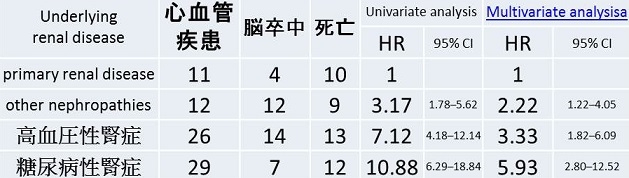
http://www.nature.com/hr/journal/v34/n10/full/hr201196a.html
2004年1月から2005年6月にかけて慢性心不全の増悪により日本循環器学会認定研究施設164病院に入院した患者2675例の背景や治療内容、予後データを解析したJCARE-CARD試験は平均年齢71歳、心不全患者の一年死亡率は7.3%、心不全増悪による再入院率は、半年以内で27%、一年後は35%であり、高い再入院率は欧米の報告と同様であった。これらの症例を対象に、CKDが長期予後に与える影響について解析が行われたが、eGFRが60以上の患者に比較して、30未満や透析が行われている患者の全死亡あるいは心不全増悪による再入院リスクは2.57倍に上昇することが明らかになった。
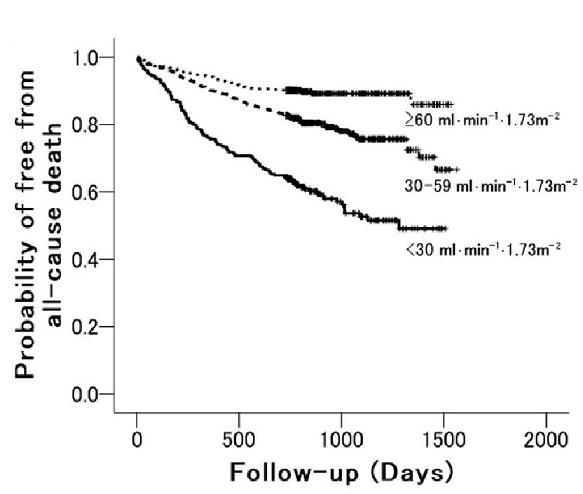
https://www.jstage.jst.go.jp/article/circj/73/8/73_CJ-09-0062/_pdf
http://www.chugaiigaku.jp/upfile/browse/browse492.pdf
以上をまとめると、糖尿病患者のCKDの治療が患者予後を改善させるために重要であることがわかるが、臨床上幾つかの問題点がある。
1 経口糖尿病薬は遷延性低血糖を起こす危険性がある
2 代謝排泄経路が腎臓である薬は禁忌となることが多い
3 インスリン導入しても透析による血液中の濃度の変化や透析による食事時間のずれによる血糖値の変動が生じる→透析日、非透析日でインスリンの単位数の打ち分けが必要である
積極的に血糖値を下げたために却って死亡率が増加した研究が幾つか報告され、低血糖、体重を増加させない薬剤が望まれるようになり、DPP-4阻害薬やSGLT2阻害薬に期待がもたれ、実際よく使われるようになってきた。
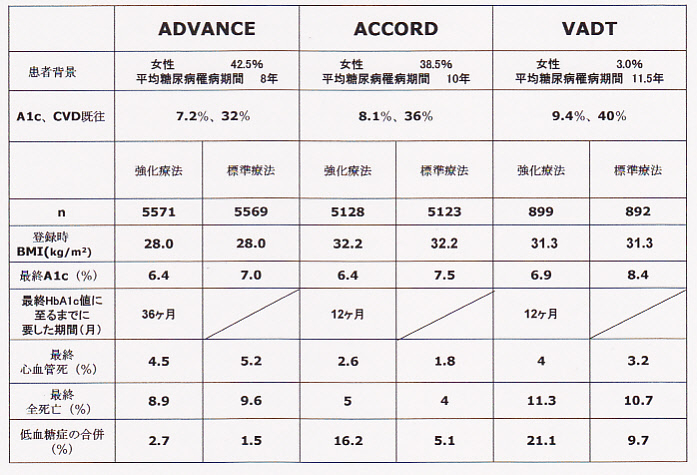
DPP-4阻害薬の比較を表にしてみた。
CKD患者に安心して使える薬としてはリナグリプチンが挙げられる。
SGLT2阻害薬であるトホリフロジンの投与で腎保護効果の可能性が井口らにより報告されている(医薬ジャーナル 50(9), 170-181, 2014)。
SGLT2阻害薬投与により、血糖値の低下ばかりでなく、体重、血圧も低下し、脂質異常も改善している。
Canagliflozinの100㎎を低下した症例でのeGFR値は投与初期においては一時的に低下するが、52週間投与ではPlaceboとの差は消失している。
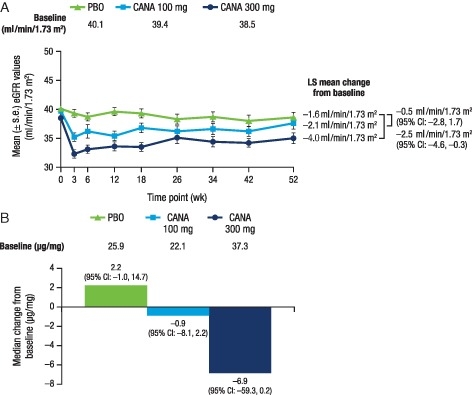
http://onlinelibrary.wiley.com/doi/10.1111/dom.12348/full
1週間後にはDapagliflozin 5㎎、10㎎投与群で血清クレアチニン値がそれぞれ+0.13mg/dL、+0.18mg/dL上昇したが104週目には差が消失した。
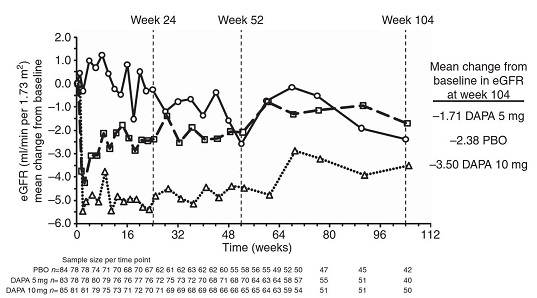
http://www.kidney-international.org/article/S0085-2538(15)56274-1/pdf
SGLT2阻害薬の腎臓保護効果の機序については現在いろいろと研究されている。
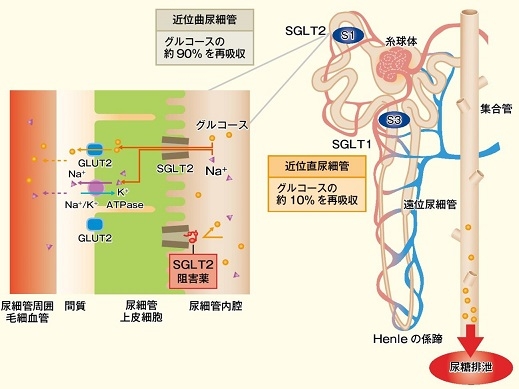
ナトリウム/グルコース共輸送体(sodium/glucose cotransporter:SGLT)は細胞内外のナトリウムイオンの濃度差を駆動力として糖を細胞内へと取り込む能動輸送を行う。
腎層の尿細管曲部(S1セグメント)には低親和性でグルコース輸送能が大きいSGLT2が、尿細管直部(S3セグメント)には高親和性でグルコース輸送能が小さいSGLT1が存在し、腎臓の糸球体でろ過されたグルコースを再吸収している。
腎臓におけるグルコースの糸球体濾過量は一日当たり180gにも達するが、正常人ではそのほとんどが近位尿細管で再吸収される。血糖値の上昇とともに糸球体でろ過されるグルコース量も増加してくるが、近位尿細管におけるグルコースの再吸収量には限界があり、糖再吸収極量といわれ、健常男性では薬375mg/分であり、糸球体でのグルコース濾過量がこの値を超えると尿糖が出現する。
しかし、尿糖が出現する血糖値の排泄閾値は、個々のネフロンにおける再吸収量のばらつきなどの影響により、糖再吸収極量に達する前に尿糖が出現し、およそ180㎎/dL程度と考えられている。
2型糖尿病患者では、正常者と比較すると近位尿細管でSGLT2が高発現し、糖再吸収極量が上昇していることから、SGLT2の機能亢進が高血糖の維持に関与すると考えられている。
このSGLT2発現亢進がナトリウムの再吸収も亢進させている。そのため、マクラデンサへのNaClの輸送が減少し、輸入細動脈が拡張することで糸球体内圧が亢進していると考えられる。
SGLT2阻害薬を投与すると、近位尿細管での糖およびナトリウムの再吸収が抑制=ナトリウムの排泄が促進され、マクラデンサへのNaCl輸送が増加し、輸入細動脈が収縮し、糸球体内圧が低下(糸球体過剰濾過が抑制)することにより、腎保護効果がみられると考えられている。
http://igaku.co.jp/pdf/1507_tonyobyo-03.pdf
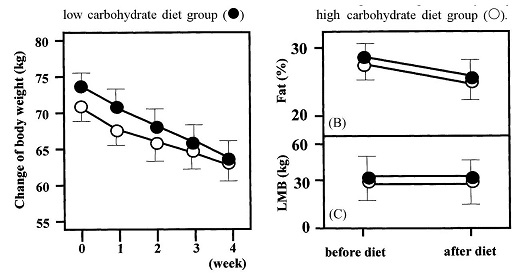
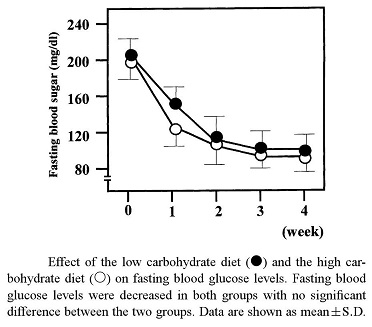
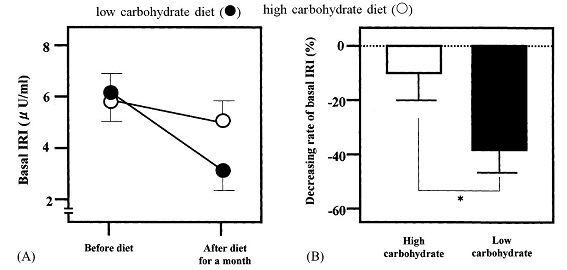
肥満2型糖尿病患者に対して低糖質食(1000Kcal、蛋白:炭水化物:脂質=25:65:10)と高糖質食(1000kcal、蛋白:炭水化物:脂質=25:40:35)の食事療法を行った11人の研究結果では、両群ともに体重や血糖値、総コレステロール値、中性脂肪値は減少した。しかし、低糖質将軍では、空腹時インスリン値は低値を示し、HDLコレステロール値はより上昇し、内臓脂肪の減少が顕著であった。
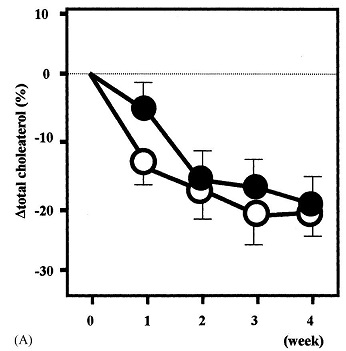
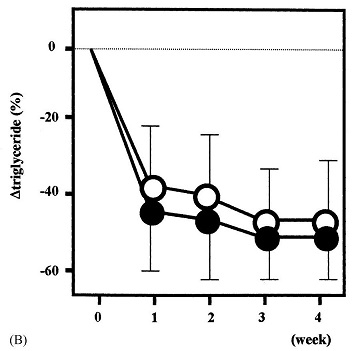
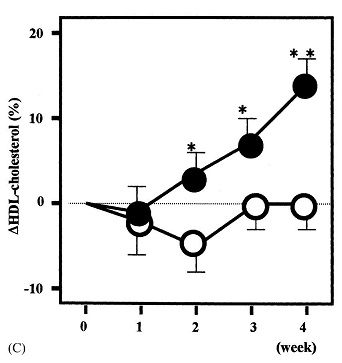
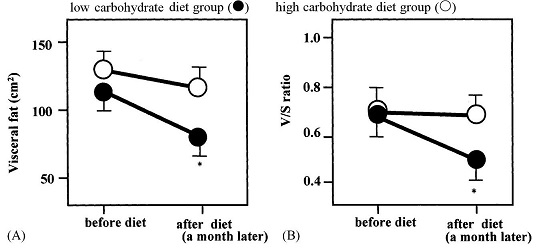
http://www.ncbi.nlm.nih.gov/pubmed/15331203
file:///C:/Users/PCUser/Downloads/miyashita-2004.pdf
しかし、CKDが合併していると、脂質摂取量の増加に伴い、総コレステロール値やLDLコレステロール値の増加や蛋白の摂取量の増加によるGFRの低下、蛋白脂質摂取量の増加による尿の酸性化などが懸念される。
従って、糖質の摂取量を減らしつつ、脂肪や蛋白質の増加を来さない対応が望ましく、そうした変化を実現できそうな薬剤としてSGLT2阻害薬が注目される。
2型糖尿病で心血管リスクの高い7020例にSGLT2阻害薬のEmpagliflozinの10㎎および11㎎投与を行った臨床試験(主要複合転帰:心血管系死亡、非致死性心筋梗塞、非致死性脳卒中)が行われた。
主要転帰は、Empagliflozin投与群では4687例中490例(10.5%)、プラセボ群の2333例中282例(12.1%)で統計上有意差は認めなかったが、心血管系の死亡(3.7%:5.9% 38%の相対リスク減少)や心不全による入院率(2.7%:4.1% 35%の相対リスクの減少)、全死亡率(5.7%:8.3% 32%の相対リスクの減少)で有意差を認めた。
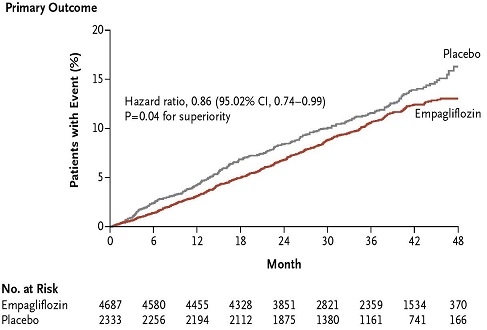
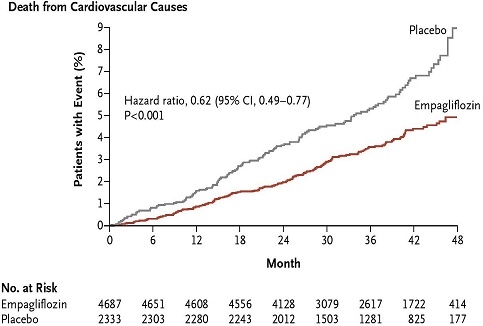
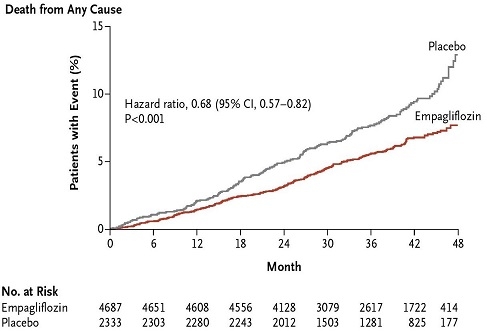
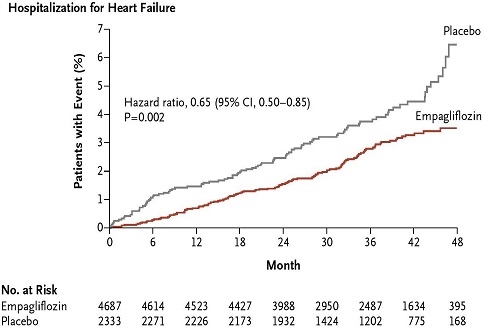
http://www.nejm.org/doi/pdf/10.1056/NEJMoa1504720
一人の患者の有害事象を減少させるために何人を治療する必要があるかを示すNNTは、4Sとして有名なScandinavian Simbastatin Survival StudyでNNTが30、HOPE研究のラミプリルが26であるが、これらの薬が使われている現状で、Empagliflozin投与でのNNTが39という数字であることは、ある意味驚異的な数字と考えることができる。