川村所長の勉強会参加記録
2017.04.06
高血圧性臓器障害におけるミトコンドリア治療の可能性
2017年1月31日
演題「高血圧性臓器障害におけるミトコンドリア治療の可能性」
演者:テンプル大学医学部生理学教授 江口 暁 先生
場所: 崎陽軒本店
内容及び補足「
おわび:江口先生はアメリカで医師として研修・研究してやり方についてもお話しいただけましたが、割愛させていただきました。
尚、講演の最後の所のミトコンドリアの実験結果の図表が探せず、うまく文章も書けなかったので、その部分は掲載できませんでした。
ペンシルバニア州はワシントンとニューヨークの中間に位置するアメリカ独立宣言文が作成された施設のある、日本における京都のような存在意義のある伝統的な町である。

フィラデルフィア美術館から望むダウンタウン風景
テンプル大学医学研究棟の8回に心臓血管研究部門があり、そこの階で研究している。

手前の部分は吹き抜けとなっており、一度足を運んだ人は、こんな環境で勉強したいと思われる。

http://www.ajconline.org/article/S0002-9149(03)00432-6/fulltext
米国の高血圧患者のうち80%が、病気のことを認知しており、48%の人の血圧がコントロールされていると考えられている。しかし、この血圧がコントロールされている人でも心血管リスクは高血圧がない人よりも50%もリスクが上昇していると考えられている。
http://hyper.ahajournals.org/content/66/5/927
ということは、血圧を治療するだけでは不十分で、高血圧に伴う脳卒中、心不全、腎不全などの合併症の発症を抑えることが重要であるということになる。
高血圧の臓器障害の機序にレニンアンギオテンシン系が関与しており、ARBやACEI投与により、臓器保護効果が期待できるし、臨床研究結果でよい報告も出ている。
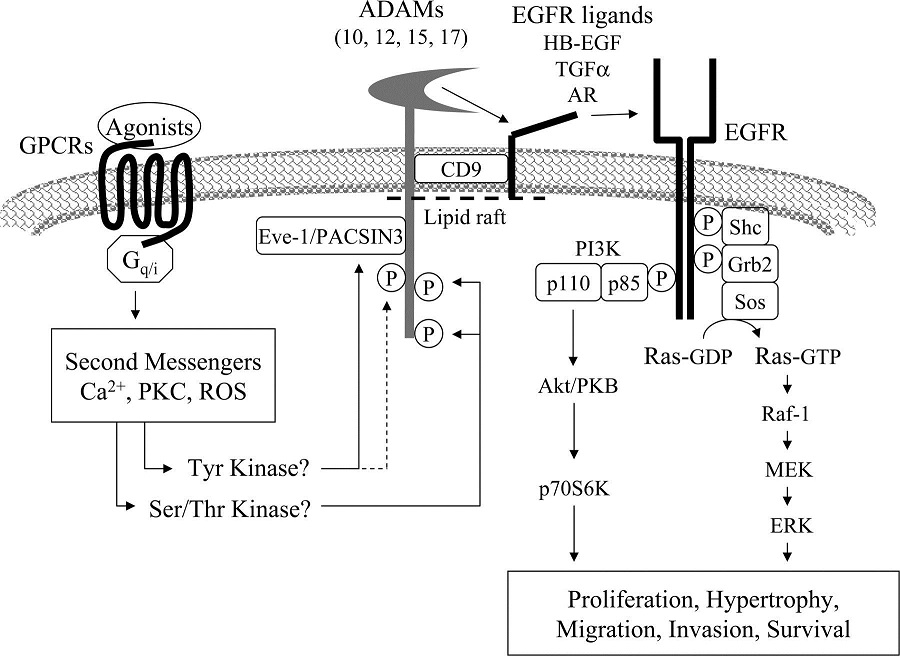
血圧の上昇とは異なる系が臓器障害を招いている可能性があり、その機序を担う一つの重要な因子としてEGF receptorがある。
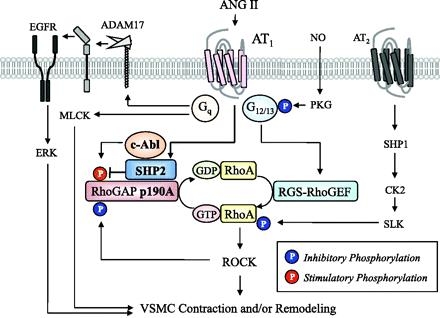
その機序として、AT2がAT1受容体に結合し、フォスフォリパーゼCとイノシトール3リン酸、ジアシルグリセロールを活性化し、またカルシウムの細胞内流入を増加させ、平滑筋の収縮が生じる。
AT1受容体は、またRhoA/Rho-kinase経路を活性化し、MLCPを抑制する。
その他にAT1受容体は、EGF受容体および、間接的に細胞分裂を促進する蛋白キナーゼ系の転写を活性化する。この経路が平滑筋の増殖・肥厚をもたらす重要な経路の一つである。EGFRからの流れをブロックすれば、血圧降下に関係なく、血管壁や心筋の肥厚を抑制できる可能性がある。
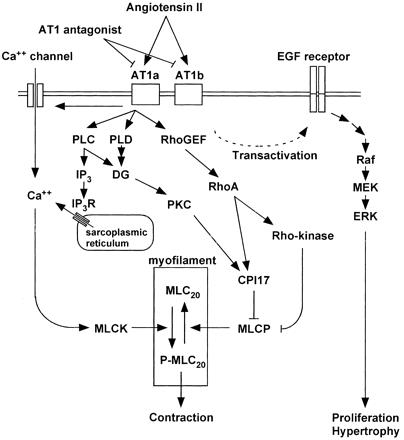
Signal transduction pathways after activation of AT1 with focus on the excitation-contraction coupling in vascular smooth muscle. The stimulation of AT1 activates phospholipase C (PLC) and produces inositol-1,4,5-trisphosphate (IP3) and diacylglycerol (DG). IP3 induces Ca2+ release from the intracellular stores through IP3 receptor (IP3R). AT1 also activates Ca2+ influx through channels on plasma membrane. The elevation of cytosolic Ca2+ concentration activates myosin light chain kinase (MLCK) and thereby phosphorylates myosin, which induces smooth muscle contraction. In addition to the PLC-derived DG, DG is also converted from phosphatidic acid produced by phospholipase D (PLD). DG activates protein kinase C (PKC). One of its substrates is a 17-kDa PKC-potentiated inhibitory protein of type 1 protein phosphatase (CPI17), which directly inhibits the activity of myosin light chain phosphatase (MLCP). AT1 also activates the RhoA/Rho-kinase pathway, which inhibits MLCP activity. CPI17 is also a substrate of Rho-kinase. The inhibition of MLCP causes a greater extent of myosin phosphorylation for a given elevation of Ca2+, resulting in the myofilament Ca2+ sensitization. AT1 transactivates EGF receptor and indirectly activates mitogen-activated protein kinase pathway. This pathway is one of the important pathways leading to smooth muscle proliferation and hypertrophy.
http://circres.ahajournals.org/content/93/11/1015
参:上皮成長因子受容体(Epidermal Growth Factor Receptor:EGFR)
上皮成長因子受容体(Epidermal Growth Factor Receptor:EGFR)は細胞の増殖や成長を制御するEGFを認識し、シグナル伝達を行うチロシンキナーゼ型受容体で細胞膜を貫通して存在する分子量170kDaの糖蛋白質である。
細胞表面の受容体にEGFなどリガンドが結合するとEGFRはリン酸化(赤)され、引き続きMAPK経路(緑)、JAK-STAT経路(黄)などの細胞内経路が活性化して、核内にシグナルを伝達する。その結果、細胞増殖、アポトーシス抑制、血管新生、浸潤、転移などが起こる。
Ras/Raf/MAPK(Mitogen-Activeted protein Kinase)経路は、主に細胞増殖と生存に関与し、PI3K(Phosphoinositide-3 Kinase)/Akt経路は細胞成長や抗アポトーシス、浸潤、郵送に関与する。
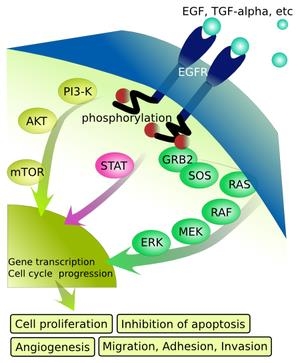
https://ja.wikipedia.org/wiki/%E4%B8%8A%E7%9A%AE%E6%88%90%E9%95%B7%E5%9B%A0%E5%AD%90%E5%8F%97%E5%AE%B9%E4%BD%93
EGFRは、腎癌の50-90%、非小細胞肺癌の40-80%、前立腺癌の40-80%、頭頸部癌の30-100%、卵巣癌の35-70%、胃癌の33-74%、乳癌の14-91%において過剰発現が見られ、この過上発現がこれらの癌の予後不良因子であることがわかっており、EGFRブロッカーが癌治療薬として、研究開発され、臨床においても使用されている。
レニンアンギオテンシン系の昇圧物質であるアンギオテンシン2は高血圧、動脈硬化症、PCI後の再狭窄、心不全においても重要な役割を担っている。
アンギオテンシン2に対する受容体はAT1とAT2の二種類があり、AT1受容体は血管収縮、血管平滑筋増殖、細胞外マトリックス合成促進、心筋肥大、交感神経刺激作用を発揮し、AT2受容体は血管拡張、神経細胞増殖抑制、血管平滑筋細胞のアポトーシス抑制を介すると報告されてきた。
http://byoutaiseiri.kenkyuukai.jp/images/sys%5Cinformation%5C20110304141052-81B83E59607896E5F806508E38B087CC28ECC3C9C242C4AEE4A39F222D1D46D9.pdf
AT1受容体は複数のGタンパクに作用していろいろな反応を引き起こす。それ以外のチロシンキナーゼやセリン/スレオニンキナーゼ、MAPKも活性化させる。Ras、RhoやRacといった小さなGTP結合蛋白を認識する蛋白キナーゼはAT1受容体をとおして活性化される。これらの小さなGTP結合蛋白はアンギオテンシン2によりリモデリングされた心血管系において重要な働きをしている。
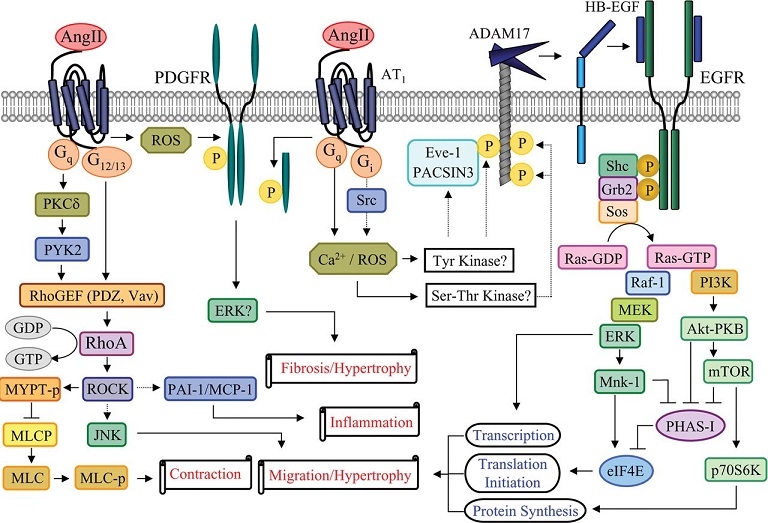
AngII activates EGFR through proHB-EGF shedding by a metalloprotease ADAM17. ADAM activation by AngII requires second messengers, such as Ca2+ and ROS, and may involve ADAM-interacting proteins, such as Eve-1 and PACSIN3, and phosphorylation by putative ADAM kinases. EGFR transactivation leads to hypertrophy and migration of VSMCs through the Ras/Raf/MEK (MAPK/ERK kinase)/ERK pathway and PI3K/Akt/mTOR (mammalian target of rapamycin)/p70S6K/eIF4E (eukaryotic translation initiation factor 4E) pathway. PDGFR transactivation induced by AngII may require ROS, thus leading to hypertrophy and fibrosis. The Rho/ROCK pathway activated by AngII is in parallel with the EGFR transactivation pathway. AngII activates Rho/ROCK through RhoGEF (PDZ, Vav), leading to vascular contraction, migration, hypertrophy, and inflammation. MLC, myosin-light chain; MLC-p, phosphorylated MLC; MLCP, MLC phosphatase; Mnk-1, MAPK signal-integrating kinase; PHAS-1, phosphorylated, heat and acid stable regulated by insulin protein-1.
http://www.clinsci.org/content/112/8/417
心筋肥大や線維化といった心血管系のリモデリグンの機序は、いまだ不明な点があるが、アンギオテンシンのこの作用は、血管ADAM17を活性化してその結果EGFRを活性化していることが想定される。
https://www.ncbi.nlm.nih.gov/pubmed/27480833
シェディング:細胞膜貫通型の蛋白質を細胞外の膜近傍で選択的に切断し、細胞外領域を可溶化するという翻訳後修飾機構であり、切断される蛋白質のみならずそれを発現している細胞の機能を比較的迅速にかつ不可逆的に制御できる極めて有効な分子機構。
http://www.careerpath-prj.keio.ac.jp/kanrinmaru/scholar/shirakabe/
参:ヘパリン結合型EGF様増殖因子:HB-EGF
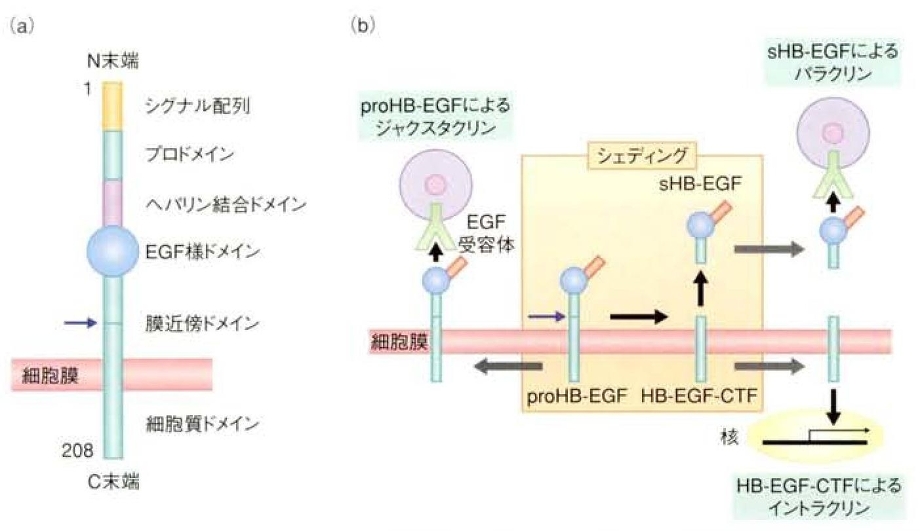
HB-EGFは心臓や皮膚、肺の発生に関与し、個体発生や恒常性の維持に関与しているだけでなく、ガンや、心臓病、動脈硬化や高稀有圧などの様々な疾患に関与しており、EGFファミリーの中でも生理的、病理的に重要な役割を果たしている。
HB-EGFは1型膜蛋白質(N末端が細胞外)として合成され(下図a)、炎症サイトカイン、活性酸素、浸透圧ショックなどの様々な細胞外刺激によりシュディングを受け、分泌型(sHB-EGF)となって細胞外に分泌され、EGF受容体(ErbB1あるいはErbB4)と結合し、細胞内にシグナルを伝達するようになる。
sHB-EGFは、血管平滑筋細胞や線維芽細胞、表皮細胞などの細胞増殖や運動亢進をさせる。
また、HB-EGFは分泌型としてではなく、膜結合型(proHB-EGF)として細胞間のシグナル伝達蛋白質としても機能している。このジャクスタリンと呼ばれる細胞接着を介した細胞間シグナル伝達は上記分泌型シグナル伝達物質が離れた細胞に働くパラクリンとは異なり、接着している細胞だけにシグナル伝達をする。
その他にシュディング受けた後のC末端側断片(HB-EGF-CTF)が核内並行へ移行し、イントラクリン様式で種々の遺伝子発現を制御することも報告された。
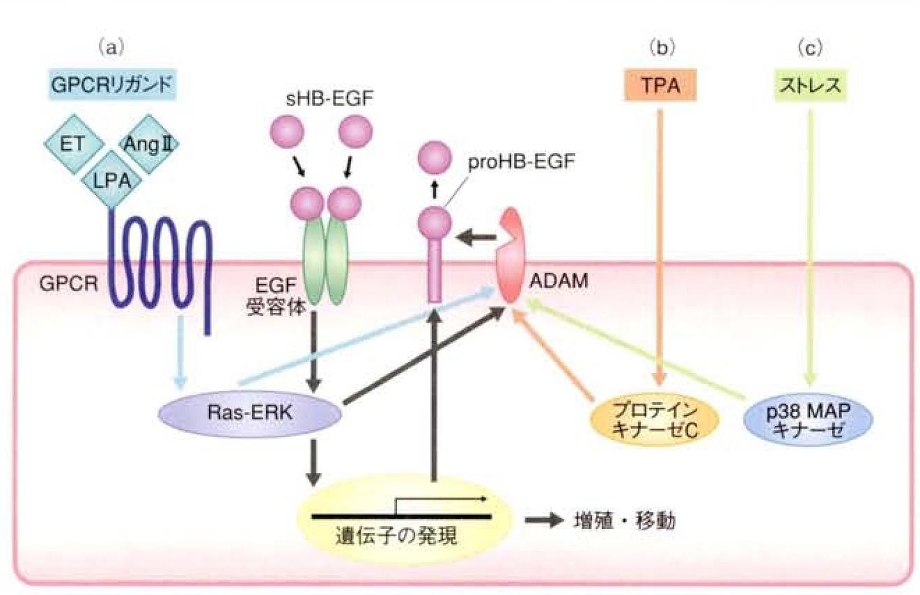
HB-EGFのシュディングはTPA(12-O-テトラデカノイルホルボール13アセタート)などのホルボールエステルやCa2+イオノフォア、種々のG蛋白質共役型受容体リガンド、炎症サイトカイン、活性酸素、浸透圧ショックなどの細胞性ストレスなどの様々な外的要因により誘導される。TPAの場合はプロテインキナーゼC経路、G蛋白質共役型受容体リガンドの場合はRas-ERK経路、細胞性ストレスの場合はp38MAPキナーゼ経路という具合に、刺激の種類によって異なる細胞なシグナル伝達経路が関与していることが培養細胞の研究から判明した。
リゾホスファチジン酸やアンジオテンシン2、エンドセリンなどG蛋白質共役型受容体リガンドによるG蛋白質共役型受容体の活性化がRas-ERK経路を活性化し、HB-EGFのシュディングを誘導し、分泌されたsHB-EGFがEGF受容体を活性化し、さらにその下流で、Ras-ERK経路が活性化される。つまり、HB-EGFのシュディングのみならずHB-EGF自体の発現も誘導し、細胞増殖シグナル、移動促進シグナルの正のフィードバックが形成される。
この正のフィードバックループの形成が、心肥大や動脈硬化、高血圧、発癌などの病理にも深くかかわっている。
このHB-EGFのシュディングに関与する切断酵素としては、おもにADAM(a disintegrin and metalloprotease)ファミリーあるいは、マトリックスメタロプロテアーゼ(matrix metalloproteinase:MMP)ファミリーに属するメタロプロテアーゼ(matrix metroprotenase)ファミリーに属するメタロプロテアーゼが示唆されている。
なかでもADAM17(TACE:TNF α converting enzyme)がその候補として有力視されている。
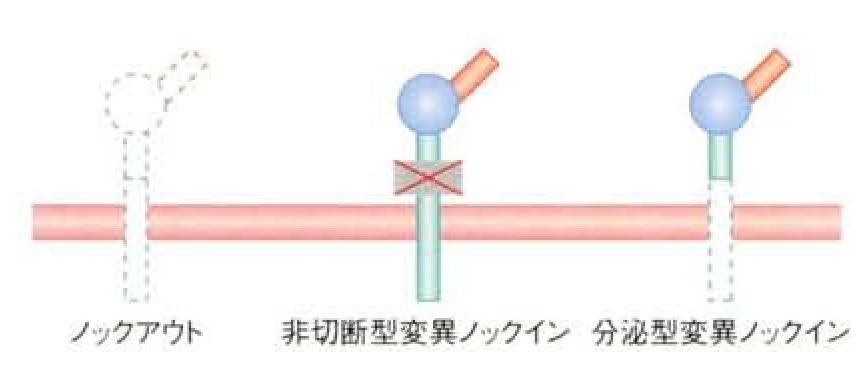
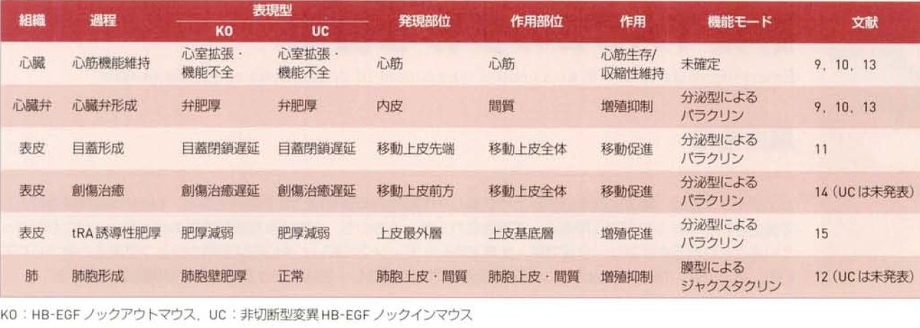
膜貫通領域を持たない分泌型変異HB-EGFを発現するノックインマウスを作成し、解析を行った。この分泌型変異HB-EGF発現ノックインマウスでは、HB-EGFはシュディングの過程を経ずに合成されると直ぐに分泌されることになる。一方の対立遺伝子のみ分泌型変異HB-EGF遺伝子に置き換わったキメラマウスあるいはそのF1ヘテロマウスは、胎生期あるいは生後すぐに死亡することが観察された。その発現系の特徴として、皮膚あるいは心室の著しい肥大など組織の過形成異常が認められた。
HB-EGFの切断部位のアミノ酸残基を置換することで切断されないようにした非切断型変異HB-EGFを発現するノックインマウスを作成し、その表現型の解析を行ったところ、多くの異常がHB-EGFノックアウトマウスと一致し、マウスの生体でのHB-EGFの機能発現にはシェディング過程が不可欠であることが分かった。これらの結果から、HB-EGFのシェディングは、正にも負にも厳密に制御されている必要があることが、生体レベルで明らかになった。
また、G蛋白質共役型受容体リガンドによるEGF受容体トランス活性化機構を介したHB-EGFのシェディング亢進が、心臓肥大、動脈硬化、高血圧、肺疾患、発癌などの種々の疾患病理とかかわっていることもHB-EGFのシェディング制御が生体の恒常性維持に非常に重要であることを裏付けるものでもあった。
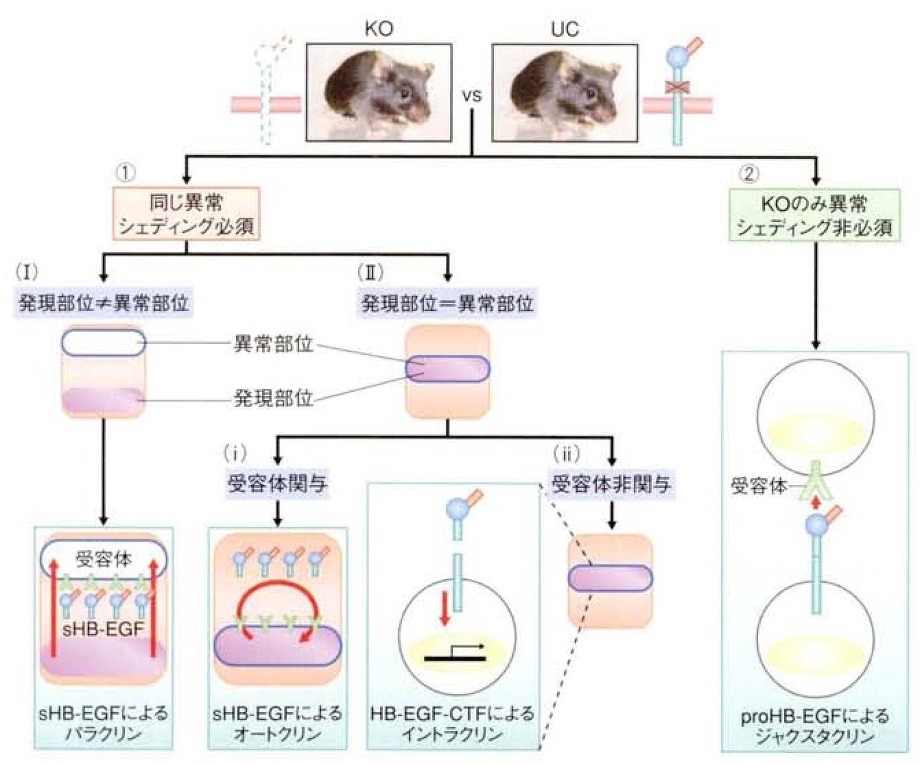
シェディングが起こるか起こらないかによって、HB-EGFには三種類の分子形態が存在することになる。
起こらない場合には、膜型proHB-EGFが、起こる場合には、分泌型sHB-EGFと残りのC末端側断片HB-EGF-CTFとが同時に生成する。
以下のような解析基準によって、マウス生体でのHB-EGFの機能様式が予想できる。
1. HB-EGFノックアウトマウスと非切断型変異HB-EGFノックインマウスとで同様な異常を呈する場合。
(ア) HB-EGFの発現部位と異常部位が離れている場合=sHB-EGFがパラクリンにより機能する
(イ) 発現部位と異常部位とが同じ場合=sHB-EGFがオートクリンにより、あるいはHB-EGF-CTFがイントラクリンにより機能。
① EGF受容体などの受容体が関与している場合=sHB-EGFがオートクリンにより機能
② 受容体が関与していない場合=HB-EGF-CTFがイントラクリンにより機能。
2. ノックアウトマウスでは異常だが変異ノックインマウスでは正常である場合=proHB-EGFがジャクスタクリンにより機能。
今まで得られた結果を簡単に以下に記載する。
1. 心機能の維持:HB-EGFノックアウトマウスは生後その多くが死亡し、これらの心臓では心室の拡張や機能不全が生じている。HB-EGFの発現が心臓で確認され、HB-EGFは心筋細胞の生存あるいは収縮性の維持に寄与していると考えられる。また、非切断型変異HB-EGFノックインマウスも同様の心臓不全を呈することから、この過程ではシェディングが必須であることがわかる。ただし、この過程においてsHB-EGFとEB-EGF-CTFのいずれが機能しているかはまだ未解明。
2. 心臓弁の形成:HB-EGFノックアウトマウスおよび非切断型変異HB-EGFノックインマウスはともに、心臓弁の形成過程において便間質細胞の過増殖を伴った心肥大を呈する。HB-EGFは弁内皮細胞に限局して発現し。シェディングによって生成したsHB-EGFがパラクリンにより弁間質内の間質細胞に働き、その増殖を負に制御している。ADAM17ノックアウトマウスも同様の弁肥厚を呈することがわかっており、ADAM17がHB-EGFのシェディングに寄与していることが予想されていた。
3. 目蓋(まぶた)の形成:HB-EGFノックアウトマウスおよび非切断型変異HB-EGFノックインマウスはともに、目蓋の形成過程において目蓋の閉鎖が遅延した。HB-EGFは目蓋閉鎖に伴って移動する上皮細胞シートの先端部に限局して発現し、シェディングによって生成したsHB-EGFが後方の上皮細胞シートにパラクリンにより働きその移動を促進している。
4. 表皮創傷の治癒:目蓋の形成過程と同様の機構で、移動上皮の前方で生成したsHB-EGFが上皮シート全体の移動をパラクリンにより促進している。
5. 表皮の肥厚:レチノイン酸の塗布によって誘導される上皮の肥厚が、HB-EGFノックアウトマウスおよび非切断型変異HB-EGFノックインマウスでは著しく減弱する。この時、HB-EGFは上皮最外層に限局して発現が誘導され、一方、増殖の亢進が上皮基底層細胞で起こることから、最外層の上皮細胞でシェディングによって生成したsHB-EGFが基底層の上皮細胞にパラクリンにより働き、その増殖性を亢進させている。
6. 肺胞の形成:HB-EGFノックアウトマウスでは周産期末梢肺の肺胞細胞の過増殖を伴って肺胞壁が著しく肥厚するが、非切断型変異HB-EGFノックインマウスの肺は正常に発生することから、この過程ではproHB-EGFがジャクスタクリンにより肺胞細胞に働き、その増殖を負に制御していることが予想される。

http://lifesciencedb.jp/dbsearch/Literature/get_pne_cgpdf.php?year=2009&number=5413&file=CPLUSgOThVWZN9b1STkxKXgXg
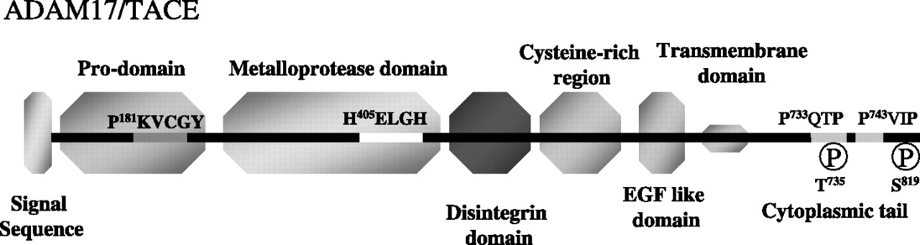
A Disintegrin And Metalloprotease Domain 17(ADAM17、TACE):1997年に腫瘍壊死因子のTNFαを切断する酵素としてクローニングされた。824アミノ酸からなる1型膜たんぱく質で、N末端側のプロドメインがFurinによって切断されることにより活性化する。触媒ドメインには亜鉛イオン結合配列が存在する。様々な臓器に偏在するが、成人では心臓や骨格筋で多く発現している。
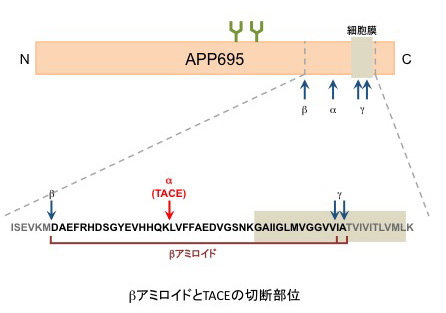
様々な膜たんぱく質を膜近傍で切断し、膜から切り離す。TGFα、Notch、TNFα、APPなど基質の種類が多いため、炎症やアルツハイマー病、心臓疾患、糖尿病、腎疾患など様々な疾患と関連する。
アルツハイマー病の原因とされているβアミロイドは、β-、γ-セクレターゼによって切断されたAPPの断片である。TACEはαセクレターゼとしてAPPに作用することによりβアミロイドの中央付近を切断するため、その産生を阻害する。このため、TACEを標的としたアルツハイマー病の治療薬の開発も行わせている。
http://www.tmig.or.jp/J_TMIG/genome300/ADAM17.html

http://ajpcell.physiology.org/content/291/1/c1
http://ajpcell.physiology.org/content/297/5/C1059
Ang2投与により血管中膜の肥厚、心臓、腎臓、血管の肥大や心臓や腎臓の血管周囲の線維化が生じる。EGFR阻害薬であるErlotinibを投与することにより高血圧には影響せず、血管のリモデリングや心肥大を減弱した。
Ang2によりEGFRの発現やADAM17の発現は亢進したが、Erlotinibの投与によりこれらの発現は抑えられた。
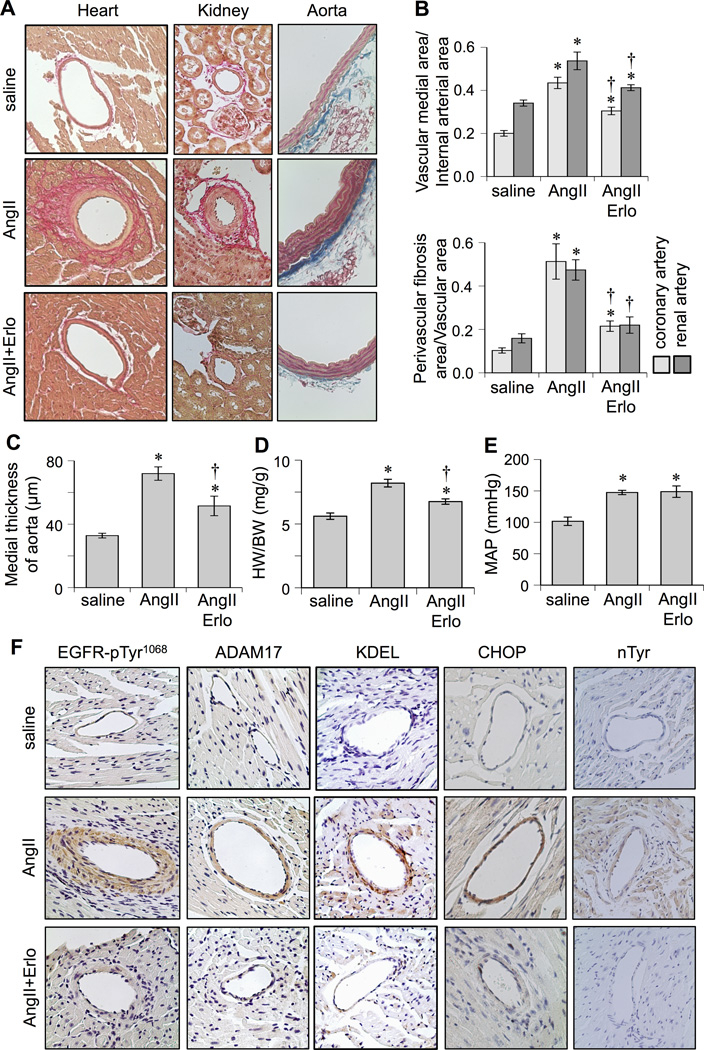
Effects of EGFR inhibitor, erlotinib, on cardiovascular remodeling induced by AngII. C57Bl/6 mice were infused with saline (n=8) for 2 weeks, or AngII (1 µg/kg/min) for 2 weeks with (n=8) or without (n=8) treatment of erlotinib (10 mg/kg/day intraperitoneal injection). Hearts and kidneys were stained with Sirius red and aortas were stained with Masson trichrome (Mean±SEM). A: Representative staining (200x) is presented. B: Quantification of medial area to internal arterial area of the coronary and renal arteries, and quantification of perivascular fibrosis area to vascular area of these arteries. C: Quantification of medial thickness of the thoracic aorta. D: Heart weight (HW) body weight (BW) ratio. E: Mean arterial pressure (MAP) was evaluated by telemetry. F: Heart sections were immuno-stained with antibodies as indicated (n=4). Antibodies against KDEL and CHOP were used to assess ER stress. Antibody against nitro-tyrosine (nTyr) was used to assess oxidative stress. *p<0.05 compared with control saline infusion. †p<0.05 compared with AngII infusion.
http://pubmedcentralcanada.ca/pmcc/articles/PMC4433406/
これらの実験結果は、はたして人に対して応用できるのであろうか?
https://www.ncbi.nlm.nih.gov/pubmed/26541681
実際にヒトの大動脈の標本を手に入れることは臨床上困難であるが、大動脈解離の手術標本で検討した研究がある。
Ang2とβaminopropionitrile(BAON)を投与して作成した腹部大動脈瘤を有するC57BL/6マウスにErlotinibを投与した群としなかった群での検討がある。Erlotinibを投与しない場合は64.3%大動脈破裂で死亡した。生存したマウスでは、腹部大動脈瘤にEGFRの過剰発現を認めたのに対し、Erlotinibを投与した群ではEGFRの発現亢進やEntoplasmic Reticulumストレス、酸化ストレス、インターロイキン-6の発現やMatrix Depositionは見られなかった。つまり、平滑筋も非投与群では切断されているが、投与群ではきれいな像が観察されている。
https://www.ncbi.nlm.nih.gov/pubmed/25531554
人においても同じことが言えそうである。
血圧を下げなくても、ARBのようなRAS系を抑えることにより、高血圧の合併症の一部を抑えることができる可能性がわかった。
ARBなどの使用により、RAS系を抑える方法以外にも、老化を遅らせる方法として、カロリー制限が有名であるが、この機序は、ミトコンドリアの機能を刺激することによっておこっていると考えられている。
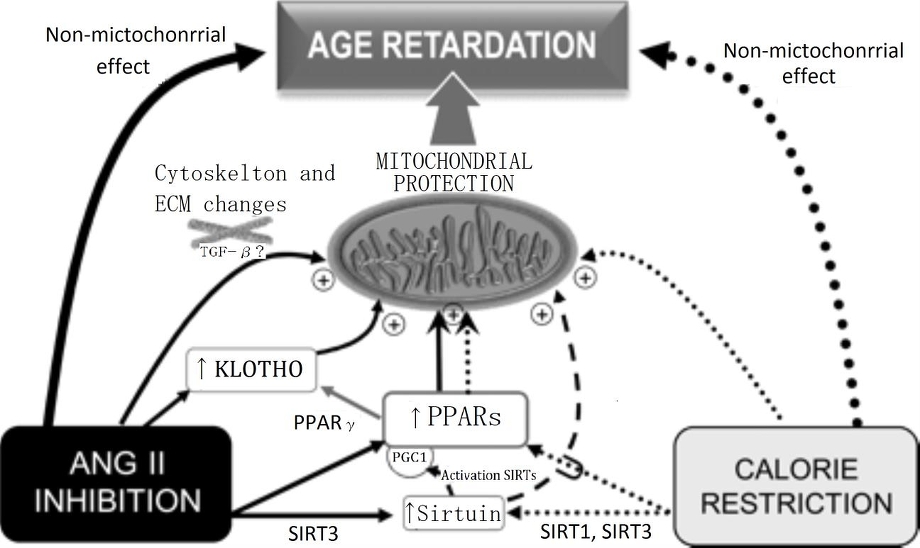
The scheme shows several mechanisms that may contribute to the age-retarding effects associated with RAS blockade, i.e. up-regulation of PPARs, up-regulation of sirtuins and klotho gene expression, and cytoskeletal and ECM changes, all of which can have a stimulatory effect on mitochondrial function. Apart from other effects that are specific for each intervention, both CR and RAS blockade were shown to up-regulate PPARs and sirtuins. Overexpression of SIRT1 modulates mitochondrial biogenesis by deacetylating PGC-1α, and SIRT3 plays a role in mitochondrial functioning by deacetylating acetyl-CoA synthethase 2. RAS blockade up-regulates anti-ageing Klotho, and we hypothesize that by up-regulating PPARs CR may also up-regulate Klotho. Our hypothesis on a central participation of PPARs in the retardation of ageing mediated by RAS blockade is based on evidence showing that (i) mitochondrial function and oxidant production are active participants in the ageing process; (ii) RAS blockade delays the deleterious effects of ageing, improves mitochondrial function, and also up-regulates PPARs; (iii) PPARs, by regulating mitochondrial function and UCPs, seem to play a major role in the age-retarding effects of CR; and (iv) experimental CR and experimental and clinical RAS blockade display overlapping physiological and molecular events (Table 1), most of which involve changes in mitochondrial function. Future work will allow to either confirm or refute this hypothesis.
Cardiovasc Res. 2011;89(1):31-40
参:ミトコンドリアMitocondria
真核生物の細胞小器官で二重生体膜からなり、独自のDNA(mtDNA)を持ち、分裂、増殖する。ATPの合成以外にも細胞のアポトーシスにおいても重要な役割を担っている。肝臓、腎臓、筋肉、脳などの代謝の活発な細胞においては、数百~数千個のミトコンドリアが細胞の中に存在し、細胞質の約40%を占めている。平均では細胞中に300~400個のミトコンドリアが存在し、体重の10%を占めている。ヤヌスグリーンで青緑色に染色される。
直径は、0.5μm程度であるが、細胞の状態により、球形、円筒形、紐状、網目状などいろいろな形状を取り、長さが10μmに達するものもある。
外膜と内膜に囲まれており、内膜の内側をマトリックス、内膜と外膜に挟まれた空間を膜間腔と呼んでおり、マトリックス側に陥入しているクリステ(稜)と呼ばれる特徴的な構造を持っている。
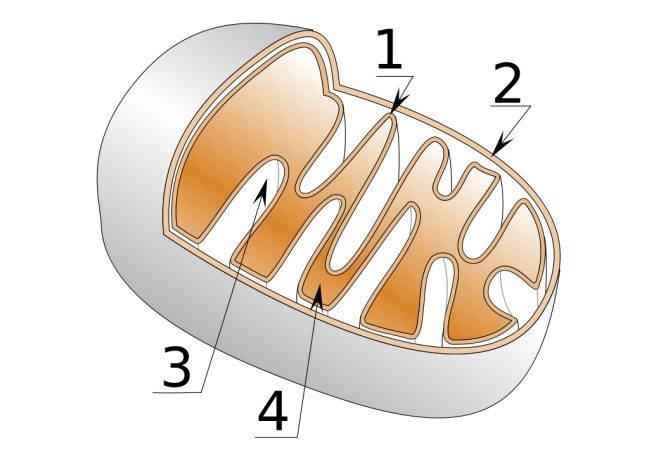
1.内膜 2.外膜 3.クリステ(平板状) 4.マトリックス
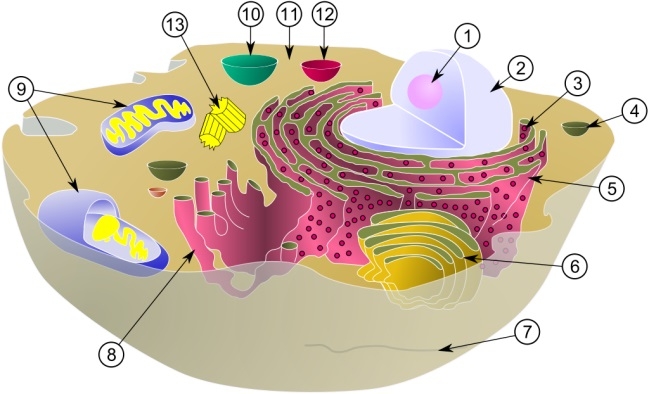
ミトコンドリア 典型的な動物細胞の模式図: (1) 核小体(仁)、(2) 細胞核、(3) リボソーム、(4) 小胞、(5) 粗面小胞体、(6) ゴルジ体、(7) 微小管、(8) 滑面小胞体、(9) ミトコンドリア、(10) 液胞、(11) 細胞質基質、(12) リソソーム、(13) 中心体
機能:ミトコンドリアの主要な機能は電子伝達系による酸化的リン酸化によるATP産生である。ほとんどの細胞の活動エネルギーは、ミトコンドリアからのATP供給で賄われている。それ以外にも細胞ごとに様々な機能を担っていて、ステロイドやヘムの合成などの代謝、カルシウムや鉄の細胞内濃度の調節、細胞周期やアポトーシスの調整にかかわっているものもある。これらの機能には多数の遺伝子がかかわっており、それらの変異が自然免疫で排除されない場合には、ミトコンドリア病を引き起こすことになる。
ミトコンドリアの構造と電子伝達系及びクエン酸回路の模式図
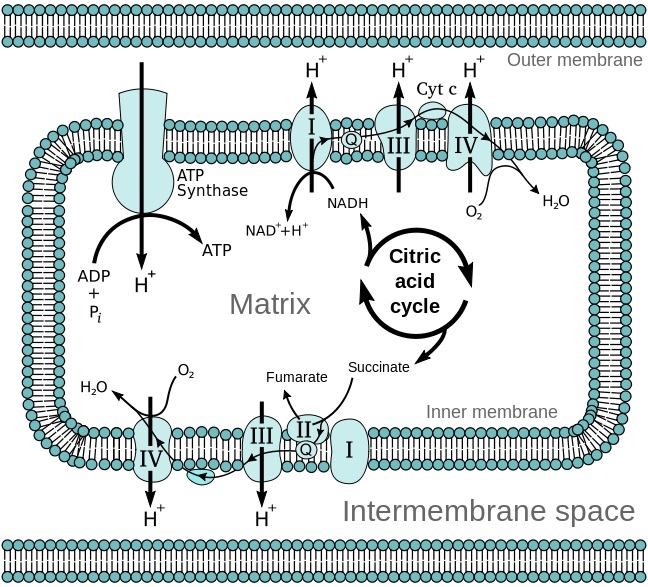
エネルギー変換:ATP産生がミトコンドリアの主たる機能である。
細胞質には解糖系があり、グルコースを代謝することでピルビン酸とNADHが作られる。酸素が不十分な場合には解糖系の産物は嫌気呼吸により代謝される。酸素が十分にある場合好気呼吸で処理され、嫌気呼吸で1分子のグルコースから2分子のATPしか得られないが、好気性分解では38分子のATPが合成される。ピルビン酸だけでなく、脂肪酸も利用でき、植物のミトコンドリアは酸素がなくとも亜硝酸を使用してある程度のATP産生が可能である。
細胞質基質で解糖系反応が起こり、合成されたピルビン酸はピルビン酸共輸送体(ピルビン酸/H+)でNADHはリンゴ酸-アスパラギン酸シャトルにより、TCA回路や電子伝達系反応が起こるミトコンドリアへ輸送され、ADPはATP/ADPトランスポーターにより細胞質からミトコンドリアへ輸送される。H2O、O2、CO2、NH3に限ってミトコンドリア内膜を通過することができる。
クエン酸回路:
解糖系で生じたピルビン酸は内膜を能動輸送により透過し、マトリックスで酸化され、補酵素Aと結合し、二酸化炭素、アセチルCoA、NADHを生じる。アセチルCoAはクエン酸回路へ入る基質である。
クエン酸回路の酵素群は、内膜の呼吸鎖複合体2になっているコハク酸デヒドロゲナーゼ(ユビキノン)以外はマトリックスに存在している。
クエン酸回路はアセチルCoAを酸化して二酸化炭素を生じ、その過程で3分子のNADHと1分子のFADH2、1分子のGTPを生成し、二酸化炭素をミトコンドリア外に排出する。
クエン酸サイクルでは、サイクルの位置回転ごとにクエン酸、イソクエン酸、α-ケトグルタル酸、コハク酸、フマル酸、リンゴ酸、オキサロ酢酸などの中間体が再生される。これらの中間体の量が増えると、その後他の中間体に変換され順次増加していき、補充反応(アナプレロティック反応)効果を示し、中間体のいずれかの除去は消費反応(カタプレロティック反応)効果を示すので、これらの補充反応や消費反応は、クエン酸を形成するために利用可能なオキサロ酢酸の量を増減させることになり、ミトコンドリアによるATP造成量と細胞へのATP供給量の増減が生じる。
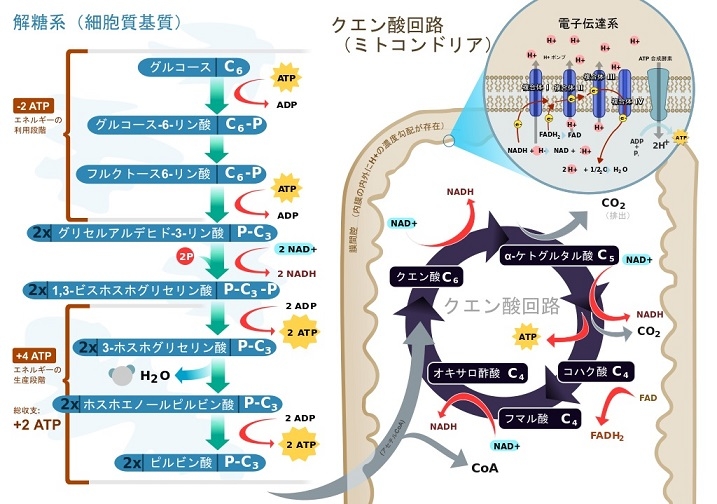
細胞質での解糖系とミトコンドリアでのピルビン酸の脱炭酸とクエン酸回路。
電子伝達系:
TCA回路からでなく、細胞質の解糖系で生じた還元等量はマロン酸-アスパラギン酸対向輸送系やリン酸グリセロールシャトル系を通じて電子伝達系に供給される。内膜の電子伝達系には、NADH脱水素酵素、チトクロームC還元酵素、チトクロームC酸化酵素が存在しており、プロトン(H+)を膜間腔へくみ出す。この過程が非常に効率的であるが、不十分にしか反応できないときには活性酸素が生じてしまい、酸化ストレスとなり、ミトコンドリア機能の低下や老化が起こると考えられている。
グルコーストランスポーターであるGLUT1を介してデヒドロアスコルビン酸がミトコンドリアに輸送され、その後ビタミンCに還元され、活性酸素によるフリーラジカルの大部分が産生される場所であるミトコンドリアに蓄積され、活性酸素から、ミトコンドリアのゲノムと膜を保護する。
プロトンが膜間腔へくみ出されることにより、内膜の内外でプロトン濃度差(電気化学的勾配)が生じる。くみ出されたプロトンはATP合成酵素を通じてマトリックスへ戻ることができ、この時にADPと無機リン酸(Pi)からATPが作られる。生成されたATPはATP/ADPトランスポーターによりミトコンドリアから細胞質へ輸送され、細胞の活動エネルギー源となる(化学浸透説)。
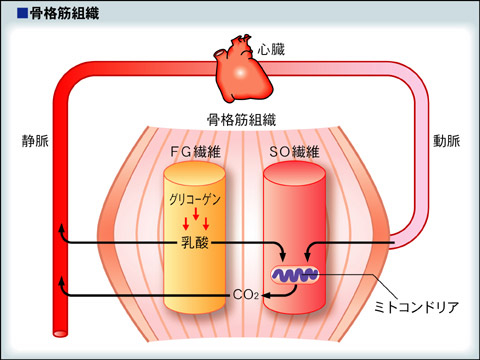
筋肉とミトコンドリア
速筋線維はミトコンドリアが少なく、グリコーゲンが比較的多いので白く見え、糖分解により乳酸ができやすい。乳酸性閾値から、運動強度が高い場合は、速筋線維が多く使われる。遅筋線維や心筋はミトコンドリアが多いので赤く見え、乳酸を作るよりは、乳酸を外から取り込んでエネルギー源として使っている。運動強度が低い場合は、遅筋線維が主として働いている。つまり速筋線維のグリコーゲンが消費された際に産生された乳酸が、遅筋線維や心筋のミトコンドリアで使われている。乳酸の代謝では、細胞膜を通過して他の細胞に乳酸が輸送される過程が重要である。この乳酸の輸送はピルビン酸の輸送にもかかわっており、モノカルボン酸輸送担体(Monocarboxylate Transporter:MCT)と呼ばれている。
乳酸シャトル説(Lactate shuttle)とモノカルボン酸輸送担体(MCT):
従来乳酸は運動中の細胞内好気的代謝系の容量限界を超えた運動強度による相対的な酸素不足によって生じる一種の老廃物という考えが一般的であった。最近のトレーサー実験の結果から、比較的低強度の運動中や食事による栄養補給などによる各組織へのエネルギー基質分配の媒体として乳酸が重要であることが明らかとなった。各組織の細胞膜表面に促通核酸(Facilitated diffusion)による乳酸の輸送担体が同定され、四種類あることが報告されている。その内運動時に重要なのが、MCT1とMCT4である。
MCT1は主に心臓、骨格筋の遅筋(SO)線維に多く分布し、細胞外から内への乳酸輸送を促進する。一方、MCT4は骨格筋の速筋(FOG)線維に多く分布し、細胞内から外への乳酸輸送を促進する。骨格筋の遅筋線維のミトコンドリア膜においてもMCT1が同定され、Brooksは下図に示すような乳酸シャトル説を提案した。すなわち、主として速筋線維で産生された乳酸は血液に拡散し、心臓や骨格筋の遅筋線維内に輸送され、ミトコンドリア内でエネルギー基質として利用される。一方、肝臓では、MCT2を介して、血中乳酸が細胞内に取り込まれ、グリコーゲンの合成に使用されるという説である。
http://sugp.wakasato.jp/Material/Medicine/cai/text/subject09/no4/html/section1.html
熱産生:
ある条件下では、膜間腔のプロトンはATP合成に関与することなく、促進拡散によってマトリックスに戻ることがある。これは「プロトンのリーク」、「ミトコンドリアの脱共役」と呼ばれ、蓄積されていた電気化学的ポテンシャルを熱として開放される現象である。Thermogeninをはじめとする一群のプロトンチャンネルが媒介しており、非震え熱産生にかかわっている。Thermogeninは若齢や冬眠中の哺乳類に見られる褐色脂肪組織のミトコンドリアに存在している。
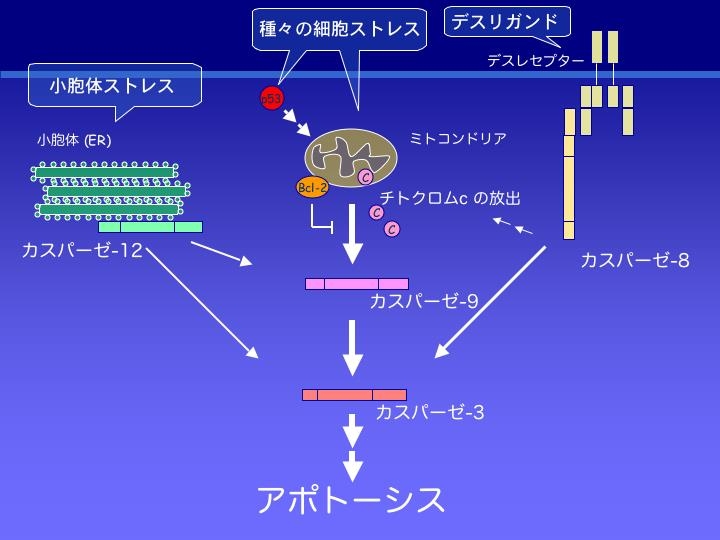
アポトーシス:
DNA損傷などのストレスは、アポトーシス誘導分子p53やアポとーシスを調節するBcl-2ファミリー蛋白質を介して、ミトコンドリアの膜電位を変化させ、その結果、ミトコンドリアからチトクロームCが漏出し、アポトーシスへと誘導される。チトクロームCは、細胞質に存在するApaf-1やカスパーゼ(Caspase)-9と結合して、アポトソーム(apoptosome)と呼ばれる集合体を形成し、これによって活性化されたカスパーゼ-9が、下流のエフェクターを活性化してアポトーシスが起こる。
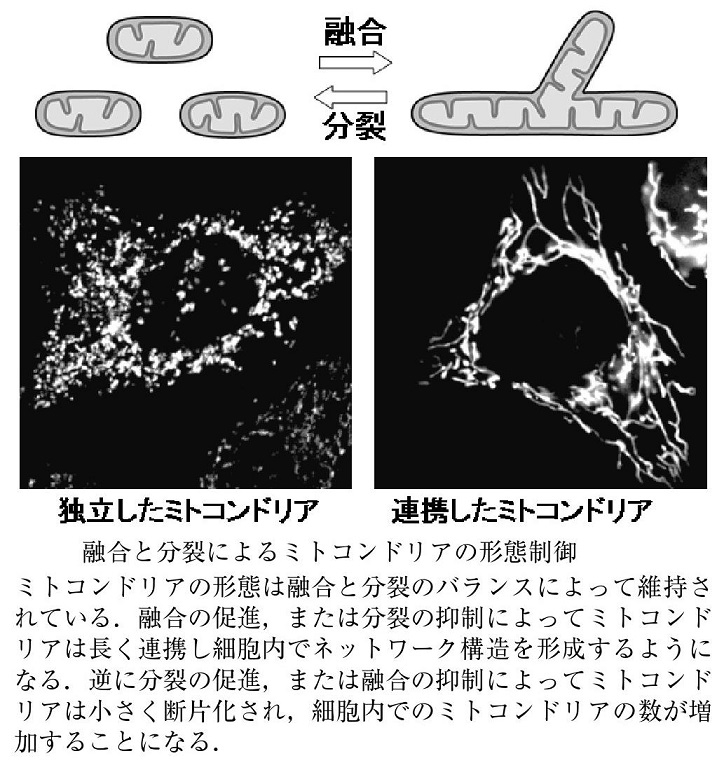
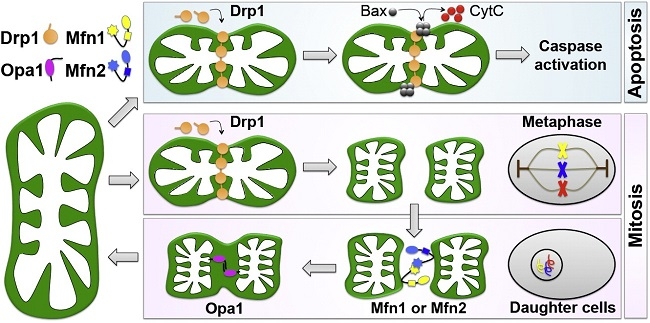
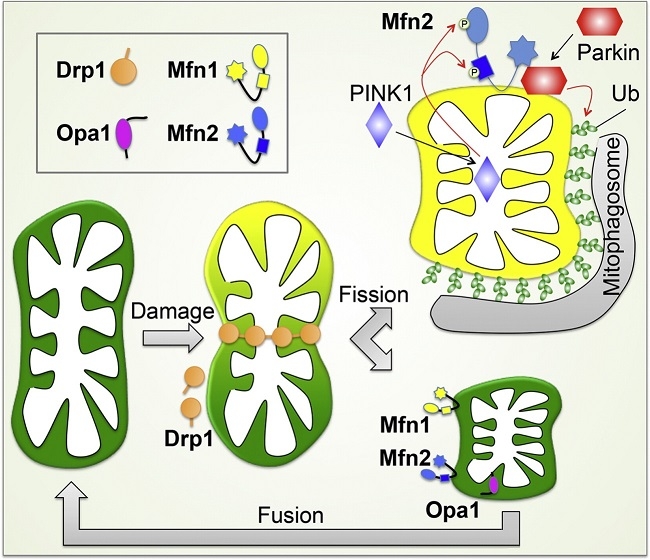
ミトコンドリアの融合と分裂:
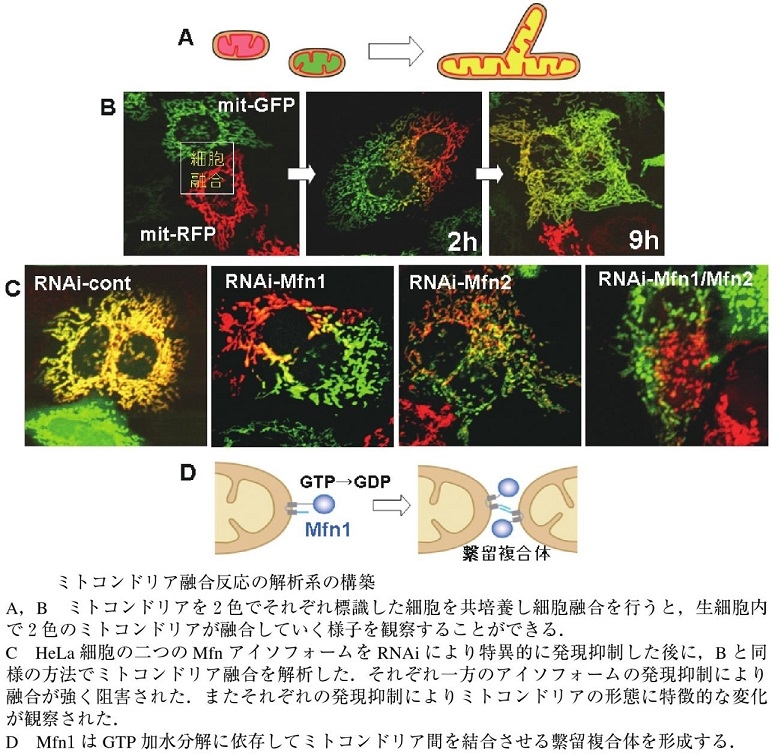
ミトコンドリア特異的蛍光色素やミトコンドリア局在化蛍光蛋白質を用いてミトコンドリアの培養細胞内での生細胞観察を行うと、細胞内でのミトコンドリアの動的構造変化を観察できる。つまり、別々のミトコンドリアがつながり融合して一つのミトコンドリアになったり、分裂していく様子を観察することができる。
ミトコンドリアの融合が活性化すると、ミトコンドリアの長いネットワークが形成されるが、逆に分裂が活性化すると、小さなミトコンドリアの数が増加する。この融合と分裂両方を停止させた酵母では、ミトコンドリアの形態が野生型とほぼ同様の正常な形態に回復することから、ミトコンドリアの形態は、融合と分裂のバランスによって維持されていると考えられている。
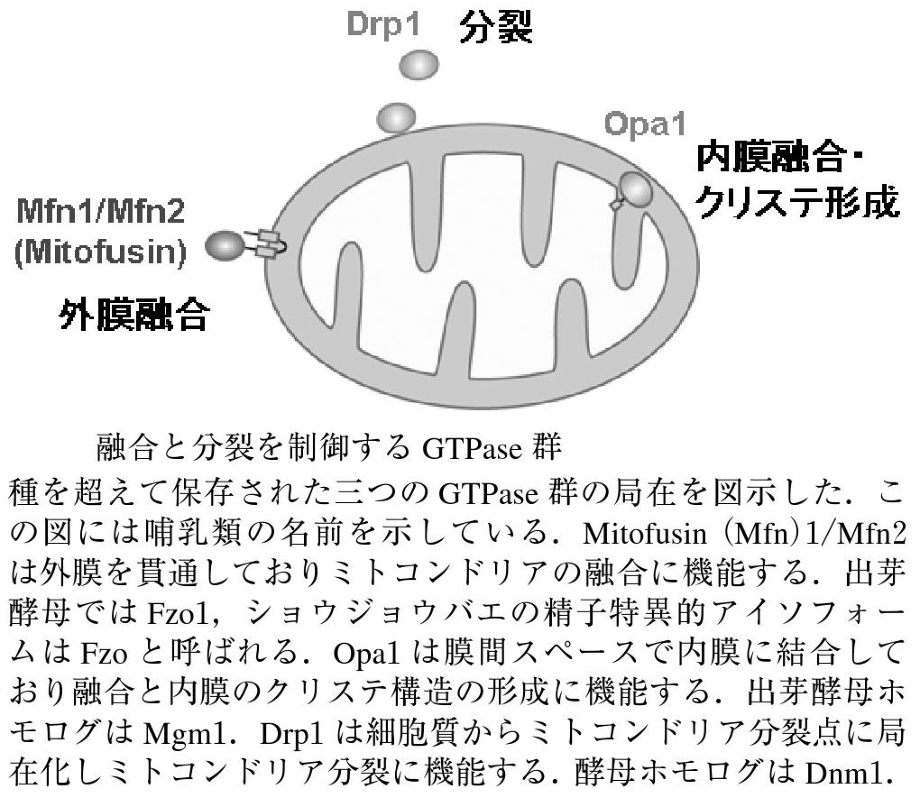
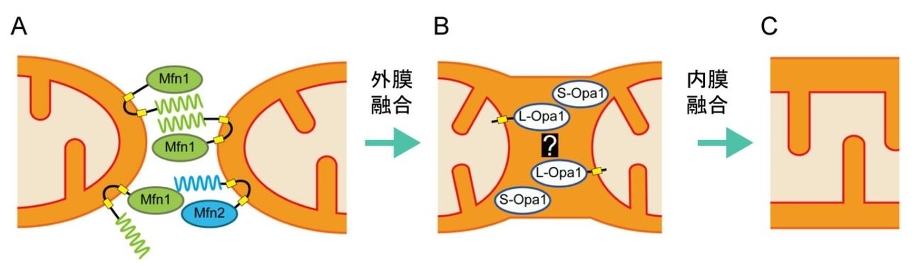
ミトコンドリアの融合と分裂に三種類のGTPaseが関与していて、外膜を貫通しているMfn1/Mfn2(Mitofusin)は融合に機能しており、Opa1は膜間スペースで内膜に結合しており、融合と内膜のクリステ構造の形成に機能しており、Mgm1. Drp1は細胞質からミトコンドリア分岐点に局在化し、ミトコンドリア分裂に機能している。
ミトコンドリアの融合を可視化するためにミトコンドリアのマトリックスに二色の異なる蛍光蛋白質を発現するHeLa細胞をそれぞれ作成し、融合させることができ、哺乳類のミトコンドリアは融合してそのマトリックスの内容物を交換できることが明らかとなった。
細胞質に存在するダイナミン様蛋白質Drp1の機能を抑制すると、ミトコンドリアの分裂が抑制され、長いミトコンドリアのネットワークが形成される。
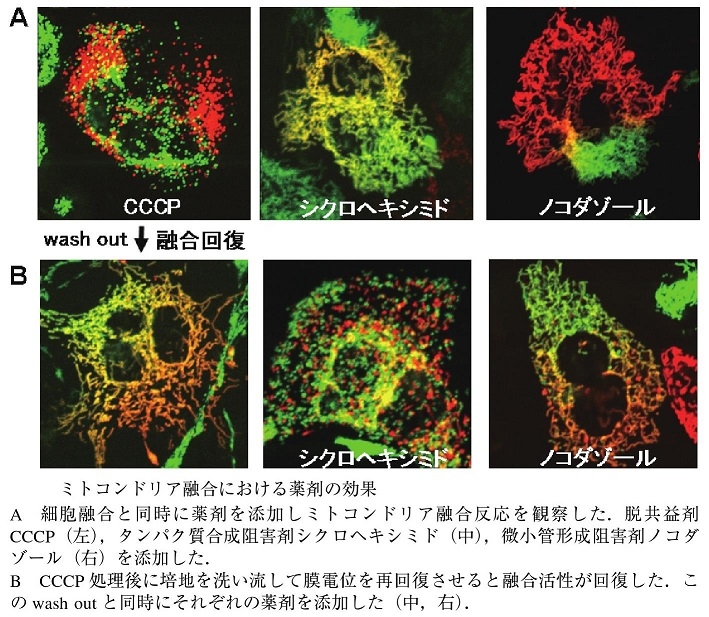
さまざまな阻害剤を用いてミトコンドリア融合の特性解析を行ったところ、CCCPの転嫁により、ミトコンドリアの融合がほぼ完全に停止することがわかった。この融合阻害は可逆的であり、薬剤を洗い流すことで融合活性が回復することもわかっている。融合反応時に微小管の重合を阻害するノコダゾールを添加すると2色のミトコンドリア蛍光の混合は強く阻害されるが、CCCP処理後のWash out時にノコダゾールを添加しても融合は観察されるので、微小管はミトコンドリアの融合自身には必須でないことがわかる。
通常の融合反応におけるノコダゾールの阻害は、ミトコンドリアの細胞内移動が阻害されることでミトコンドリアの均質化が阻害されたためと考えられる。
タンパク質合成阻害剤シクロヘキシミドを添加しても融合反応自体は阻害されないが、CCCP処理後のWash outに伴う融合活性回復時にシクロヘキシミドを添加した場合には融合の回復が見られない。この薬剤を使ってミトコンドリア膜電位を変化させて、水戸根dのリアの融合活性を変化させることによりいろいろと実験できるようになった。
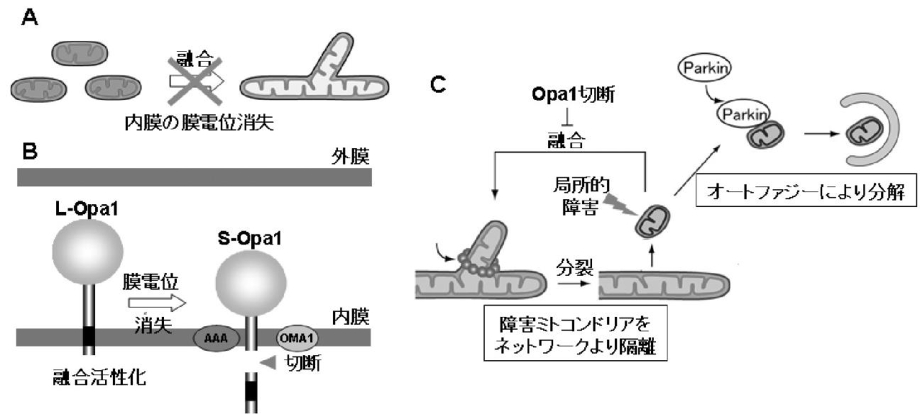
ミトコンドリアの膜電位消失時には、ミトコンドリア内のL-Opa1のN末端部分の蛋白質が切断され、S-Opa1になる。この切断によりミトコンドリアは融合活性化能を失う。障害を受けたミトコンドリア部分は膜電位を失い、Opa1の切断を介して、融合活性を失うことにより、ミトコンドリアネットワークから隔離され、Parkin局在化を引き金として、オートファージ分解される。
http://www.jbsoc.or.jp/seika/wp-content/uploads/2013/05/83-05-02.pdf
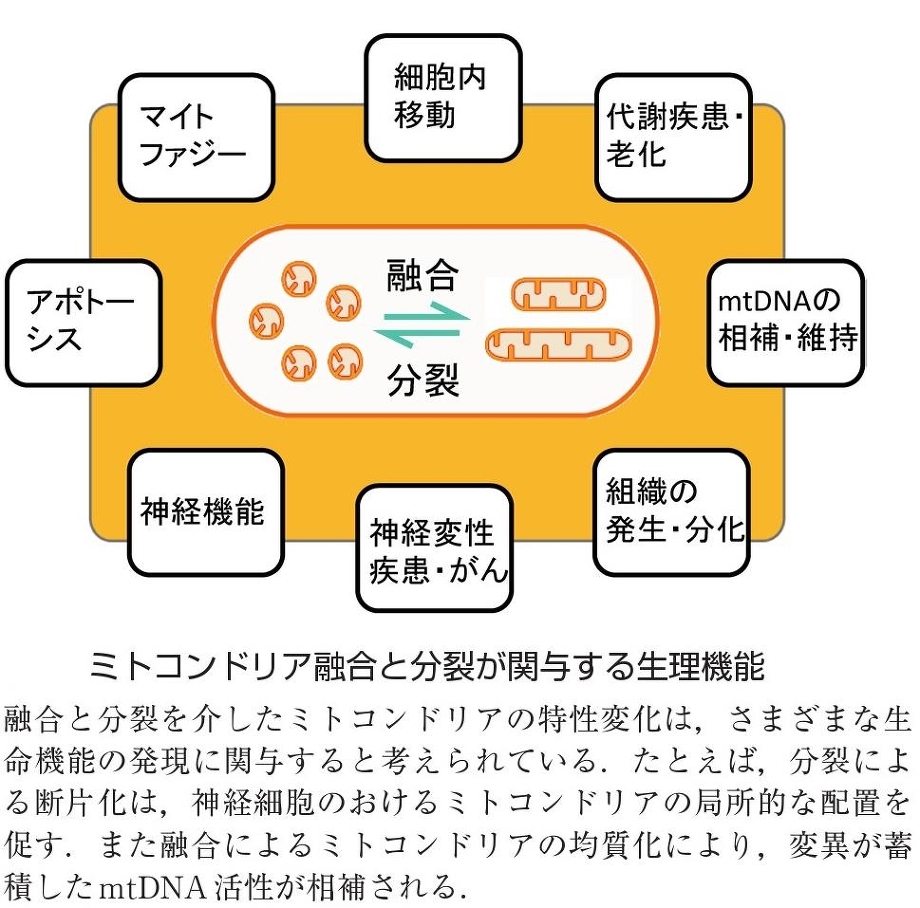
さまざまなミトコンドリアの機能は、融合と分裂のバランスの元に維持されている。
ミトコンドリアは細胞内で新規に合成されないため、現存するミトコンドリアが増殖し(大きくなり)、分裂することで細胞分裂時に娘細胞にミトコンドリアを分配していくと考えられている。しかし、実験でミトコンドリア分裂因子の機能抑制を行うと、長いミトコンドリアのネットワークが形成されるが、この場合に必ずしもミトコンドリア増殖は減少していない。
ミトコンドリア分裂因子Drp1の突然変異が重篤な新生児致死の原因となることが報告され、全身でDrp1を欠損したマウスは胎生致死となることからミトコンドリア分裂も初期発生・分化に必須な機能を持つと考えられる。
神経細胞で特異的にDrp1欠損マウスでは、出生直後に神経変性により致死となり、神経細胞内でミトコンドリアは分裂不全となりきわめて大きなミトコンドリアとなり、シナプス形成がほとんど観察されなかった。正常な神経細胞では神経突起の中に多数の小さなミトコンドリアが観察されるが、分裂を抑制すると神経突起内に分布するミトコンドリアはあまり認められず、その結果シナプス形成異常になると考えられる。
疾患とミトコンドリア機能:
ミトコンドリアの機能不全は、糖尿病などの代謝性疾患、がん、アルツハイマー病やパーキンソン病などの神経変性疾患などで見られる。
ミトコンドリア内膜に存在する呼吸鎖複合体において酸素を用いてATPを産生する際に、その副産物として活性酸素種(reactive oxygen species:ROS)を作り出す。もともとミトコンドリアに備わっているROSの除去機能を超える量のROSが産生されると、ミトコンドリア機能不全がもたらされ、老化や発がん、動脈硬化の原因になると考えられている。また、突然変異型mtDNA分子種が、糖尿病、神経変性疾患の患者組織やがん組織、老化個体の組織からも検出される。
障害を受け機能不全になったミトコンドリアに、パーキンソン病の原因因子PINK1やParkinが局在化し、その結果選択的なオートファージ分解(マイトファジー)により分解される。パーキンソン病の発症は、異常ミトコンドリアの蓄積に伴いマイトファージ―機構の破たんによる側面も考えられている。
中枢部位の神経細胞は、ミトコンドリアのエネルギー代謝が高く、ミトコンドリアの機能欠損による影響を受けやすい。
アルツハイマー病の発症に深くかかわっているβアミロイドが、細胞内のNO産生を促し、それによりS-ニトロシル化された活性型Drp1が分裂を促進し、神経細胞に損傷を与えることが報告されている。
ハンチントン病の原因となるグルタミン鎖が異常に伸長したハンチントン蛋白質がDrp1に結合し、GTPase活性およびオリゴマー化を促進し、過剰なミトコンドリア分裂を誘起していることも報告されている。
乳癌細胞株MDA-MB-231/436において、ミトコンドリア分裂抑制により、転移にかかわる細胞移動能・浸潤能が低下し、逆にミトコンドリア融合抑制によって細胞移動能・浸潤能が上昇するとの報告がされている。
ミトコンドリア融合・分裂機構:
ミトコンドリアの融合にかかわるGTPaseは、900残気ほどの膜貫通領域を持つたんぱく質である。
ミトコンドリア外膜の融合には外膜のGTPase:mitofusin(Mfn:酵母ではFzol)が関与している。MfnにはMfn1とMfn2があり、Mfn1はGTP加水分解に依存して、2つのミトコンドリアが繋留し、Mfn2と協調的に融合に機能する。外膜融合後に、Opa1により内膜融合が起こる。Opa1は内膜貫通領域を持つL-Opa1と、プロテアーゼにより膜貫通領域が欠損したS-Opa1の2つのフォームで存在しいるが、詳細な機序についてはまだ不明である。
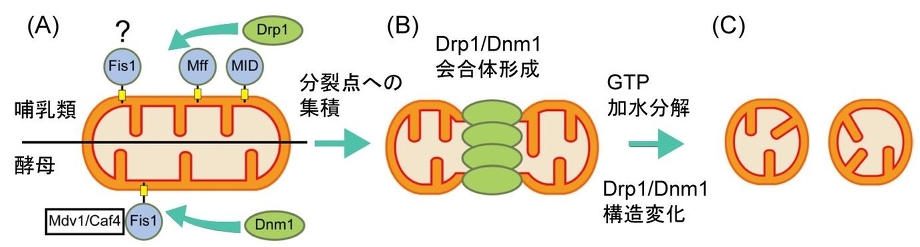
ミトコンドリア分裂には、ダイナミン様蛋白質Drp1(酵母ではDnm1)が関与している。
哺乳類では、Drp1が外膜のMffおよびMid蛋白質と複合体を形成し、分岐点に集積する。
酵母では、Dnm1がMdv1とCaf4との結合を介して外膜のFis1と複合体を形成する。哺乳類では、Fis1は、Drp1のミトコンドリアへの局在化に直接関与しないと考えられている。
分岐点での、Drp1/Dnm1の自己会合体形成に伴い、ミトコンドリア膜の変形が起こる。
GTP加水分解によるDrp1/Dnm1の構造変化により、脂質膜の分裂が促進する。
https://katosei.jsbba.or.jp/download_pdf.php?aid=315
Cell Metabolism 21(2):195-205 · February 2015
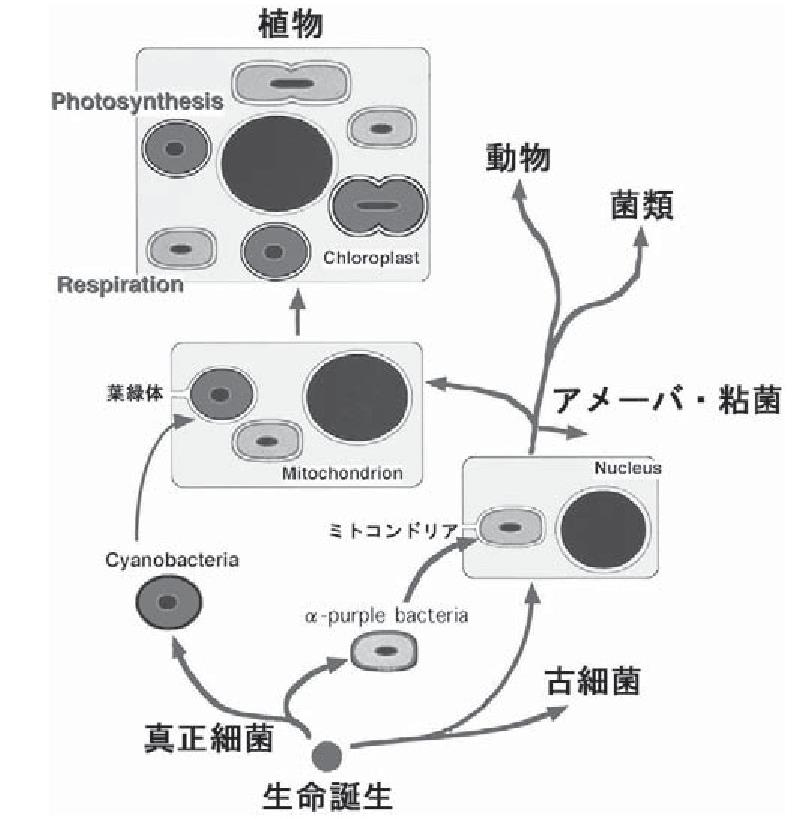
参:ミトコンドリアと葉緑体はどこから来たか
生物は原核生物として誕生し、間もなく真正細菌ドメインと古細菌ドメインを形成する生物群に分岐した。続いて古細菌ドメインから真核細胞ドメインが分岐し、アメーバ・粘菌界、動物・粘菌界(後方鞭毛生物界)、植物界が誕生した。
αプロテオ細菌(α-purple bacteria)が、宿主生物に共生し、ミトコンドリアを含む原始真核細胞生物が生まれた。この真核生物がすべての生物の要となった。この原始真核細胞にシアノバクテリア(Cyanobacreria)が共生し、葉緑体となり、植物が生まれた。
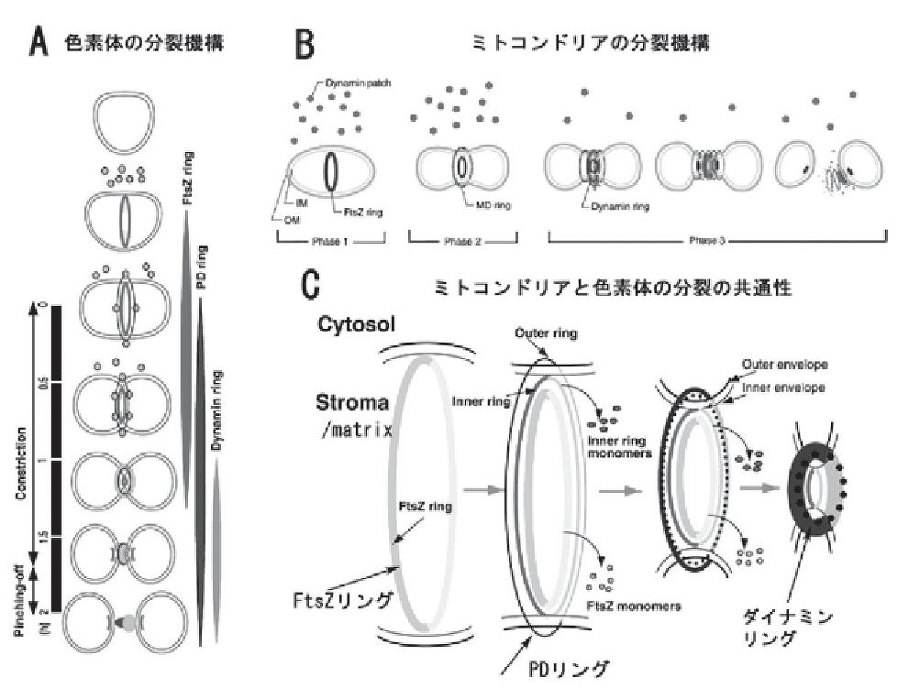
分裂早期(A、C)と分裂晩期(B、D)の葉緑体の赤道表面を走査電子顕微鏡(A,B)とNP-40処理後のネガティブ透過型電子顕微鏡(C,D)で観察するとリング(Plastid-dividing ring:PD ring)が巻き付いているのがわかる。リングは絞り込まれる前後で同じ直径の6~7nmの繊維で形成されている。この繊維の滑り込みによって、色素体の分裂面は絞り込まれ、分断されると考えられる。
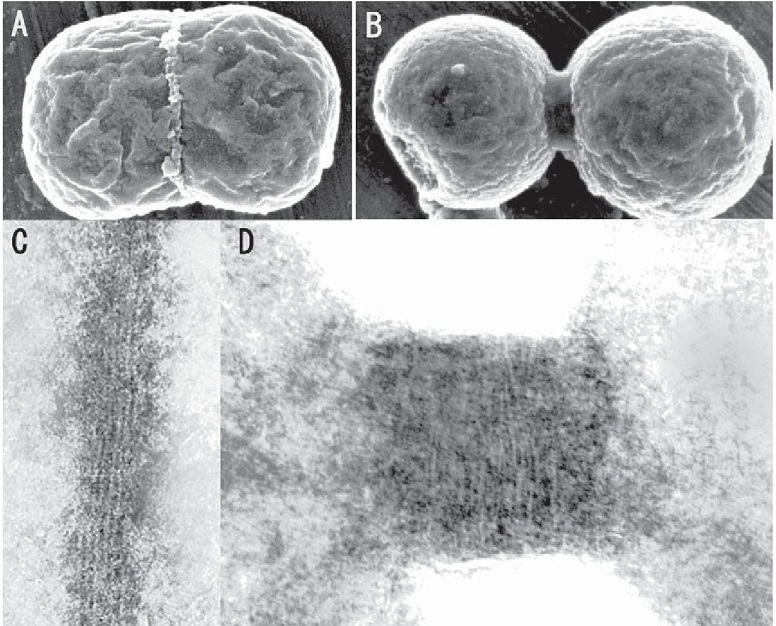
色素体の分裂(A、C)はまず、細菌由来のFtsZリングが基質(Stroma)に形成される。続いて、内外のPDリングが形成され、最後にダイナミンリングが形成されて、分裂が終了する。類似のことがミトコンドリアにも見られた(B、C)。ミトコンドリアも色素体も分裂の最後を制御しているのは、PDとダイナミンリングのような宿主細胞ゲノムによって形成されたリングである。宿主細胞核ゲノムは、オルガネラの増殖を制御するために、戦略としてPDリングやダイナミンリングを作ったと考えられる。
http://www.toray.co.jp/tsf/kouen/pdf/54-h16_2.pdf
江口暁先生の紹介
https://medicine.temple.edu/satoru-eguchi
























