川村所長の勉強会参加記録
2023.07.06
心不全予防を見据えた糖尿病治療戦略 室原豊明教授
2023年7月2日
演題「診療科を超えた心不全予防を見据えた糖尿病治療戦略」
演者:名古屋大学大学院医学系研究科 循環器内科学教授 室原豊明 先生
場所: ザ・プリンス タワー東京
内容及び補足「
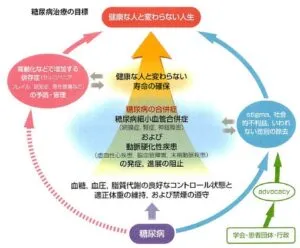
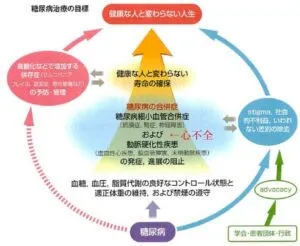
糖尿病知慮の目標は、血糖や血圧、脂質といった多因子を法覚的にコントロールし、合併症の発症・進展を阻止して健康な人と変わらない寿命を確保することである。
フィンランドで行われた、二型糖尿病患者1304例と非糖尿病患者1059例で7年間の追跡期間中、心筋梗塞既往のない糖尿病患者の心筋梗塞発症頻度は、心筋梗塞の既往がある非糖尿病患者と同じ程度のリスクがあることが示された。
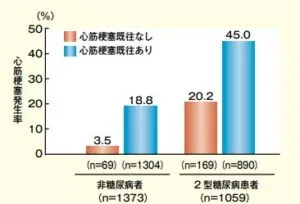
NEJM 339:229-234,1998
https://www.nejm.org/doi/full/10.1056/NEJM199807233390404
メタ解析でも2型糖尿病患者は、正常例に比べて冠動脈疾患や脳卒中が1.5~3.6倍に増加するとされている。もし、急性心筋梗塞や心臓突然死が発症する前に動脈硬化性病変が存在するハイリスク群が診断できれば、生活習慣の改善を促し、積極的な薬物理療介入を行うことによりこれらの疾患発症を予防することが可能となる。
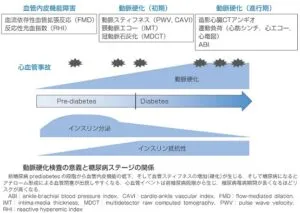
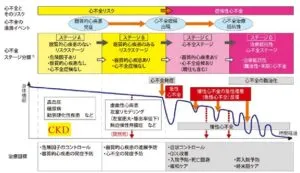
動脈硬化の進行経過と有効な諸検査の関係を下図に示す。
インスリン抵抗性は糖尿病発症の10年以上前から認められているが、インスリン分泌が亢進しているため空腹時の血糖値は正常範囲である。その段階から血管内皮機能障害が出現している。インスリン分泌が低下すると血糖値が上昇し糖尿病が発症する。その前後で血管スティフネスが増加し、特に収縮期血圧が上昇する。糖尿病罹病期間が長くなるあるいは重症になるとアテロームが形成され、心血管イベントリスクがさらに上昇する。
HbA1cの変化のみでなく、脂質異常症、慢性腎臓病の進行、血圧のコントロール状況、喫煙なども冠動脈イベントに関連する危険因子である。
糖代謝異常者における循環器病の診断・予防・治療に関するコンセンサスステートメント2020
https://www.j-circ.or.jp/cms/wp-content/uploads/2022/01/jcs_jds_statement_20220114.pdf
冠動脈硬化症のプラークの脂質および線維体積を計測した研究では、糖代謝異常がない症例に比べ、耐糖能障害症例や糖尿病症例ではプラークの量が有意に多かった。
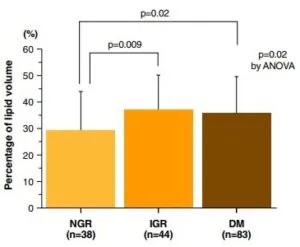
インスリン抵抗性の指標であるHOMA-IRで3分位に分けると、インスリン抵抗性の程度に応じて脂肪リッチプラーク量が有意に増加した。
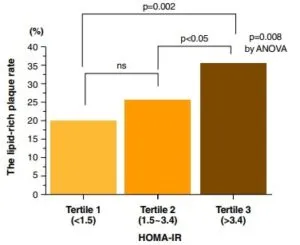
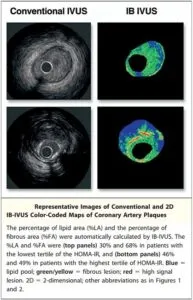
Am Coll Cardiol Img 2008;1:39–45
https://www.sciencedirect.com/science/article/pii/S1936878X07000071
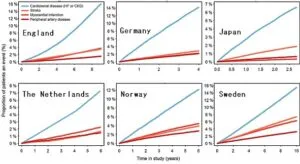
2型糖尿病患者1177896名のうち心血管疾患や腎疾患(Cardiovascular or Renal disease:CVRD)を有していない772336(66%)例を平均4.5年観察した。合計137081(18%)例がCVRDに進展した。CKD36%、HF24%、Stroke16%、MI14%、PAD10%であった。国別にみてもCVRDがダントツに多かった(日本はStrokeが他国よりも多かった)。
CVRDは死亡リスクの有意な増加と関係しておりHRは3.91であった。
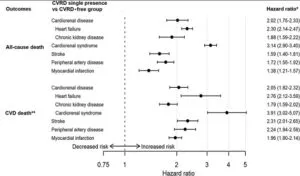
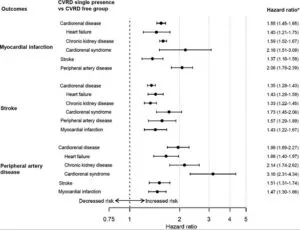
Diabetes Obesity and Metabolism 22 1607-1618 2020
https://dom-pubs.onlinelibrary.wiley.com/doi/10.1111/dom.14074
2型糖尿病患者9591例のうち1131(11.8%)に心不全が見られたがコントロールでは435(4.5%)にしか見られなかった。50代以降でその差が大きかった。
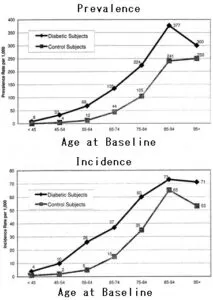
Diabetes Care 2001;24(9):1614–1619
https://diabetesjournals.org/care/article/24/9/1614/21484/Congestive-Heart-Failure-in-Type-2
3791人の参加者のうち心不全で入院する人の割合は、eGFRが低下するほど、尿中ACRが増加するほど増加した。
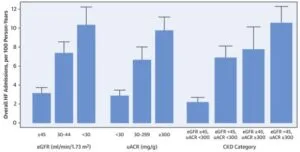
J Am Coll Cardiol. 2019 Jun, 73 (21) 2691–2700
https://www.jacc.org/doi/full/10.1016/j.jacc.2019.02.071
イギリス、ドイツ、日本、オランダ、ノルウェー、スウェーデンの約100万人の患者において、2型糖尿病、CKDの有無で4郡に分け2年間の観察期間中にうっ血性心不全、急性心筋梗塞、腎代替療法、死亡の発症率を見てみたが、いずれのエンドポイントも2型糖尿病、CKDを合併した群でリスクが増加した。
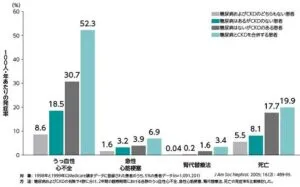
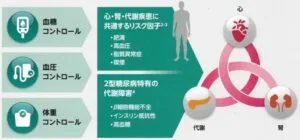
心腎代謝疾患は、複数のメカニズムで負の相互作用を示す。
高血糖状態、インスリン抵抗性、交感神経系活性化、RAAS活性化、脂肪毒性、AGEsの増加、小胞体ストレス、Ca2+ハンドリング異常、ミトコンドリア機能不全、ROSの産生、慢性炎症、内皮機能障害、ANP/BNPの上昇が心臓だけでなく、腎臓にも機能障害を引き起こす。
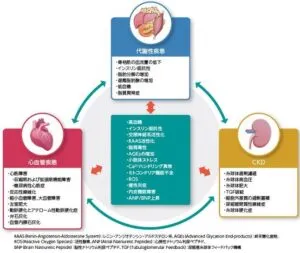
Diabetes Obesity and Metabolism 24 2283-2296 2022
https://dom-pubs.onlinelibrary.wiley.com/doi/full/10.1111/dom.14829
糖尿病性網膜症においては微小動脈瘤、毛細血管基底膜肥厚が出現する。
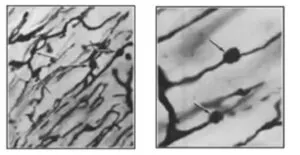
NEJM 1980 302 384-388
https://www.nejm.org/doi/full/10.1056/NEJM198002143020706
糖尿病と心不全が合併すると予後が悪化する。
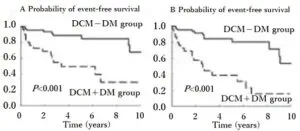
Diabetes Res Clin Pract. 2011 Jun;92(3):348-55
https://www.diabetesresearchclinicalpractice.com/article/S0168-8227(11)00100-8/fulltext
CHAEM研究で、EF良好例3023例(糖尿病患者857例,非糖尿病患者2166例)、低EF例4576例(それぞれ1306例,3270例)で平均37.7ヵ月追跡したが、心不全による入院や死亡は糖尿業があると有意に上昇した。
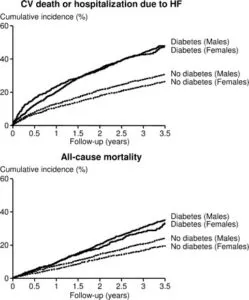
European Heart Journal, 2008, 29 1377–1385
https://academic.oup.com/eurheartj/article/29/11/1377/636933
糖尿病などの代謝性疾患は、心血管疾患や腎疾患と共通のリスク因子を有しており、相互に関連している。
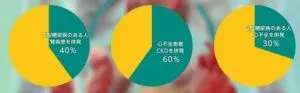
2型糖尿病患者の約40%がCKDを併発(Ann Intern Med 2016;165:473-81)、心不全患者の約30%が2型糖尿病を併発(Card Fail Rev 2017;3:52-5)、心不全患者の約60%がCKDを併発(Heart Fall Clin 2008;4:387-99)している。
糖尿病患者の治療の目標の図の合併症において心不全も入れたい。
心・腎の機能改善を早期から意識した2型糖尿病理療アプローチは、心・腎・代謝が相互に好影響をもたらし、合併症のリスクを減少させることが期待できる。
現在糖尿病の治療薬はインスリンに対する効果や血糖値に対する作用機序で下図のように分類されている。この図の中でインスリンに全然作用しない薬がSGLT2阻害薬であり、心不全やCKDの進行抑制効果が見られる薬でもある。
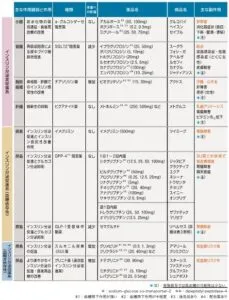
糖尿病治療のエッセンス 2022年版
https://www.med.or.jp/dl-med/tounyoubyou/essence2022.pdf
SGLT2阻害薬の臨床研究結果がEMPA-REG OUTCOME試験、CANVAS Program試験、DECLARE-TIMEで報告されており、そのまとめがLancetに掲載された。症例の背景が異なり二次予防の比率がそれぞれの試験で異なるが、SGLT2阻害薬は有効であるが、一次予防において有効性は示せなかった。


Lancet 2019 Jan 5;393(10166):31-39
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(18)32590-X/fulltext
Empagliflozinは2型糖尿病間において、Primary endpointで有効性が示され、心血管死においては38%もリスクを低減している。
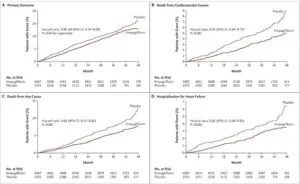
NEJM.2015 Nov 26;373(22):2117-28
https://www.nejm.org/doi/10.1056/NEJMoa1504720
アジア人における効果も検討されており、非常に有効である。
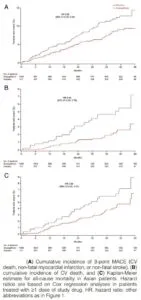
Circ J 2017; 81: 227–234
https://www.jstage.jst.go.jp/article/circj/81/2/81_CJ-16-1148/_pdf/-char/en
SGLT2阻害薬はポンプとしての心臓、パイプとしての血管、フィルターとしての腎臓に対しての効果を見てみると、腎臓障害と心不全に対して、1次、2次予防として効果が見られるが、大血管に対しては2次予防の効果しか現時点では示されていない。
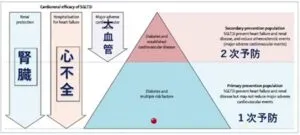
Lancet. 2019;393:3-5
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(18)32824-1/fulltext
前述した2型糖尿病患者1177896名のうち心血管疾患や腎疾患(Cardiovascular or Renal disease:CVRD)を有していない772336(66%)例を平均4.5年観察した研究の結果を追跡期間中に発症した最初のイベントで見てみると、CKD 36.2、心不全23.7%、日本集団で見てみるとCKD 39.3%、心不全30.6%と半数以上の症例をしている。このCKDと心不全にSGLT2阻害薬は有効性を示している。
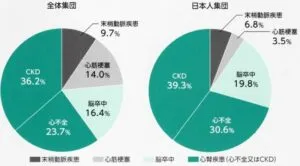
Diabetes Obes Metab 2020 22 1607-18
https://dom-pubs.onlinelibrary.wiley.com/doi/10.1111/dom.14074
より作図されたジャディアンスのパンフレットの図を掲載
CKDの発症は心不全よりも頻度が多いので、心不全の重症度分類のステージAにCKDも追加して考える必要がある。
心不全の治療アルゴリズムが2021年にアップデートされた。
LVEF<40%のHFrEFの症例に対してSGLT2阻害薬の併用が推奨された。
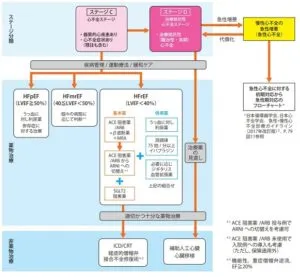
心不全治療アルゴリズム 日本循環器学会ガイドライン2021
https://www.j-circ.or.jp/cms/wp-content/uploads/2021/03/JCS2021_Tsutsui.pdf
EF<40%のHFrEF3730例(平均年齢67歳、虚血性心不全51%、糖尿病50%、Af36%、平均eGFR 62)でEmpaglifrozin 10㎎とプラセボで16か月(中央値)の経過観察を行った。
心不全悪化による入院と死亡は25%低下した。
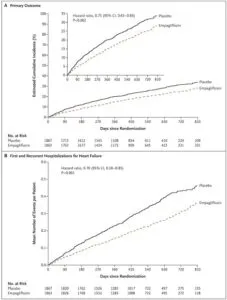
NEJM 2020 383 1413-1424
https://www.nejm.org/doi/10.1056/NEJMoa2022190
EF<40%のHFrEF 4744例(平均年齢66歳、虚血性心不全56%、糖尿病42%、AF48%、eGFR 66)に対してDapagliflozin 10mgとプラセボで18.2か月(中央値)の経過観察で心不全による入院・悪化及び心血管死が26%低減できた。
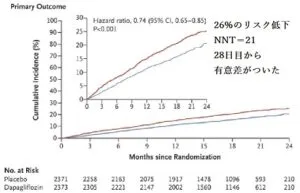
NEJM 2019 381 1995-2008
https://www.nejm.org/doi/10.1056/NEJMoa1911303
両試験のメタ解析から見えてくることとして以下のものがあげられる
全死亡や心血管死というハードエンドポイントをクリアしている。
心不全や腎臓のイベントは、プラセボと比較し減少している。
糖尿病の有無やBMIにかかわらず、有効である。
ARNI治療の有無にかかわらず、有効である。
55歳未満で、やや効果が弱いが、傾向はある。
eGFR 60でみたCKDの有無に関わらず、有効である。
NYHAの3~4度よりも、2度の段階でより有効か。
アジア人やAfrican-Americanで、有効性が強そうだ。
現在欧米の心不全治療の基本はMRA、ベータ遮断薬、ARNI、SGLT2阻害薬の組み合わせるFantastic fourが主流となっている。
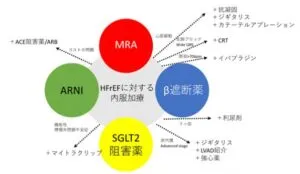
European Heart Journal, 2021; 42(6):681-683
https://europepmc.org/article/PMC/PMC7878007
EF≧40%の慢性心不全患者5988例を対象にEmpaglifrozin10㎎投与群2997例とプラセボ2991例で26.2か月(中央値)の追跡を行った。主要エンドポイントはEmpaglifrozin群で415例(13.8%)、プラセボ群で511例(17.1%)に発生し、統計上有意に21%のリスク低下を認めた。
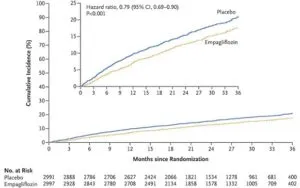
NEJM 2021 385 1451-1461
https://www.nejm.org/doi/10.1056/NEJMoa2107038
Empaglifrozinの心不全に対する臨床的効果は、25%<EF<65%で有効であり同等の効果であったが、EF≧65%の患者では効果が減弱した。
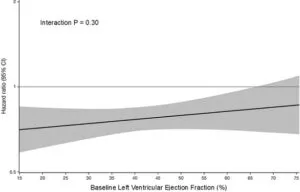
Eur Heart J 2022 43 416-26
https://academic.oup.com/eurheartj/article/43/5/416/6455932?login=false
2021年に発表された米国心臓病学会ACCエキスパートコンセンサスでは、心不全症状を呈するステージCのHFrEFについてはeGFR≧20mL/min/1.73m2かつNYHA分類で2~4である場合、SGLT2阻害薬を標準的に追加することが推奨された。
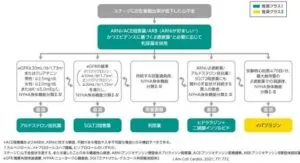
2023度版においては、HFpEFの治療に関しては、まずSGLT2阻害薬をはじめに投与するアルゴリズムが提唱された。
禁忌事項に該当しない限り、HFpEF都心案された患者に対して、心血管死や心不全による入院リスク軽減のためにSGLT2阻害薬を投与すべきである。
入院時のGDMT(診療ガイドラインに基づく標準的治療)の導入は長期的なアドヒアランスと処方の持続性と関連しているため、SGLT2 阻害薬は、臨床的に心不全の状態が安定した入院中に投与を開始すると有効であると考えられる。
LVEFが55~60%未満の場合、MRA、ARNI、またはARBの使用を検討することがある。
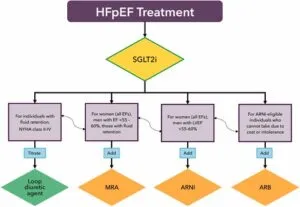
J AM coll cardiol 2023 81 1835-78
https://www.jacc.org/doi/full/10.1016/j.jacc.2023.03.393
SGLT2阻害薬が特段の禁忌や使いにくい状況とは?
この薬剤にアレルギー歴がある人
尿路・陰部感染症を繰り返す人(腹圧性尿失禁があり、治療していない人)
高齢者でかつフレイル、サルコペニアのある人
認知症の人
ケトアシドーシスの既往がある人
SU薬やインスリンで治療中の人
シックデイや手術を控えている人
激しい運動をしている人
腎機能が低下した人(eGFR<30)
1型糖尿病の人は糖尿病専門医にコンサルト要
上記以外の人で心不全リスクのある人は、原則SGLT2阻害薬を処方しておいた方が良いと考える(私見)。
























