その他
2024.09.21
糖尿病合併腎臓病対策 森克仁准教授
2024年9月13日
演題「糖尿病合併腎臓病対策 ~新時代の幕開け~」
演者:大阪公立大学大学院医学研究科 腎臓病態内科学准教授 森 克仁 先生
場所:横浜TKPガーデンシティPremium横浜ランドマークタワー ミーティングルームK
内容及び補足「
2022年末慢性透析療法を受けている患者総数は347474人約35万人で、およそ日本人380人に一人の割合になる。
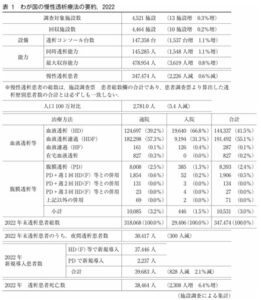
https://docs.jsdt.or.jp/overview/file/2022/pdf/01.pdf
1ヶ月の透析治療の医療費は、患者一人につき外来血液透析で約40万円、腹膜透析では30~50万円程度が必要と言われている。
腎生検を行った2型糖尿病に伴う糖尿病性腎症と診断された260例の長期予後を見てみると、eGFRが60以上の症例群でも、60未満の症例群でもで、正常アルブミン尿/蛋白尿の群の予後は微量アルブミン尿/蛋白尿よりもよく牽制アルブミン尿/蛋白尿の群の予後が一番悪いことはすでに示されている。
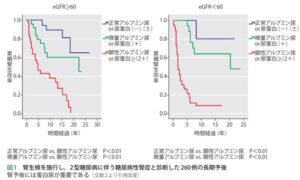
https://www.jstage.jst.go.jp/article/naika/105/3/105_482/_pdf
2022年末時点での慢性透析患者の原疾患で最も多いのは糖尿病性腎症の39.5%で、次いで慢性糸球体腎炎が24.0%、腎硬化症が13.4%である。
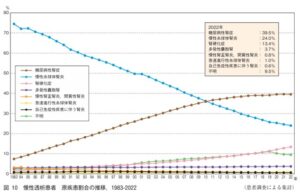
https://docs.jsdt.or.jp/overview/file/2022/pdf/02.pdf
糖尿病性腎症は少なくとも5年以上の糖尿病罹患期間があり、尿検査で微量アルブミン尿~顕性アルブミン尿が持続し、眼底検査で糖尿病網膜症が存在する場合に疑われる。糖尿病性腎症は、eGFRは当初保たれ、微量アルブミン尿が出始め、持続し、顕性アルブミン尿となってからeGFRは急激に低下し、透析が必要な病態へと移行する。
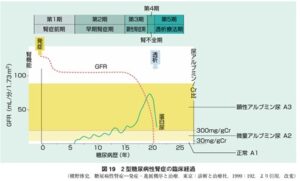
日本腎臓学会編CKD診療ガイド2012
https://jsn.or.jp/guideline/pdf/CKDguide2012.pdf
高齢化や肥満者の増加、糖尿病や高血圧症に対する新規治療薬の開発などがあり、糖尿病患者に合併した腎臓病が多様化している。糖尿病性腎症合同委員会が腎症病期分類を2014年に改訂した。
今回の改訂では、CKD重症度分類や国際的な表記とより整合性がとりやすくなるよう、「第1期(腎症前期)」を「正常アルブミン尿期(第1期)」「第2期(早期腎症期)」を「微量アルブミン尿期(第2期)」、「第3期(顕性腎症期)」を「顕性アルブミン尿期(第3期)」、「第4期(腎不全期)」を「GFR高度低下・末期腎不全期(第4期)」、「第5期(透析療法期)」を「腎代替療法期(第5期)」へ変更した。
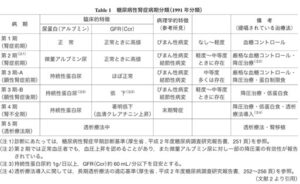
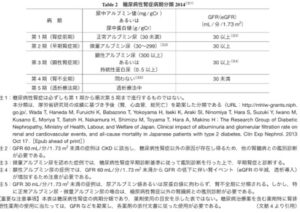
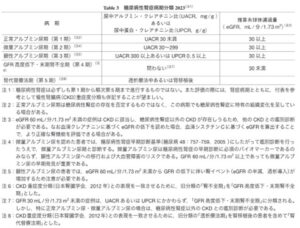

日腎会誌 2023 65(7)847-856
https://cdn.jsn.or.jp/data/DKD2023.pdf
・高血圧性腎硬化症の臨床的特徴
高血圧歴を有し、血尿を認めず、蛋白尿が高頻度でない
糖尿病、原発性あるいは二次性の糸球体腎炎を認めない腎機能低下症例が多いが、これらの疾患と併存している症例も想定される。
一般的には緩徐な腎機能障害の進行を示す。
透析導入患者の中で腎硬化症の占める割合が年々増加傾向にある。
・高血圧性腎硬化症の形態的・病理学的特徴
病理学的検討により診断される症例は比較的少ない。
形態学的には、末期では、皮質が菲薄化し、腎表面が粗大顆粒状となり、腎萎縮を認める。
組織の病理所見は、動脈の内膜肥厚、細動脈の硝子様変性、糸球体虚脱を呈し、至急対抗か、間質線維化、尿細管萎縮といった所見を認める。
CKD診療ガイドライン2024
https://jsn.or.jp/data/gl2024_ckd_ch03.pdf
腎硬化症の変化は黄色い線のように徐々に腎機能の低下が進行するがアルブミン尿や蛋白尿の発現頻度は少ない。糖尿病性腎症の場合は青色の線のように、微量アルブミン尿/蛋白尿が発現し、顕性化し腎機能の低下を来す変化を取ることが多い。
糖尿病に高血圧を合併したり、高血圧に糖尿病を合併している症例においては、この二つの変化の中間をたどることも少なくないと考えられる。
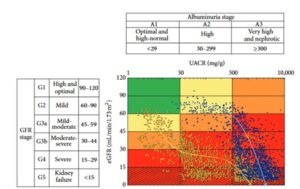
J Diabetes Res. 2016;2016:5374746
経口血糖降下薬はインスリン分泌非促進系、インスリン分泌促進系(血糖依存性、血糖非依存性)のカテゴリーに分類され、その作用臓器は小腸、腎臓、脂肪組織、肝臓、膵臓ラ氏島の5つの臓器に大別される。
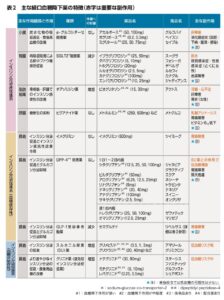
糖尿病治療のエッセンス2022年版
https://www.med.or.jp/dl-med/tounyoubyou/essence2022.pdf
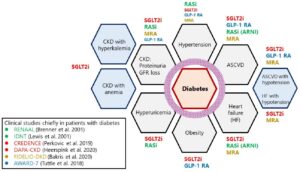
2022年のADA/EASD (the American Diabetes Association and the European Association for the Study of Diabetes)から出された2型糖尿病の高血糖管理に関するコンセンサスリポートは下図の左側の「心腎リスク抑制」をゴールとして薬物選択を考える部分では、「ASCVDの既往あり」、「CVD高リスク状態」、「心不全あり」、「CKDあり」の4つのカテゴリーに分類されている。「ASCVDあり」または「高リスク状態」に該当する場合は、CVDリスク抑制が示されたGLP-1受容体作動薬またはSLT2阻害薬を第一選択とし、「心不全あり」に該当する場合は、心不全リスクの抑制が示されたSGLT2阻害薬を、「CKDあり」に該当する場合にはCKDの進行抑制が確認されたSGLT2阻害薬を推奨している。
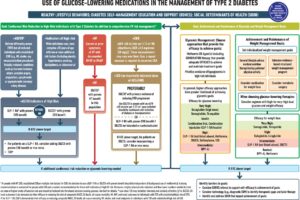
Diabetes Care December 2023, Vol.47, S158-S178.
2型糖尿病の大規模臨床試験においては、介入の結果によるアウトカムの評価が重要であり、評価の判定として、主要評価項目は、心血管死、非致死性心筋梗塞、非致死性脳卒中の複合エンドポイントの3 point MACE(Major Adverse Cardiovascular Events)と、心不全による入院などの副次評価項目が設定されていた。
2007年のロシグリタゾンを使用した臨床試験の結果のメタ解析において、ロシグリタゾンの使用により心筋梗塞が43%、心血管死が94%増加するとNissenラが報告し、一大議論を巻き起こした。これを受けFDAの諮問委員会は、糖尿病のすべての新薬に関して2段階の心血管疾患に関する安全性評価を義務づけることを勧告し、1. 第3相までの販売前試験で対象治療に対する実薬治療の心血管イベントのハザード比の95%信頼区間の上限が1.8を下回ること、2.承認後の臨床試験において、対象治療に対する実薬治療の心血管イベントのハザード比の95%信頼区間の上限が1.3を下回ること、を要求することを推奨し、新薬の承認について上記のプロセスをとることを製薬企業に課した。
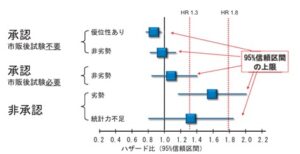
糖尿病 63(10)678-688 2020
https://www.jstage.jst.go.jp/article/tonyobyo/63/10/63_678/_pdf/-char/en
DDP-4阻害薬に関するランダム化試験のメタアナリシスではMACEのORは0.99、全死因死亡率のORは0.99、および心不全のORは1.05でリスクの増加とは関連していなかった。
Nutr Metab Cardiovasc Dis. 2021 Sep 22;31(10):2745-2755.
https://www.sciencedirect.com/science/article/abs/pii/S0939475321002799
GLP1-RAの臨床試験5件42920例、SGLT2iの臨床試験8件34322例のデータ解析の結果GLP1-RA試験の患者4871例、SGLT2i試験の患者3342例にMACEイベントを経験した。GLP1-RAは相対リスクを12%、SGLT2iは11%減少させた。
ASCVDが確立された患者では14%の減少に限られたが(GLP1-RAでHR 0.87、SGLT2iでHR 0.86とほぼ同等の効果)、MRF患者では治療効果は認められなかった。

心筋梗塞を経験した患者は4274例(GLP1-RAで2670例、SGLT2iで1604例)、脳卒中を経験した患者は2237例(GLP1-RAで1177例、SGLT2iで1060例)、心血管死を経験した患者は3132例(GLP1-RAで1876例、SGLT2iで1256例)であった。
心筋梗塞の相対リスクをGLP1-RAは9%、SGLT2iは11%減少した。
脳卒中の相対リスクはGLP1-RAは14%減少させたが、SGLT2iは効果がなかった。心血管死の相対リスクはGLP1-RAで12%、SGLT2iは16%減少させた。
心不全HHFは2240例:GLP1-RAで1278例、SGLT2iで962例発生した。GLP1-RAは心不全の相対リスクを有意に低下させなかったが、SGLT2iは31%も減少させた。
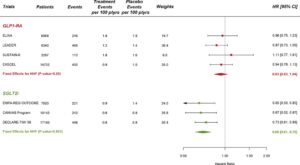
全体として、広範な複合腎臓エンドポイントは5071例の患者で発生した。GLP1-RAは18%、SGLT2iは38%も有意に減少した。
SGLT2iはeGFRの悪化、末期腎疾患、または腎死の相対リスクを45%有意に減少させた。血清クレアチニン単独の倍増を用いた感度解析でもほぼド内向か推定値が得られた(HR 0.56)。

Circulation 139 2022-2031 2019
https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.118.038868
GLP-1 RA(赤)、DPP-4i(緑)、SGLT-2i(青)投与によるMACE(A)、心血管死(B)、脳卒中(C)、非致死性心筋梗塞(D)、心不全による入院(E)に及ぼす影響を検討したまとめを見てみると、GLP-1 RAは急性心筋梗塞や脳卒中などの心血管イベントとそれに伴う死亡を効果的に防ぐことが示されている。SGLT-2iは心血管イベントも減少し心不全による入院も減少させている。
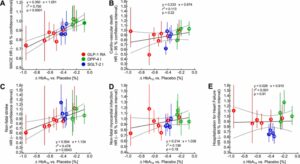
Mol Metab. 2021 Apr:46:101102. doi: 10.1016/j.molmet.2020.101102.
https://www.sciencedirect.com/science/article/pii/S2212877820301769?via%3Dihub
CKDを合併している糖尿病患者に対して、The Kidney Disease: Improving Global Outcomes(KDIGO) 2022に出したClinical Practice Guidelineでは生活習慣の改善、ファーストライン薬としてSGLT2iとメトホルミンが推奨され、セカンドラインとしてGLP-1 RA、非ステロイドMRA薬が推奨された。
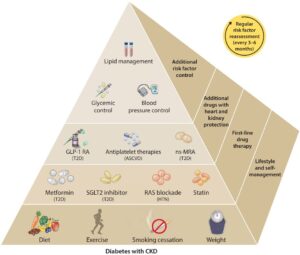
Kidney Int. 2022 Nov;102(5):990-999.
https://www.kidney-international.org/article/S0085-2538(22)00518-X/fulltext
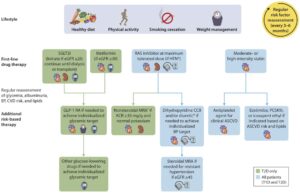
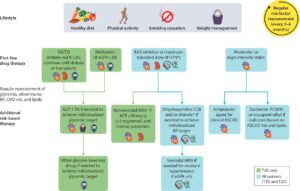
Diabetes Care 2024;47(Supplement_1):S219–S230
参:2024年のガイドラインはさらに変更されている。
KDIGO CKDガイドライン2024をまとめてくださった「腎臓内科専攻医おちばの備忘録」より
- クレアチニンが当てにならないときはシスタチンCをうまく使おう
- 蛋白制限は緩めに。8g/kgは維持を。
- 診察室血圧は120mmHg未満まで厳格に!
- RASi使用による高カリウム血症の場合、できるだけRASiの減量中止以外の方法で、カリウムコントロールを。
- 2型糖尿病でeGFR≧20にはSGLT2iを推奨
- eGFR 20-45では、尿アルブミン/Cr比<200でもSGLT2iを提案
- RASi入れた2型糖尿病でeGFR>25,高Kなし、ACR>30なら、MRAをりれることを提案
- 2型糖尿病合併CKDで、メトホルミン+SGLT2iでも血糖コントロールができないなら長時間作用型GLP-1RAの使用を推奨
- 無症候性の高尿酸血症に対して、CKD進行を予防する目的での尿酸降下薬は使用しないことを提案
- 50歳以上ならスタチン±エゼチミブを推奨(透析/移植例は除く)
https://ikuji-doctor.com/kdigo-ckd-guideline-2024/

Kidney Int. 2024 Apr;105(4S):S117-S314.
https://www.kidney-international.org/article/S0085-2538(23)00766-4/fulltext
CKDと2型糖尿病を有する患者に対して非ステロイド選択的ミネラルコルチコイド受容体拮抗薬(MRA)であるfinerenoneを投与する群(F群)3686例とプラセボ投与群(P群)3666例を中央値3.4年追跡した。F群458例12.4%、P群519例14.2%に主要転帰イベントが発生した(HR 0.87)。この差は主に心不全による入院の発生率の低下によった。
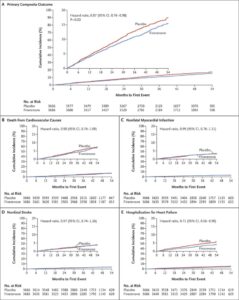

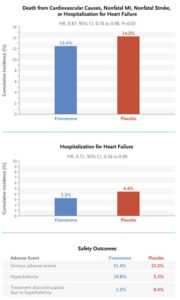
N Engl J Med 2021;385:2252-2263
https://www.nejm.org/doi/full/10.1056/NEJMoa2110956
https://www.nejm.org/doi/pdf/10.1056/NEJMoa2110956
糖尿病でアルブミン尿を認めない慢性腎臓病(CKD)を糖尿病性腎臓病(DKD)と故障することも提案されている。
近年多種多様な糖尿病治療薬が日常診療で使用可能となった。特にDPP-4阻害薬、GLP^1受容体作動薬、SGLT2阻害薬の登場により治療トレンドが大きく変わった。
厳格な血糖コントロールによる合併症の発症、進展の抑制から、低血糖を来さず血糖変動の少ない質のよい血糖管理が求められるようになった。我が国ではDPP-4阻害薬の使用頻度が激増した。さらに、大規模な無作為化比較試験の結果より、SGLT-2阻害薬とGLP-1受容体作動薬の血糖コントロール非依存的な新血管系、腎に対する保護効果が示され、血糖降下薬から糖尿病治療薬へのパラダイムシフトが起こっている。
αグルコシダーゼ阻害薬:我が国では透析を含む腎不全で投与可能である。毎食直前投与のため、服薬継続率は低く消化器症状が出やすい。海外では腎不全期における使用は推奨されていない。
SGLT2阻害薬:ADA/KDIGOコンセンサスレポートでは推奨度が高く、現在は投与可能なeGFRの下限について議論になっており、eGFR20以上で投与開始可能。腎代替療法まで継続投与可能と記載されている。一方、日本腎臓学会による「CKD治療におけるSGLT2阻害薬の適正使用に関するrecommendation」では、糖尿病合併CKD患者に対して腎保護効果が期待されるため積極的な使用を考慮する(CKDの重症度分類の末期腎不全に該当するeGFR15未満では新規に開始しない。継続投与して15未満となった場合では、副作用に注意しながら継続する)と記載されている。いずれにしても、腎不全期では血糖降下作用は期待できないことには注意が必要である。
チアゾリジン薬:我が国では重篤な腎機能障害では投与禁忌である。主に歓待者/胆汁排泄であるため薬物動態的な問題は少なく、海外では腎不全においても血糖降下作用を発揮するため使用可能であるが、体液貯留、心不全リスクに注意が必要とされている。
ビグアナイド薬:メトホルミンは代謝を受けずみへん硬いが主に腎排泄であるため、我が国でも海外でもeGFR 30未満では乳酸アシドーシスのリスクが高まることから禁忌である。
イメグリミン:血糖依存性のインスリン分泌促進作用、さらにインスリン抵抗性改善作用も示唆されている。新規薬剤で充分なデータやエビデンスがなく、eGFR 45未満での使用は推奨されておらず、今後の検討が必要な薬物である。
DPP-4阻害薬:我が国で最も使用されている経口血糖降下薬である。RCTの結果より心血管複合イベント、腎複合イベントに対してニュートラルであることが示されている。透析を含む腎不全期でも血糖降下薬として有効であり、かつ低血糖をきたしにくい。各薬物の代謝/排泄経路により、用量調節が必要な薬物、透析期でも常用量が使用可能な薬物がある。透析を含む腎不全期での血糖降下薬として重要な位置を占める。
GLP-1受容体作動薬:腎不全期においても血糖降下作用は確実であり、エキセナチド以外は透析を含む腎不全期でも使用可能である。ただし、嘔気、下痢、便秘などの消化器症状が出現しやすいため、投与には注意が必要である。RCTで腎複合イベントを主要評価項目にした結果はないが、メタ解析で腎イベント抑制効果が示され、海外では使用が推奨されている。最近経口のGLP-1受容体作動薬も使用可能となった。
スルホニル尿素薬:血糖降下作用は強いが、重症低血糖の原因薬物として最も頻度が高い。肝代謝で、グリベンクラミドは胆汁排泄、グリメピリドとグリクラジドは腎排泄の割合が高い。安全性にかかわるのはそれぞれの中間代謝産物の血糖降下作用と血中への残存である。グリベンクラミドとグリメピリドの代謝産物は血糖降下作用を有し、腎不全では代謝産物の血中濃度が上昇し、重篤な遷延性低血糖のリスクが高くなる。一方、グリクラジドの代謝産物も血糖低下作用を有するが、血中の残存率が低いためグリベンクラミドとグリメピリドと比較し、低血糖は生じにくいと考えられている。海外では、グリメピリドを含め一部は低血糖に注意しながら使用可能である。我が国の添付文章では重篤な腎機能障害では投与禁忌である。
即効型インスリン分泌促進薬(グリニド薬):ナテグリニドは代謝産物に血糖低下作用が残存し腎排泄のため低血糖をきたす危険性があり腎不全では禁忌であるが、ミチグリニドとレバグリニドは透析期においても使用可能であり、食後高血糖の是正にはよい適応となる。
インスリン:上述の安全に使用可能な薬物が登場するまで、腎不全期における薬物療法の基本であった。即効型、中間型と、アナログ製剤である超速効型、持続型溶解、さらに配合溶解、混合型を始め様々なインスリン製剤が存在する。腎不全では、インスリンクリアランスが低下するため低血糖が生じやすいため、減量が必要となる。超速効型に比較し即効型は血糖降下作用が遷延し、また、持続型溶解に比べて中間型は血糖降下作用のピークがあるため、低血糖をきたしやすくなる。透析期では、血液透析による血糖変動が顕著で、透析日と非透析日でインスリン投与量の調節が必要な症例も少なからず存在する。

糖尿病66(3):194~198,2023
https://www.jstage.jst.go.jp/article/tonyobyo/66/3/66_194/_pdf/-char/ja
SGLT2阻害薬:インスリンに依存せず、尿中へ糖を排泄させることで高血糖を是正する薬物。
腎糸球体で濾過されたグルコースは、正常血糖では、その90%(約160g)が近位尿細管の前半部分である近位尿細管のSGLT2によって再吸収され、残りの10%(約20g)が近位尿細管の後半部の近位直尿細管のSGLT1によって再吸収される。このときSGLT1は、15%しか働いておらず、85%を予備能として備えている。そこでSGLT2阻害薬により、近位局尿細管での糖再吸収が阻害され、高濃度のグルコースが近位直尿細管に達すると、SGLT1が100%稼働し、120gまでグルコースを再吸収できる。このように、腎尿細管にはSGLT2の下流にあるSGLT1による糖再吸収のバックアップ機構があり、これがSGLT2阻害薬は少なくとも単独で用いた場合比較的低血糖を起こしにくいことに寄与している。さらに、SGLT2阻害薬投与時にはグルカゴンの上昇と糖産生の行進が加わり、血糖値が維持される。
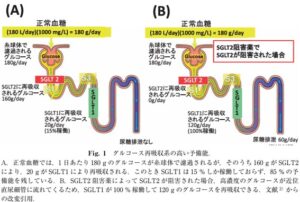
SGLT2阻害薬は、一般に蛋白結合率が高めであり、糸球体で濾過される薬物量は限られているため、SGLT2阻害薬は糸球体で濾過されて尿側から作用するのか、あるいは血管側から作用するのかという議論があったが、SGLT2発言細胞を用いたin vitroでの検討により、SGLT2阻害薬は細胞内からではなく、細胞外から作用することが結論された。すなわち、SGLT2阻害薬は尿側から作用する。近位尿細管の管腔内液は、SGLT2を充分阻害する薬物濃度となっていることも、臨床用量投与時の血中濃度と蛋白結合率から推定されている。
SGLT2阻害薬は、高血糖を是正することで膵β細胞を保護し、糖を排泄させるエネルギー代謝を腑に傾け体重を減少させ、インスリン抵抗性を改善し、その二次的、三次的影響により様々な代謝的改善をもたらす。
血清尿酸値低下もその一つであるが、この機序として、尿細管の尿酸トランスポーターへの作用が提唱されている。これは、SGLT2阻害薬によって尿細管内で高濃度になったグルコースが管腔側のGLUT9に作用し、Glut9を介する尿酸の再吸収が抑制され、尿酸が尿中に排泄されることによる。また、Glut9はグルコースと尿酸の交換輸送も担っているため、管腔内に上昇したグルコースが、尿細管細胞内の尿酸を管腔内に排出させることになり、さらに尿酸の尿中排泄が促進され、血清尿酸値の低下をもたらすと考えられている。
以前SGLT2阻害薬は、Na+の排泄を増加させ、電解質バランスに影響する可能性が指摘されていたが、臨床試験および動物実験においても、投与開始直後を除いて、糖排泄上昇に伴うNa+の排泄上昇はないことが報告されている。SGLT2を介するNa+の5~10%(糸球体で濾過されるNa+の3~7%)程度であり、量的には多いものではなく、遠位側のNa+再吸収機構により容易に代償され得るものと考えられる。
SGLT2阻害薬投与により膵臓α細胞のグルカゴン分泌が促進されることがin vitroで確認され、SGLT2阻害薬投与時のグルカゴン上昇に寄与していると推定されている。
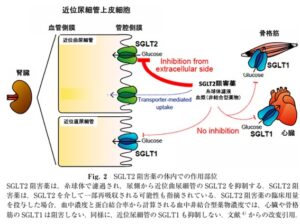
糖尿病59(9)628-631 2016
https://www.jstage.jst.go.jp/article/tonyobyo/59/9/59_628/_pdf/-char/ja
エンパレグフロジンを用いたEMPA-REG outcome trial、カナグリフロジンを用いたCANVASでは3 point MACEを有意に抑制し、一次予防が多かったダパグリフロジンについてのDECLARE TIMI58では心不全は抑制され、3 point MACEについては抑制傾向を認めた。また、eGFRの低下速度の抑制などの腎保護効果についてもSGLT2阻害薬のクラスエフェクトとして認められると考えられている。

糖尿病63(10) 678-688 2020
https://www.jstage.jst.go.jp/article/tonyobyo/63/10/63_678/_pdf/-char/en
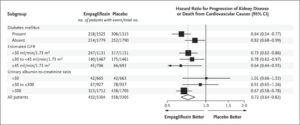
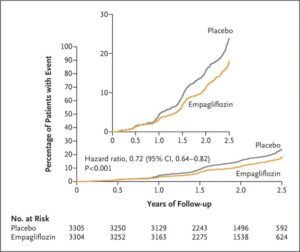
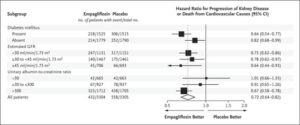
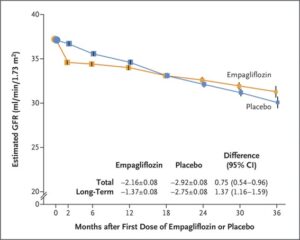
eGFR 20~45のCKD診療ガイドライン2012患者または尿中アルブミン・クレアチニン比が200≧でeGFR が45以上90未満のCKD患者6609例を中央値2.0年追跡した。エンパグリフロジン群3304例中432例13.1%、プラセボ群3305例中558例16.9%に腎臓病の進行または心血管疾患による死亡が発生し、エンパグリフロジン群のハザード比0.72と有意に有効であった。糖尿病の有無にかかわらず、eGFRのどのサブグループでも有効であった。
何らかの原因による入院率もエンパグリフロジン群の方が低かった(ハザード比0.86)。心不全による入院または心血管系の原因による死亡はエンパグリフロジン群で4.0%、プラセボ群で4.%、また何らかの原因による死亡はそれぞれ4.5%と5.1%で統計上有意差は認めなかった。
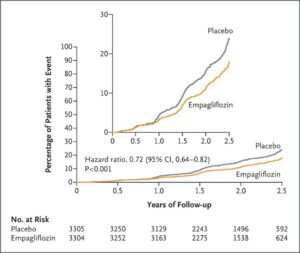
N Engl J Med 2023;388:117-127
https://www.nejm.org/doi/full/10.1056/NEJMoa2204233
慢性腎臓病の医薬品の早期開発を促進するためには、長期予後糖を初速する適切な代替エンドポイントなどの治療薬の臨床的有効性評価法が必須である。
2~3年での推算糸球体濾過量(eGFR)の30~40%の低下
eGFR slope
アルブミン尿減少
等が提唱されている。
https://jsn.or.jp/medic/data/guidelines1205.pdf
参:
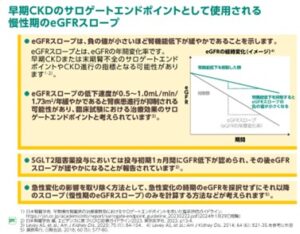
CKD診療ガイド2024における主な改訂ポイント
DAPA-CKD
eGFRが25~75ml/minで尿中アルブミン・クレアチニン比が200~5000の4304例をダパグリフロジン投与群(2152例)とプラセボ群(2152例)に振り分けた。
中央値2.4年間の観察で主要評価項目がeGFRの持続的な低下が少なくとも50%、末期腎疾患、または腎臓病または心血管系が原因の死亡とした。
主要アウトカムイベントは、ダパグリフロジン群では197例9.2%でプラセボ群では312例14.5%に発生し、ハザード比は0.56であった。心血管系の原因による死亡または心不全による入院の複合ハザード比は0.71であった。死亡はダパグリフロジン群で101例4.7%、プラセボ分では146例6.8%に発生し、ハザード比は0.69であった。
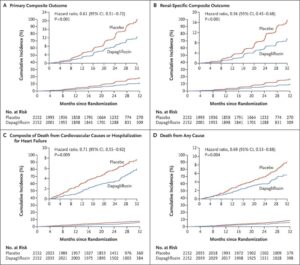
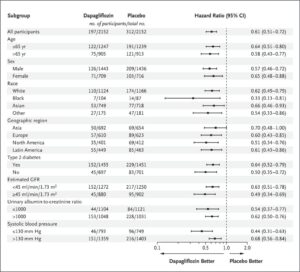
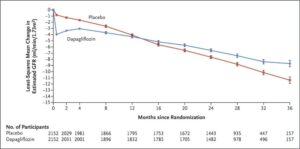
N Engl J Med. 2020 Oct 8;383(15):1436-1446.
https://www.nejm.org/doi/10.1056/NEJMoa2024816
CKDの臨床試験ではESKDの発症や腎代償療法の開始などの臨床的事象とeGFRの持続的な大幅な減少(例:≧50%)を含む複合エンドポイントがよく使用されている。このようなイベントは通常、疾患の後半に発生するため、ほとんどの参加者が臨床イベントに関与しない大規模な試験を行うことになっている。さらに、エンドポイントのコンポーネントは同等に重要であると見なされているが、それらの臨床的意義は異なっている。実際腎代償療法の開始は、eGFR≧50%の低下よりも臨床的に意義がある可能性が高い。対照的に、階層型複合エンドポイント(Hierarchical composite end point:HCEs)は、複数のアウトカムを組み合わせ、各患者の最も臨床的に関連性のあるアウトカムを解析に含めるために優先順位をつける。
eGFRの経時的な変化(スロープ)は、すべての参加者でデータがとられており、ESKDへの振興の有効な代理エンドポイントであることは実証されているが、eGFRの経時的な分析では、死亡や腎不全の発症などの臨床事象は考慮されておらず、eGFRを評価する際には、通常、これらの事象の後に欠落している、または情報のないeGFRデータの保管が必要である。
従来の複合エンドポイントとは異なり、HCEは、臨床的意義にしたがってコンポーネントをランク付けする。
HCEは、固定のフローアップ期間で評価し、順序エンドポイントの導出にコンポーネントの優先順位付けをする。
HCEは、心血管死亡のリスク低減、心不全入院の負担軽減、心不全に伴う症状の改善という治療目標に対応するアウトカムを組み合わせるために、心不全試験に端を発している。
HCEは、有害な結果(悪化)と好ましい結果(改善)の療法が含まれる可能性がある。したがって、治療が予防しようとする臨床的に重篤なアウトカムのみを含むエンドポイントとは異なり、HCEには患者の臨床状態の改善を示すアウトカムが含まれる場合がある。例えば、2019年にコロナウイルス病で入院した心血管代謝リスク因子を有する患者を対象としたダパグリフロジン(DARE-19)試験では、HCEを使用して、2019年にコロナウイルス病で入院した患者におけるダパグリフロジンによる治療の効果を30日間評価した。DARE-19研究のHCEには、参加者の臨床状態の悪化(死亡や院内臓器機能障害など)と改善(退院など)の療法を表すイベントが含まれていた。
したがって、HEの使用は実現可能であり、様々な疾患環境で効率的で有益な試験デザインを可能にすることが実証されており、HCEはCKD試験の潜在的な選択肢となる。
順序ロジスティック回帰や勝率統計(win ratio, win odds, or net benefit)等によりHCEは分析される。
Win統計は、治療グループ間の勝ち数、敗北数、場合によっては同点の数を比較する。HCEの構成要素は臨床的重要性に従ってランク付けされ、各参加者はタイミングに関係なく、最も臨床的に重要なイベントに従って分析される(例えば、CKD試験の参加者が、ESKDの発症を経験し、後にCD死亡となった症例では、ESKDがはじめに発生していても、死亡として分析される)。対照群と比較した能動的治療の治療効果を評価するために、能動群に割りあれられた各患者を対照群の各患者と個別に比較する。各比較の結果は、能動群の「価値」、「負け」、または「引き分け」に分類される。追跡期間が固定されている場合、能動群の参加者が対照群の参加者よりも深刻でないイベント(タイミングに関係なく)を経験した場合、または両方の参加者が同じイベントを経験したが、能動群の参加者がより長い時間後にイベントを経験した場合に、能動群の「勝利」とする。
上段:対照群の参加者(A)がより臨床的に重篤な事象(死亡●)を経験したため能動的治療群の「勝利」。
中段:両方の参加者が同じイベント(ESKD◆)イベントを経験したが、対照群の参加者(A)はイベントをより早く経験したため、能動的治療群の「勝利」。
下段:どちらの参加者ともイベントを経験していないため、参加者のeGFRスロープの比較によって「勝ち」または「負け」が宣言される。

「勝ち」、「負け」、「引き分け」の合計数は、勝ちオッズの計算に使用され、対照群と比較して、能動的治療群よりよい結果が得られるオッズを表す。
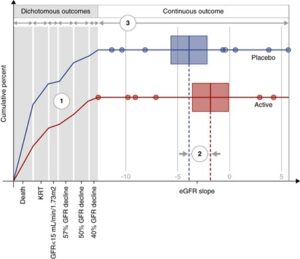
概念的なマラカスプロット:
HCEを使用した能動的な治療(赤)とプラセボ治療(青)の視覚化した図で、6つの二分結果(灰色の背景)と連続的なeGFRスロープ結果(白い背景)がある。
数字は、視覚化から3つの主要な読みだしを示している。
- 個々の二分成分と組み合わせた二分成分の結果に対する治療効果
- 連続部分に対する処理効果
- 全人口における結果の割合
各コンポーネントでは、HEに寄与するコンポーネントに対する処理効果を参照しており、コンポーネントに対する個別の処理効果ではなく、コンポーネントに対する処理効果を参照していることに注意することが重要である。
HCEを使用して試験を設計する際には、いくつかの要素を考慮する必要がある。
まず、分析方法では、すべての患者に対して固定の追跡期間を使用し、共通の時間枠に基づいて患者を比較できるようにする必要がある。
患者の追跡期間が異なると、患者の比較は非推移的になり、その結果、逆説的な結論が導き出され、結果の臨床的解釈が困難になる可能性がある。
A対Bの比較ではESKDでBが「勝つ」が、Bが死亡した時点では、Aは生存しているのでAが「勝つ」ことになるが、追跡調査が不完全であるため、その結論は失われる。
B対C、B対A、C対Aの比較で、死亡で見ればCがBに「勝つ」、ESKDで見ればBがAに「勝つ」し、AがCに「勝つ」ことになり非論理的に見える。
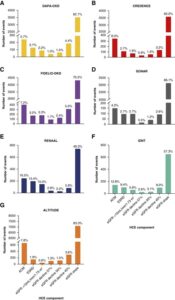
J Am Soc Neph 34 1928-1935, 2023.
CKD患者におけるカナグリフロジン、ダパグリフロジン、フィネレノン、アトラセンタン、ロサルタン、イルベサルタン、アリスキレンの効果を評価した7つの主要な第3相プラセボ対照試験の事後解析を行い、腎臓病の進行に対する新しいHCEを開発および検証した。

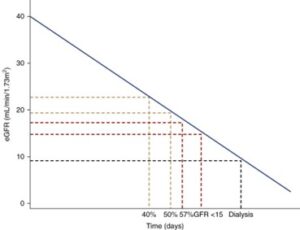
CKDの新たな治療法の開発を目指す臨床試験では、従来、血清クレアチニンが2倍、eGFRが57%の低下などの腎機能の大幅な低下を複合エンドポイント都として用いてきた。これらのエンドポイントは、10年から20年の長期経過の後に発生することが多く、臨床試験には適していない。より小さなサンプルサイズとより短い期間で臨床試験の実施を容易にする代理エンドポイントを開発した。
A:DAPA-CKDトライアル、B:クレデンストライアル、C:FIDELIO-DKDトライアル、D:ソナートライアル、E:RENAALトライアル、F:IDNTトライアル、G:ALTITUDEトライアルにおけるHCEの複合腎臓エンドポイントの個々のコンポーネントの数を示す。
- All-cause mortality
- Kidney transplantation
- Sustained GFR<15ml/min per 1.73m2 for at least 28 days
- Sustained GFR decline form baseline for at least 28 days of 57%
- Sustained GFR decline form baseline for at least 28 days of 50%
- Sustained GFR decline form baseline for at least 28 days of 40%
- eGFR slope
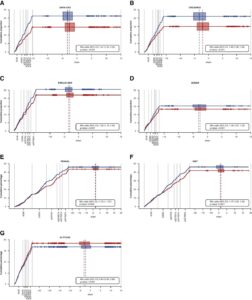
A:DAPA-CKDトライアル、B:クレデンストライアル、C:FIDELIO-DKDトライアル、D:ソナートライアル、E:RENAALトライアル、F:IDNTトライアル、G:ALTITUDEトライアルにおけるMaracaプロットを示す。
Maracaプロットは、複数のイベント発生までの時間の結果と一つの連続した結果を組み合わせたHCEを視覚化したものである。
積極的治療の有効性を示さなかったG:ALTITUDE試験を除いて、すべての試験でプラセボ群と比較して、能動的治療群の二値アウトカムが少ないことを示している。
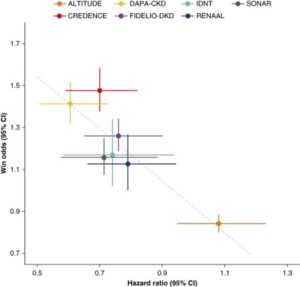
HCEを元の原発性腎臓試験のエンドポイントと比較すると、治療効果の推定値に同様の情お香と大きさが観察される。
DPAP-CKDでは、GFR低下の持続50%、腎不全、または腎死の主要アウトカムのHRは0.60で、HCEのWOは1.41であった。FIDELIO-DKDトライアルでは40%GFR低下、腎不全、腎死の主要アウトカムのHRは0.82、WOは1.26であった。
共有のフォローアップアプローチによるWOは、主要な解析と比較して同様の結果を示している。

一次腎臓エンドポイントとHCEに関する治療推定値の散布図。
臨床試験のブートストラップリサンプリングを使用して、元の原発性腎臓エンドポイントとGFRの傾きを使用して、各エンドポイントで観察された治療効果を検出するための新規HCEのサンプルサイズ要件と統計的検出力を比較した。リサンプリング手順では、各サンプルサイズ(ん=200,500,500-3000まで増加)で1000回の反復を使用した。全死因死亡率をHCから除外した場合、HCEを使用したサンプルサイズ要件は、すべての試験で元の腎臓エンドポイントの要件よりも小さかった。

HCEを使用すると、従来の最初のイベントまでの時間解析と比較して、統計的検出力が向上した。新たに定義された階層型複合腎臓エンドポイントは、臨床的に影響力のある結果を優先し、すべてのレベルでの疾患の進行に関する情報をより効果的に組み込んでいるため、従来のCKDエンドポイントよりも治療効果の検出感度が高いようだ。
Journal of the American Society of Nephrology 34(12):p 2025-2038, December 2023.
EMPA-KIDNEY試験は中央落ち2.0年の追跡期間にエンパレグフロジン群3304例中432例13.1%、プラセボ群3304例中558例16.9%に腎臓病の進行または心血管疾患による死亡が発生した(ハザード比0.72)。糖尿病の有無にかかわらず、およびeGFR範囲に従って定義されたサブグループ間で一致した有効性が示された。何らかの原因による入院率はプラセボ群よりもエンパグリフロジン群で有意に低かった(ハザード比0.86)。心不全による入院または心血管系の原因による死亡(エンパグリフロジン群で4.0%、プラセボ群で4.6%)、何らかの原因による死亡(エンパグリフロジン群で4.5%、プラセボ群で5.1%)の複合結果に関しては、群間で有意な差はなかった。
N Engl J Med 2023;388:117-127
https://www.nejm.org/doi/full/10.1056/NEJMoa2204233
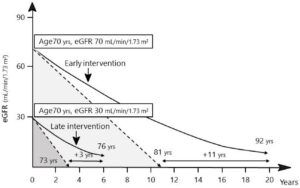
糖尿病性腎臓病DKDは、世界中の慢性腎臓病CKDおよび末期腎疾患の主な原因である。日本では、DKDによる透析を必要とする新規患者の割合は、過去5年間横ばいで推移している。DKDの進行を予防するためには、早期診断と治療が非常に重要である。アルブミン尿症は、DKDを診断し、その予後を早期に予測するために現在利用可能な最も有望なバイオマーカーである。しかし、DKDに対する得意度と感度は比較的低い。腫瘍壊死因子受容体(TNFR1および2)は、糖尿病の状態に関係なく、CKD患者の予後を予測するための代替手段である。心腎危険因子の管理とレニンアンジオテンシン系阻害薬の使用は、DKDの進行を遅らせるのに効果的であるが、DKD残留リスクは依然として高いままである。最近、DKDの侵攻を防ぐための心腎疾患修飾療法としてSGLT2そば医薬とGLP-A受容体作動薬が出現した。
Int J Mol Sci. 2022 Nov 9;23(22):13749
https://www.mdpi.com/1422-0067/23/22/13749
























