川村所長の勉強会参加記録
2024.09.24
心血管イベント・心不全抑制を考慮する糖尿病治療 SGLT2阻害薬 桑原宏一教授
2023年7月22日
演題「心血管イベント・心不全抑制を考慮する糖尿病治療―SGLT2阻害薬の意義―」
演者:信州大学医学部 循環器内科学教室教授 桑原宏一郎先生
場所: ホテルメルパルク横浜
内容及び補足「
肥満・内臓脂肪蓄積に伴って糖尿病は、高血圧や脂質異常症の合併が多く、網膜症・腎症・神経障害のみならず心血管疾患の重大な独立したリスクファクターである。しかし、ACCORD、ADVANCE、UKPDS、VADTの試験をメタ解析した結果では、主要心血管イベント、Stroke、心筋梗塞、入院や心不全の発症といった予後を比較した際に、厳格な血糖コントロールと従来の血糖コントロールでの有意な差は認められていない。
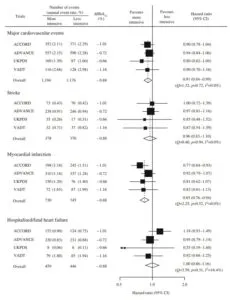
Diabetologia 2009 52 2285-98
file:///C:/Users/jeffbeck/Downloads/s00125-009-1470-0.pdf
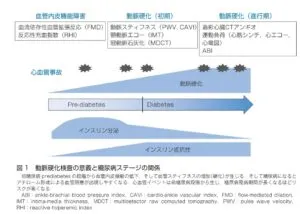
その理由として考えられることは、動脈硬化の進行形かと諸検査との関係(下図)を見てみると理解できる。インスリン抵抗性は糖尿病発症の10年以上前から認められているが、インスリン分泌亢進のため血糖値は正常範囲にあるので気付かれていないが、すでにこの段階で血管内皮機能が出現しており、動脈硬化の変化が出現している。その後インスリン分泌が低下してくると血糖値が上昇し、糖尿病が発症する。この前後で血管スティフネスが増加し、特に収縮期血圧が上昇する。その後罹病期間の経過とともにアテロームが形成され、心血管イベントリスクが上昇する。より早期の段階で治療介入しないと大血管障害の予防が困難であるといえる。
HbA1cの上昇とともに冠動脈イベントが増加するが、HbA1cが正常範囲内であっても心血管イベントが起きることと、糖尿病治療によりHbA1cを低下させても心血管イベントが必ずしも減少するとは限らないのが問題である。
脂質異常症(非空腹時高TG血症、低HDL-C血症)、LDL-C上昇、慢性腎臓病の進行(血清クレアチニン上昇、eGFR低下、尿中微量アルブミン量)が冠動脈イベントに関連する危険因子とされている。
糖尿病診療ガイドライン2016では、大血管症の非侵襲的スクリーニング検査として、頸動脈エコー、FMD、心エコー、負荷心電図、負荷心筋シンチ、冠動脈CTをあげているが、無症状の症例や心電図以上のない症例に実施することはコンセンサスが得られていないとしている。
過剰な検査を避けるために対象者を絞る必要がある。2型糖尿病患者の40歳未満あるいは罹患歴が短い患者であれば、心血管イベントリスクは低い(Wien Med Wochenschr. 2010 Jan;160(1-2):8-19
https://link.springer.com/article/10.1007/s10354-010-0748-7)。
40歳以上あるいは罹患歴10年以上の糖尿病患者、さらに高血圧、脂質異常症、慢性腎臓病などの併存症を有する患者は、スクリーニングの対象とすべきである。

糖代謝異常者における循環器病の診断・予防・治療に関するコンセンサスステートメント2020
https://www.j-circ.or.jp/cms/wp-content/uploads/2022/01/jcs_jds_statement_20220114.pdf
2型糖尿病において収縮期血圧を4mmHg低下、LDL-Cを1mmol/L低下、HbA1cを0.9%低下させると、それぞれ心血管イベントが12.5%、8.2%、2.9%低下する。
BMJ 2011;343:d4243
https://www.bmj.com/content/343/bmj.d4243
糖尿病患者では、非糖尿病患者に比べ高血圧の頻度が高く、高血圧を合併すると大血管疾患発症及び死亡のリスクが上昇する。また、糖尿病性細小血管障害のリスクも高血圧によって増大する。従って糖尿病患者における高血圧の管理・治療は極めて重要であり血圧が130/80mmHg以上で治療を開始するべきである。
糖代謝異常者における循環器病の診断・予防・治療に関するコンセンサスステートメント2020
https://www.j-circ.or.jp/cms/wp-content/uploads/2022/01/jcs_jds_statement_20220114.pdf
糖尿病における降圧薬の選択としては、微量アルブミン尿/蛋白尿を合併しているかどうかを判断する。合併している場合には、RAAS系阻害薬を最初に考慮する。合併していない場合には、RAAS系阻害薬に加え、Ca拮抗薬、少量のサイアザイド系利尿薬のいずれかの単剤を考慮する。
糖尿病患者においては心不全の合併が多く、Framingham研究では、糖尿病患者の心不全発症リスクは非糖尿病患者に比べ、男性で2倍、女性で5倍を超えるとされている。
ALLHAT試験で55歳以上の高リスク高血圧患者42418例において、サイアザイド系利尿薬がCa拮抗薬やACE阻害薬、α遮断薬よりも有効であることが示されたが、その後5年間治療を継続した後の長期にわたる効果でも差がないことが発表された。塩分感受性が高く塩分摂取量の多い日本人の高血圧治療としては心不全予防効果が高いと考える。
Current Opinion in Cardiology 25(4): 355-365 2010
糖尿病患者は高LDL-C血症、低HDL-C血症、高TG血症などの脂質異常症を合併しやすい。LDL-Cは糖尿病患者においても、大血管症の最も強いリスクファクターである。動脈硬化性疾患予防ガイドライン2022年版では、糖尿病があることで高リスク群に分類される。
高リスク群においてはLDL-C<120を目標とし、PAD、細小血管症(網膜症、腎症、神経障害)合併時、喫煙ありの場合にLDL-C<100を管理目標とするよう提唱している。
動脈硬化性疾患予防ガイドライン2022年版
https://www.j-athero.org/jp/wp-content/uploads/publications/pdf/GL2022_s/jas_gl2022_220808.pdf
高リスク群においては、LDL-Cはスタチン+エゼチミブといった併用でもよいので下げたほうが良い。
Atherosclerosis 2019 290 140-205
https://www.atherosclerosis-journal.com/article/S0021-9150(19)31459-5/fulltext
欧米においては心筋梗塞の発生率は減少している。35歳以上のカリフォルニア在住の人で2000年~2014年の間の18630776人年観察した研究では、急性心筋梗塞は48.7%、非ST上昇型心筋梗塞は34.2%、ST上昇型心筋梗塞は69.8%減少した。
J Am Heart Assoc. 2020 9: e013542
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7335574/
日本においてはどうかとみてみると、循環器疾患診療実態調査報告書(JROAD:The Japanese Registry Of All cardiac and vascular Diseases)の2020年の報告を見ると増加しているとは言えないが、決して減少しているとは言えない状況にある。
https://www.j-circ.or.jp/jittai_chosa/media/jittai_chosa2019web.pdf
2022年版の糖尿病治療のエッセンスでは、糖尿病患者の血糖コントロール改善・治療調節において目標別にHbA1c値を定め、低血糖を起こさあに様に管理するのが望ましいとしている。
https://www.med.or.jp/dl-med/tounyoubyou/essence2022.pdf
18歳以上のeGFR≧30ml/min/1.73m2、HbA1c≧7.0%の糖尿病患者にempagliflozin10㎎投与2345症例、20㎎投与2342例、プラセボ群2333例で治療機関中央値2.6年、追跡期間中央値3.1年でのEMPAREG-OUTCOME試験において、プラセボ群に比べ、empagliflozin群では心血管疾患による死亡が38%低下しただけでなく、全死亡においても32%リスク低下が認められた。しかも入院や心不全発症も35%低下させたことは画期的な試験であった。
N Engl J Med 2015; 373:2117-2128
https://www.nejm.org/doi/full/10.1056/nejmoa1504720
日本のKCHF Registry研究では、心不全患者のうち37%に糖尿病が合併していた。
Circulation J 2018 82 2811-2819
https://www.jstage.jst.go.jp/article/circj/82/11/82_CJ-17-1386/_pdf/-char/en
1998年~2014年に糖尿病と診断された患者の旧青函症候群、すせいみゃく、心不全、Strokeの発生頻度を見てみると、急性冠症候群と心不全は男女ともに低下した。
Diabetes Care 2018 41 293-302
2型糖尿病患者1177896名のうち心血管疾患や腎疾患(Cardiovascular or Renal disease:CVRD)を有していない772336(66%)例を平均4.5年観察した。合計137081(18%)例がCVRDに進展した。CKD36%、HF24%、Stroke16%、MI14%、PAD10%であった。国別にみてもCVRDがダントツに多かった(日本はStrokeが他国よりも多かった)。
Diabetes, Obesity and MetabolismVolume 22, Issue 9 p. 1607-1618
https://dom-pubs.onlinelibrary.wiley.com/doi/10.1111/dom.14074
3717例(平均77.7歳、男性55.1%)の心不全患者をHFrEF 1383(37.2%)、HFmrEF 703例(18.9%)、HFpEF 1631例(43.9%)に分け、死亡や入院を検討した。3群間に死亡原因の差は認めなかった。
全死亡や心血管死、突然死で見ても観察期間中3群間に有意な差は認めなかった。
JAMA 2020 3(5) e204296
https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2765656
調査開始時には糖尿病患者1131例(11.8%)に対して、糖尿病がない患者では435例(4.5%)に心不全を認めた。
観察期間中において、心不全がない糖尿病患者の650例(8460例中7.7%)に心不全を認めたが糖尿病がない症例においては314例(9156例中3.4%)と有意な差を認めた。
Prevalence and incidence rates of CHF per 1000 people
Diabetes Care 2001 24 1614-1691
https://diabetesjournals.org/care/article/24/9/1614/21484/Congestive-Heart-Failure-in-Type-2
糖尿病患者のHbA1c地に応じて心不全の危険度を見てみると右肩上がりで上昇している。HbA1cが1%上昇すると心不全が16%上昇する計算となる。
Lancet 2015 May 23;385(9982):2107-17
https://pubmed.ncbi.nlm.nih.gov/26009231/
BMJ 2000 Aug 12;321(7258):405-12
https://pubmed.ncbi.nlm.nih.gov/10938048/
糖尿病のコントロールが悪ければ心不全患者は増加するが、治療によりコントロールが良くなれば心不全患者は減るのだろうか?
14件のトライアルデータの95502例を検討すると3907例(4%)に心不全が出現した。HbA1cを0.5%低下させると1.7㎏体重が増加し、心不全発症リスクも1.14倍増加するという結果になった。
おそらくチアゾリジン投与と一部の心不全を増加するといわれているDPP-4阻害薬の影響と考えられる。
Lancet Diabetes endocrinology 2015 3 356-66
https://www.thelancet.com/journals/landia/article/PIIS2213-8587(15)00044-3/fulltext
EMPAREG-OUTCOME、CANVAS program、DECLEAR-TIMI研究の3私見34322例の検討ではSGLT2阻害薬による糖尿病治療では、心血管死亡リスクや心不全による入院を23%減少させた。
Lancet. 2019 Jan 5;393(10166):31-39
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(18)32590-X/fulltext
心不全治療でエビデンスが確立しているACEI、ARB、β遮断薬の効果について、糖尿病を合併する心不全症例のみを対象として評価した臨床試験はいまだ報告されていない。
慢性心不全の急性増悪を含む心不全予防を考慮した糖尿病治療として、生活習慣改善と危険因子に対する包括的介入に加え、ステージC・Ⅾ症候性心不全やステージBの潜在的な心不全高リスク群(BNPやNT-proBNPの上昇、心筋梗塞既往、eGFR 30ml/min/1,73m2未満を除く慢性腎臓病など)に対しては、SGLT2阻害薬の使用を推奨する。
利尿薬併用時には脱水予防のため、適宜利尿薬の容量調節を検討する。
糖代謝異常者における循環器病の診断・予防・治療に関するコンセンサスステートメント2020
https://www.j-circ.or.jp/cms/wp-content/uploads/2022/01/jcs_jds_statement_20220114.pdf
そこで重要になってくるのは心不全の早期発見になる。
最初に行うスクリーニング検査は、BNPあるいはNT-proBNPの測定である。
BNP≧40pg/mLあるいはNT-proBNP≧125mg/dLであれば心不全の可能性がある。
BNP≧100pg/mLあるいはNT-proBNP≧400mg/dLであれば治療大量となる心不全の可能性が高く、心不全症状がなくても、循環器内科医にコンサルとすべきである。
糖代謝異常者における循環器病の診断・予防・治療に関するコンセンサスステートメント2020
https://www.j-circ.or.jp/cms/wp-content/uploads/2022/01/jcs_jds_statement_20220114.pdf
300例の2型糖尿病患者でNT-proBNPが上昇しているが、心疾患の罹患歴がない患者を糖尿病外来のみの群(control group)と、循環器医とともに外来で診療する群(intensified group)の予後に差が出るかを見たPONTIAC(NT-proBNP Selected PreventiOn of cardiac events in a population of dIabetic patients without A historu of Cardiac disease):A prospective randomaized controlled試験が行われた。
12ヶ月後の時点で、両群間と治療薬としてRAAS阻害薬、β遮断薬で治療された患者数に有意さがあった。1年後の状態では、両群とも有意に血圧は低下したが値には差はなかったが、心拍数は循環器医が併進した群で飲み低下していた。1年後のNT-proBNPの濃度には差がなかった。死亡例はintensified group 3例とcontrol group 5例であったが入院においては有意な差を認めた。
JACC 2013 62 1365-72
https://www.sciencedirect.com/science/article/pii/S0735109713025175?via%3Dihub
Diabetes Care 2022 45 1670-90
2型糖尿病患者の患者でempagliflozin投与群4124例中525例(12.7%)が、プラセボ群2061例中388例(18.8%)にNeohropathyの増悪が認められた。血清クレアチニン値の倍加はempagliflozin群では4645例中13例(1.5%)、プラセボ群2323例中60例(2.6%)にみられ、44%のrisk reductionが見られた。腎代替療法はempagliflozin群では4687例中13例(0.3%)、プラセボ群2333例中14例(0.6%)にみられ、55%のrisk reductionが見られた。
SGLT2阻害薬の投与は2型糖尿病患者の腎イベントを減少させることが示された。
N Engl J Med 2016; 375:323-334
https://www.nejm.org/doi/10.1056/NEJMoa1515920
CREDENCE試験:アルブミン尿を有するCKDを伴る2型糖尿病患者4401例(平均63歳、女性33.9%、HbA1c 8.3%、eGFR 56.2 ml/min/1.73m2、尿中アルブミン・クレアチニン比927mg/g)
Canagliflozin群ではプラセボ群に比べ、複合アルト間の相対リスクは34%減少、心血管死、心筋梗塞、または脳卒中の複合発生リスクはHR0.80、心不全による入院リスクはHR0.61に減少した。
N Engl J Med 2019; 380:2295-2306
https://www.nejm.org/doi/10.1056/NEJMoa1811744
34カ国4401例で検討されたCREDENCE試験では、3point MACEでは20%の減少を、心不全などの入院を26%減少させた。
Circulation 2019 140 739-750
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6727954/
DAPA-CKD:ステージ2~4のCKD患者4304例(18歳以上、糖尿病合併例67%)で2.4年間(中央値)経過観察した。Dapagliflozin10㎎投与群2152例中197例(9.2%)にプラセボ群2152例中312例(14.5%)にプライマリエンドポイント(eGFRの倍加、慢性透析の適応、腎移植)が発生し、HR0.61の抑制効果が見られた。Dapagliflozin群の死亡は101例(4.7%)、プラセボ群では146例(6.8%)で、HR0.69と抑制効果が見られた。この効果は2型糖尿病のあるなしで有意な差を認めなかった。
NEJM 2020 383 1436-46
https://www.nejm.org/doi/full/10.1056/NEJMoa2024816
EMPA-Kidney
eGFRが20~45 ml/min/1.73m2、または45 ml/min/1.73m2未満で尿アルブミンが200mg/gCr以上の状態にあるCKD患者を8カ国6609例(平均63.8歳、女性33%、微量アルブミン尿28%、県政アルブミン尿52%、糖尿病合併46%、心血管疾患の既往27%)を2.0年(中央値)追跡調査した。
Empagliflozin群では3304例中432例(13.1%)にプラセボ群では3305例中558例(16.9%)に腎疾患の進行や心血管死が見られ、empagliflozin投与によるHRは0.72であった。
N Engl J Med 2023; 388:117-127
https://www.nejm.org/doi/full/10.1056/NEJMoa2204233
メタ解析の結果SGLT2阻害薬は2型糖尿病の心血管及び腎臓の一次、二次予防効果があることが認められた。
Lancet. 2019;393:3-5
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(18)32824-1/fulltext
個人的には一時及び二次予防の間に顕性アルブミン尿の状態を入れたいと考える。
日本人の糖尿病患者をスクリーニング期間をおいて24週間、プラセボ群、Tofogliflozin 10㎎、Tofogliflozin 20㎎、Tofogliflozin40㎎投与を行った。
最終的データ解析を行った症例は、それぞれの群で56例、57例、58例、58例であった。
HbA1cは24週間後に、-0.028%、-0.797%、-1.017%、-0.870%であった。
体重の減少は2.23~2.97㎏でTofogliflozinにみられる体重原料と同じ程度であった。
空腹時血糖値は、ベースラインの血糖値が高いほど低下した。
Cardiovasc Diabetol. 2014 Mar 28;13:65
https://cardiab.biomedcentral.com/articles/10.1186/1475-2840-13-65
ADA診療ガイドラインの2023年版を見てみると、血糖・体重管理の目標達成と維持が目標である場合にはメトホルミンが第一選択といまだになっているが、心・腎ハイリスク者のリスク低減を目標にする場合にはもはやメトホルミンではなく、SGLT2阻害薬かGLP-1作動薬が第一選択にあげられるようになった。
https://static.m3.com/clinical/news/2023/specialist/noto/v61_1.jpg
Diabetes Care 2023;46(Suppl. 1):S140–S157
Effect of Tofogliflozin on UACR Compared to Metformin Hydrochloride in Diabetic Kidney Disease (TRUTH-DKD)
メトホルミンとSGLT2阻害薬の比較試験は世界で発表されていない。欧米においては、2型糖尿病といえば、メトホルミンという感じでほとんどの人に投与されているので比較試験ができない。
しかし、日本においては、糖尿病専門医以外はメトホルミンをそれほど投与していない現状がある。そこで、メトホルミンとTofogliflozinの比較試験をDKD症例において行うTRUTH-DKDを企画している。120例ほどをエントリーする予定である。
https://classic.clinicaltrials.gov/ct2/show/NCT05469659
Tofogliflozinは血中半減期が5.4時間とSGLT2阻害薬の中では短く、夜間排泄量が少ないことが報告されている。
DAPA-HF(Dapagliflozin And Prevention of Adverse-outcomes in Headt Failure)試験は、2型糖尿病合併の有無に関わらず。左室駆出率が低下した(LVEF≦40%)心不全患者4744例を対象にDapagliflozin10㎎を心不全標準治療に追加投与した場合の効果を18.2か月(中央値)追跡し、プラセボと比較した試験である。
心不全の増悪や心血管死であるプライマリーエンドポイントはDapagliflozin群で386例(16.3%)に、プラセボ群では502例(21.2%)にミラ江26%のリスク減少が見られた。心不全による入院はDapagliflozin群で231例(9.7%)に対し、プラセボ群では318例(13.4%)で30%のリスク減少が見られた。
NEJM 2019 381 1995-2008
https://www.nejm.org/doi/full/10.1056/NEJMoa1911303
EMPEROR-Reduce試験
EF<40%のHFrEF3730例(平均年齢67歳、虚血性心不全51%、糖尿病50%、Af36%、平均eGFR 62)でEmpaglifrozin 10㎎とプラセボで16か月(中央値)の経過観察を行った。
心不全悪化による入院と死亡は25%低下した。
NEJM 2020 383 1413-1424
https://www.nejm.org/doi/10.1056/NEJMoa2022190
DAPA-HFとEMPEROR-Reduce試験を合わせた解析をした。
8474例の患者のうち推定治療効果は、全死因死亡の13%、心血管死の14%減少が見込まれる。心血管死と心不全の入院は26%減少、心不全の繰り返しの入院と心血管死は25%減少となった。
Lancet. 2020 Sep 19;396(10254):819-829.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31824-9/fulltext
HFrEFの治療に関しては、ARNI,βブロッカー、MRA、SGLT2阻害薬の併用を行うことが推奨された。
https://openheart.bmj.com/content/8/1/e001585
残された課題はHFpEF、HFmrEFの治療ということになる。
EMPEROR-Preserved試験:LVEFが保たれた慢性心不全患者5988例を対象とした国際共同第三相試験である。LVEF≧40%で慢性心不全(NT-proBNP>300pg/mlまたは心房細動か心房粗動を合併する場合には>900pg/ml)の患者を対象にempagliflozin10㎎の投与した際の心血管死及び心不全による入院リスクに対する有効性をプラセボと比較した試験である。プラセボ群に比較してempagliflozin1群では有意に21%リスクを軽減した。
N Engl J Med 2021; 385:1451-1461
https://www.nejm.org/doi/full/10.1056/NEJMoa2107038
DELIVER試験
40歳以上のLVEF≧40%の安定した慢性心不全患者にDapagliflozin10㎎の投与が、心血管死や心不全悪化による入院を18%減らす結果となった。
N Engl J Med 2022;387:1089-98.
https://www.nejm.org/doi/pdf/10.1056/NEJMoa2206286
Lancet. 2022 Sep 3;400(10354):757-767.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(22)01429-5/fulltext
2023年のACC Expert Consensus Decision Pathway on Management of Heart Failure With Preserved Ejection FractionにおいてHFpEFにおいてはSGLT2阻害薬が推奨されている。
J AM coll cardiol 2023 81 1835-78
https://www.jacc.org/doi/full/10.1016/j.jacc.2023.03.393
急性心不全で入退院後、GDMT:Guideline-directed medical therapyの早期漸増と頻回のフォローアップによる強化治療群は通常治療群と比較して、症状の軽減、QOL改善、および180日以内の全死因死亡+心不全再入院リスクの減少をもたらした。
Lancet. 2022; 400:1938–1952
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(22)02076-1/fulltext
入院中及び退院後早期の経口治療薬(RAS阻害薬、βブロッカー、MRA,SGLT2阻害薬)の迅速な併用療法により、LVEFとは無関係に急性心不全入院後の180日以内の死亡と心不全の再入院を減少させる。
J Am Coll Cardiol. 2023 Jun, 81 (22) 2131–2144
https://www.jacc.org/doi/10.1016/j.jacc.2023.03.426
1222例の2型糖尿病患者の心不全増悪により入院した症例に対してSotagliflozinの投与群608例とプラセボ群614例を9.0か月(中央値)で追跡したところ、心血管死と心不全による再入院は、51.0検体76.3件で33%リスクを軽減した。
N Engl J Med 2021; 384:117-128
https://www.nejm.org/doi/full/10.1056/NEJMoa2030183
SGLT2阻害薬が慢性心不全患者の心血管死または心不全入院リスクを軽減することは多くの研究結果で示されているが、急性心不全で入院した患者の臨床転帰を改善するかはまだ示されていない。
EMPULISE trialでは、臨床転帰をWin ratio法(各軍の患者の状態をこのエンドポイント順で比較し、エンドポイントに先に達したほうが負けとして勝率を比較する手法)を用いて評価した。
2020年6月から2021年2月までに日本を含む15カ国118施設において合計566人がエントリーされた。急性心不全で入院した患者に対して、心不全が安定した入院後少なくとも24時間後遅くとも5日以内に、empagliflozin10㎎を投与された265例と、プラセボ群265例を最大90日間治療した。
治療薬の早期中止は、empagliflozin群で114例(21.8%)、プラセボ群で62例(23.5%)、全死亡は、empagliflozin群で11例(4.2%)、プラセボ群で22例(8.3%)で発生した。Win ratio法による階層的な複合評価項目は、53.9%がempagliflozin群で優れており、39.7%がプラセボ群で優れているという評価となった。Empagliflozin群の勝率は1.36となり、empagliflozinの投与により臨床的ベネフィットを得られる確率はプラセボ投与よりも36%有意に高いという結果になった。
Nature Medicine volume 28, pages568–574 (2022)
https://www.nature.com/articles/s41591-021-01659-1
file:///C:/Users/jeffbeck/Downloads/s41591-021-01659-1.pdf
SGLT2阻害薬の術前の休薬期間については、糖尿病がある症例では術前3日間の休薬を、糖尿病なない症例では術前絶食となった前日から投与中止とした。
参:Radclife Cardiology:Sodium–Glucose Co-transporter 2 Inhibitors in Heart Failure: Recent Data and Implications for Practice
























