クリニックからのお知らせ
2025.03.02
心原性脳塞栓症を防ぐ PFA 田中泰章先生
2025年1月31日
演題「 ~パルスフィールドアブレーションが変える心房細動治療~」
演者:横須賀共済病院 循環器センター内科部長 田中泰章 先生
場所: Hotel Plumm
内容及び補足「
左心耳は盲端となっており、櫛状筋が張り巡らされている。
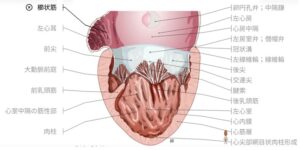
https://www.imaios.com/jp/e-anatomy/1/4?mic=coeur-illustrations&afi=28&is=4056&il=jp&l=ja_JP&ul=true
経胸壁または経食道心エコーで左心耳内に血栓が確認される。
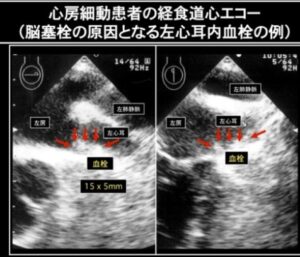
https://haku-ai.or.jp/shinryoka/fuseimyaku/
心原性血栓性脳梗塞の原因疾患を早期に診断し、適切な抗凝固療法を行い、合わせて原因疾患を治療することが必要である。
原因疾患としては、狭心症、心筋梗塞、心原性脳梗塞以外の脳梗塞、TIA、冠動脈バイパス術(CABG)後、経皮経肝冠動脈形成術(PTCA)後、川崎病などがある。
どの薬を使うかを決めるためには、どのタイプの脳卒中であるかの正確な診断が必要である。
検査としては、MRI、カテーテルによる脳血管造影、ホルター心電図、経食道心エコー、心エコー検査、埋め込み型心電図(ICM:insertable cardiac monitor)等の検査が有用である。
しかし、心房細動の52%は症状がないという報告もあり、健診などで偶然発見される症例も少なくない。
携帯型心電計も進歩している。
携帯型心電計 HCG-8060T


https://www.healthcare.omron.co.jp/medical/products/HCG-8060T/index.html
近年では埋め込み型のループレコーダーや貼るタイプでも長時間記録心電図レコーダが開発されている。
eMEMO WR-100
https://www.fukuda.co.jp/medical/new_recommend/wr_100.html
Lotus Heart
Heartnote
https://www.jsr.co.jp/products/ecg/heartnote.html
それ以外にも強力な診断ツールとして家庭用医療機器として厚生労働省より認可を取得した腕時計型ウエアラブルデバイスである医療機器認定スマートウォッチがある。
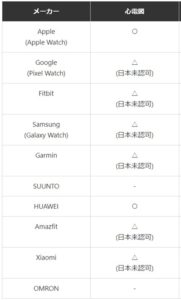
https://tokemee.xsrv.jp/medicaldevice-smartwatch/
参:令和5年3月16日 令和4年度第2回医療機器・再生医療籐製品安全対策部会 資料1-7
医療機器認定スマートウォッチの測定結果は、他の家庭用医療機器同様に病院の医師の確定診断に代わるものではありません。何らかの病気の兆候を示す測定結果が出た場合でも、病気を確定するためには病院を受診して再度検査を実施し医師による診断を受ける必要があります。
https://www.mhlw.go.jp/content/11121000/001071709.pdf
1週間入院してもらい心電図で心房細動が記録された症例を検討した研究では、入院初日の発症記録が一番多く、4日目以降は減少している。
![]()
参:
カナダで行われた前向き試験CARAFでは、初めて診断された心房細動899例が平均4.1年間経過観察された、発症後1年以内に約50%の例で再発が見られたが、残し50%には再発は見られなかった。観察期間中に6~7%の症例が脳梗塞を発症した。
我が国の平均14年にわたる長期観察データでは、発作性心房細動を主にⅠ軍港不整脈薬で治療した場合、1年あたり平均5.5%は治療抵抗性を示し、持続性心房細動に移行した。
我が国における単一施設研究で289例の初めて診断された心房細動患者を自覚症状をCCS-SAFスケールとEHRAスコアで調査した報告では、約40%の患者が無症候であった。
Fushimi AF registryのサブ会席では、心房細動患者3749例中1971例52.6%ガム症候であった。無症候であった因子として、75歳以上の年齢、脳卒中/全身性塞栓症の既往、男性、慢性腎臓病が抽出された。
2020年改訂版 不整脈薬物治療ガイドライン(2023年10月13日更新)
https://www.j-circ.or.jp/cms/wp-content/uploads/2020/01/JCS2020_Ono.pdf
心房細動脳有病率は、年齢だけでなく、性別、人種、高血圧、心不全、冠動脈疾患、心臓弁膜症、肥満、糖尿病、慢性腎臓病、社会経済的要因などの状態により異なるが、年々増加傾向にある。コミュニティベースのフラミンガム研究では、1958~67年と1998~2007年の間に、年齢調節された心房細動の有病率は男性で1000人年あたり20.4人から96.2人へ、女性でも13.7人から49.4人へと4倍に増加したと報告されている。
我が国でも2003年の定期健診の成績から心房細動有病率は男女とも加齢とともに増加し、70歳代では男性3.44%、女性1.12%、80歳以上では男性4.463%、女性2.19%であった。2005年時点では71.6万人が心房細動を有すると推定され、2050年には103万人、総人口の約1.1%を占めると予測されている。
https://www.j-circ.or.jp/cms/wp-content/uploads/2020/01/JCS2020_Ono.pdf
ワルファリン
1920年代のアメリカ中西部の酪農農家で飼っている牛が出血多量により死亡する奇病がはやった。スイートクローバーと呼ばれる牧草に原因があり、カビが生えたスイートクローバーを牛に与えると病気になることがわかった。この原因物質は「ジクマロール」と名付けられ、これを元にネズミの駆除剤が開発され「ワルファリン」と名付けられた。1954年に医薬品として認証され「クマジン」という販売名で売られた。
ワルファリンの投与で脳梗塞は減少した。
2020年の不整脈薬物治療ガイドラインでは、非弁膜症性心房細動の治療薬として、憩室からの出血を繰り返すような症例などに対しては、ワルファリンからDOACに推奨が変更されるようになった。
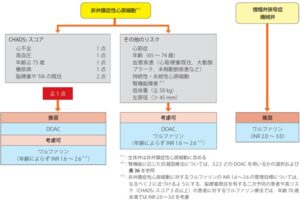
ワルファリンの他に4種類のDOACが現在投与可能である。
用法・用量は以下の表のようになっている。
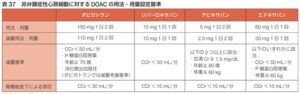
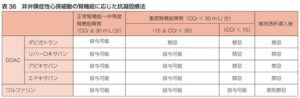
参:凝固検査への反応や、CKD患者に対する適応は以下の表の通りである。

ELDERCARE-AF Trialは既存の経口抗凝固剤の認証用法・用量での投与が困難と判断された80歳以上の非弁膜症性心房細動を対照として、エドキサバン15mg1日1回経口投与の有効性および安全性を検証した試験である。
脳卒中/全身性塞栓症(SSE)はエドキサバン群が15例(2.3%/人・年)、プラセボ群が44例(6.7%/人・年)でHR 0.34とP<0.001と有意に抑制した。
安全性は、エドキサバン群で20例(3.3%/人・年)、プラセボ群で11例(1.8%/人・年)に発生し、HRは1.87であった。大出血の中で、頭蓋内出血はそれぞれ2例、4例で差は認めなかったが、消化管出血は14例、5例とエドキサバン群で多かった。
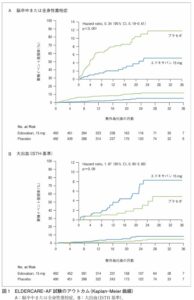
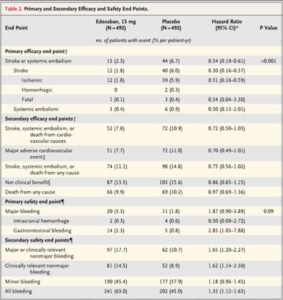
NEJM 2020 383 1735-1745
https://www.nejm.org/doi/full/10.1056/NEJMoa2012883
心房細動の治療:
心房細動は進行すると発作性から持続性へ移行し、茶房系も拡大し、アブレーション成績も悪化するため、適応のある症例はタイミングを逃さずアブレーションを積極的に考慮する必要がある。
薬剤抵抗性の症候性発作性心房細動はじきを逸することなくカテーテルアブレーションを行うことが推奨されている。
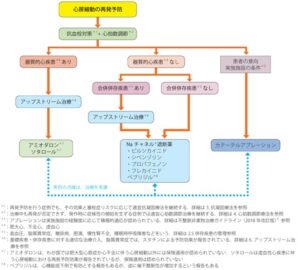
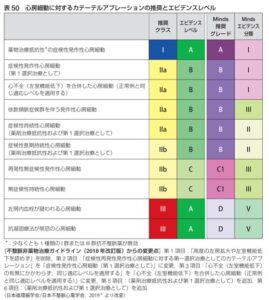
低心機能の心不全患者において、薬物治療とカテーテルアブレーションの有効性を比較したRCTはこれまでに5つ報告されており、それらのうち4つを含めためた解析も発表されている。
そのメタ解析では、224例の患者(82.5%が持続性心房細動)がカテーテルアブレーション群と心拍数調節群にランダム化された。カテーテルアブレーション群では、心拍数調節群と比較して、左室駆出率が平均8.5%上昇し、QOLの改善や最大酸素消費量なども上昇した。また重大有害事象の発生率には両群間で有意差を認めなかった。
CASTLE-AF試験:心房細動を合併した心不全患者の予後に与える影響をカテーテルアブレーション179例と薬物治療群184例で比較したランダム化比較試験
3年間の追跡期間で、心房細動を合併した心不全例において、アブレーションによる同調率維持は薬物治療に比べ、洞調率維持、心機能改善(心不全の悪化による入院37例vs66例)、生命予後(24例vs46例)に優れていることが示された。

NEJM 2018 378 417-427
https://www.nejm.org/doi/full/10.1056/NEJMoa1707855
カテーテルアブレーション治療は1980年代前半に始まり、1990年に入ってからは頻脈性不整脈に対して有効な治療法として全世界で試行させるようになったが、当時は、心房細動はカテーテルアブレーションでは直せないと言われていた。
1990年代中頃フランスのボルドー大学のDr. Haissaguerre(ハイサゲール)が心房細動の機序を解明し、アブレーション治療を始めた。
心房細動の連続的な異常電気信号の多く(約94%:肺静脈周囲の身は約70%)は、肺静脈開口部あるいは肺静脈に迷入している心筋からの連続的な異常電気信号によって発生することがわかり、その部位をカテーテルで焼却することにより異常電気信号が消失し、心房細動が予防できることが1998年に示された。
しかし、①治療中に異常電気信号がでてこなければ焼くことができない。②複数箇所からの異常電気信号がでた場合、すべてを焼けない場合がある。③肺静脈の周囲を焼くため、焼却に伴い肺静脈狭窄の併発症のリスクがある。といった欠点があり、アブレーション治療後も再発があり、成功率は50%以下であった。
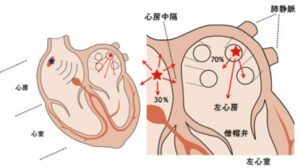
そこで、4本の肺静脈の開口部に対し、それぞれの開口部の周囲を包むように焼くことで電気信号を遮断した(個別肺静脈隔離アブレーション法)。
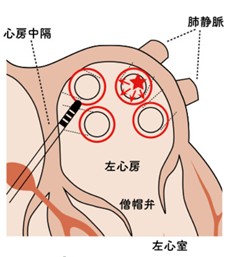
拡大肺静脈隔離アブレーション:左の上下、右の上下2本の肺静脈をまとめて大きく囲う焼却法
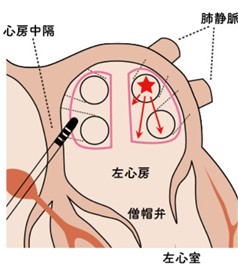
拡大肺静脈隔離アブレーションは、三次元マッピングシステムの導入により、多くの病因で施行できるようになったが、技術的に難しい主義である。
https://www.ablation.jp/ablation/transition.html
肺静脈以外の心房からの異常電気信号がでる場合、患者によって異なるため、基本的には異常電気信号を探してピンポイントでアブレーションを行う。
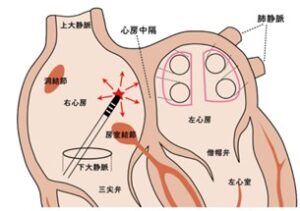
肺静脈のように囲うようにアブレーションができる部位として、上大静脈と左心房の後壁がある。
上大静脈は、右心房の上部にあり、肺静脈のように心房筋が迷入しやすい部位であり、ここからの異常電気信号の発生が家訓できれば、開口部を囲むように焼却ができる。
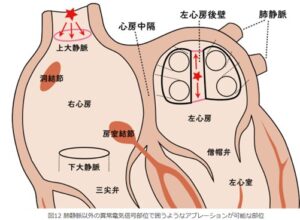
https://www.ablation.jp/ablation/abnormal.html
クライオバルーンアブレーション:バルーンカテーテルを肺静脈開口部に挿入し、風船を膨らまし、肺静脈開口部にはめ込んで密着させ、風船部分をマイナス88.5℃まで冷却し、肺静脈周囲を一気に焼却する方法。
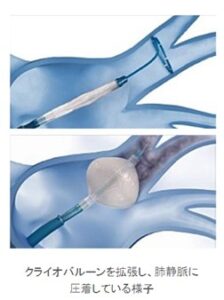
http://www.kosei.jp/medica/cardiovascular/9650.html
Maze手術 1987年ワシントン大学のDr James Coxが開発した心房細動の原因となる電気信号を遮断する心臓手術。
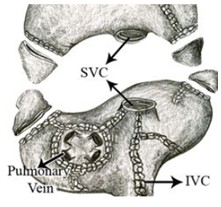
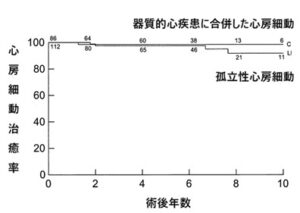
心房筋を一旦切って繋ぐ手術で、その後改良が重ねられVer.3では術後10年で96%の患者が心房細動なしで過ごしており、脳卒中の発生率は1%以下と報告されている。
https://www.sciencedirect.com/science/article/pii/S002252230301287X
さらに進歩し、心房筋をincisionする代わりにablationするようになり、出血のリスクも減っており、MazeⅣと呼ばれることもある。
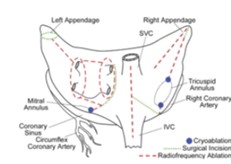
https://www.shinzougekashujutsu.com/web/2011/02/coxmaze.html
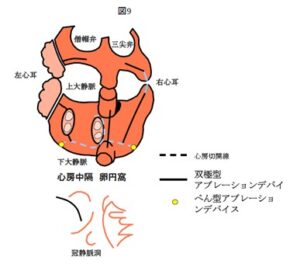
心房細動手術のコンセプト
- 肺静脈を電気的に隔離することで肺静脈からの異常興奮を遮断して、心房全体に異常な興奮が広がることを防ぐ
- 心房を切開することで心房を大きく旋回する興奮を遮断する
- 左心耳を切除することで、左心耳内に血栓ができないように予防する
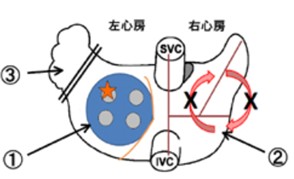
外科用アブレーションデバイスを用いて、心房を線条に焼却する。
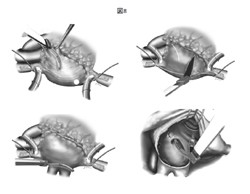
https://plaza.umin.ac.jp/~arrhythm/treatment/surgery/ablation.html
心房細動カテーテルアブレーションの安全性は、JROAD(Japanese Registry of all cardiac and vascular disease)により2012年4月~2018年3月までの期間456の病因で心房細動アブレーションを施行した135299例の調査で、院内合併症発生は3.4%(心タンポナーデ1.2%、脳卒中・VIA 1.0%、洞不全症候群0.36%、肺炎0.28%、血管合併症0.24%)、院内死亡率は0.04%であった。
https://new.jhrs.or.jp/pdf/article_in_press/article003.pdf
パルスフィールドアブレーションは、短時間の周期(パルス)で高電場(パルスフィールド)を発生させることで細胞膜に小さな穴を開けることにより、細胞死を誘導する方法で、熱は発生しない。組織特異的な電場の閾値があるため、心房周囲組織に影響を与えることなく、心筋を特異的に焼却することができる治療法。

17642人の市販後調査で重大合併症1%(心タンポナーデ 0.36%、脳卒中 0.12%、死亡 0.03%)であり、食道関連合併症、肺静脈狭窄、横各神経麻痺はなかったと報告されている。
https://www.nature.com/articles/s41591-024-03114-3
リング状カテーテルであるPilse Selectを左状肺静脈入口部に留置し、90度ずつ回転させながら4回の通電を行う。その後手前に引いて、前庭部で同様に90度ずつ回転させながら4回の通電を行う。
https://osaka-heart.jp/patient/cardiovascular-disease/arrhythmia/new-ablation-technology/
パルスフィールドアブレーションのメリットは、合併症が少なく、従来の高周波カテーテルアブレーションと同等の効果で手術時間が短縮される。
パルスフィールドアブレーションならではの合併症として、溶血(赤血球の破壊に伴う貧血や腎機能障害)や冠攣縮性狭心症があるが、上記論文では、冠攣縮性狭心症 0.14%、透析を要する急性腎機能障害0.03%と報告されている。
https://www.nature.com/articles/s41591-024-03114-3
参:
PFAの分子生物学的視点
PFAはの主たる技術、高電圧パルスによる細胞膜に永久的な孔を形成するプロセスである「不可逆エレクトロポレーション(IRE)」は、次のように進行する。
- 高電圧パルスの適用:
- 高電圧(数百から数千ボルト)の短時間の電場パルス(通常は数マイクロ秒から数ミリ秒)を組織に加える。
- この電場は細胞膜に強い電気力を生じさせ、細胞膜の脂質二重層に構造的変化を引き起こす。
- ナノポアの形成:
- 電場によって細胞膜の安定性が崩れると、ナノメートルサイズの孔が形成される。
- 低電圧や短時間のパルスでは、これらの孔は可逆的で細胞が回復するが、高電圧ではこれが不可逆的となり、細胞の恒常性が維持できなくなる。
- 細胞膜の崩壊:
- 形成された孔を通じて細胞内外の物質交換が制御不能となり、イオン濃度の不均衡や浸透圧の変化が発生する。
- 特にカルシウムイオンなどの細胞内外の大規模な流入が、細胞死の主因となる。
- 細胞死の誘導:
- 電場に晒された細胞はアポトーシス(プログラムされた細胞死)またはネクローシス(非制御的な細胞死)を引き起こす。
- このプロセスは、周辺の非標的細胞(例えば血管や神経など)に最小限の影響を及ぼし、心筋細胞を選択的に破壊する。
- 組織レベルでの効果:
- IREによる細胞死は、組織全体にわたる効果的な病変形成を可能にする。これにより、心筋の不整脈源を効率的に除去する。
- PULSED-AF試験
- 対象:300名のAF患者(発作性および持続性)
- 成果:
- 発作性AF患者の1年後非再発率:69.5%
- 持続性AF患者の1年後非再発率:62.3%
- 合併症率:0.7%
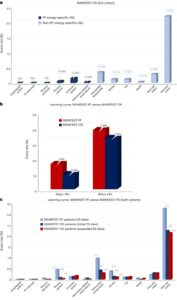
- MANIFEST-PF試験
- 対象:1758名のAF患者
- 成果:
- 急性肺静脈隔離(PVI)成功率:99.9%
- 発作性AF患者の1年後非再発率:81.6%
- 持続性AF患者の1年後非再発率:71.5%
- 術後合併症:血管アクセス合併症(3.18%)、心タンポナーデ(0.97%)
https://wbck.tokyo/archives/1318
























