クリニックからのお知らせ
2025.02.19
脳梗塞の急性期治療 血管内治療と抗血栓療法 佐々木亮先生
2025年1月31日
演題「脳梗塞の急性期治療について ~血管内治療と抗血栓療法~」
演者:聖隷横浜病院 脳神経欠陥・高次脳機能センター センター長 佐々木亮先生
場所: Hotel Plumm
内容及び補足「
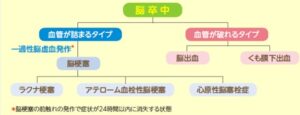
脳卒中は年間約170万人発生し、以下のように分類される。
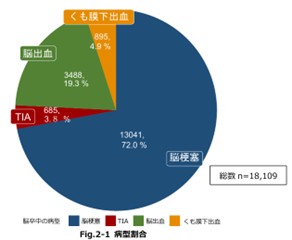
日本脳卒中データバンクによると2023年1月1日~2023年12月31日までに入院した症例18109例のうちの約72%が脳梗塞、TIAが3.8%、脳出血が19.3%、くも膜下出血が4.9%と報告している。
https://strokedatabank.ncvc.go.jp/
脳梗塞は、病態として下図のように3タイプに分けられる。

https://www.pref.hiroshima.lg.jp/site/junkanki/nousottyu.html
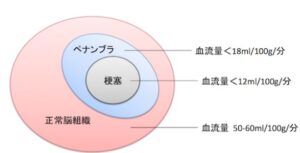
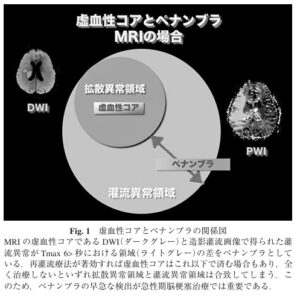
ペナンブラPenumbra
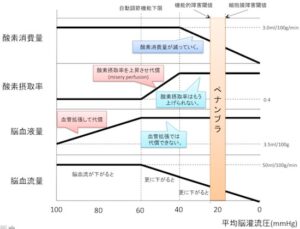
脳血流が100mmHgより低下すると、血管が拡張することにより脳血流を増加させて代償する。しかし、60mmHgより低下すると血管拡張による代償機構が働かず、脳細胞が酸素摂取率を上げようとすることで代償しようとする(misery perfusion)。さらに40mmHgより低下すると酸素摂取率を上げることでの代償ができなくなり、脳細胞の酸素消費量が減って虚血に陥る。
20mmHg鏡で機能的障害閾値に到達し、16mmHg程度で細胞膜障害閾値に到達する。ここを超えると細胞は壊死に陥る。この間ならまだ回復する可能性があり、この状況をペナンプラという。
参:diffusion-perfusion mismatch:臨床的には拡散強調像高信号のほとんどは最終高速に至る。各参以上領域よりも広い範囲で還流異常領域がある。換算以上領域は最終拘束の最小範囲を示し、還流異常領域は最大範囲を示していることになる。
https://xn--o1qq22cjlllou16giuj.jp/archives/116
MRIの灌流画像(Perfusion imaging:PWI)には造影剤を用いるDSC(Dynamic susceptibility contrast)法とDCE(Dynamic contrast enhanced)法がある。
https://www.jstage.jst.go.jp/article/jstroke/advpub/0/advpub_10621/_pdf/-char/ja
参:
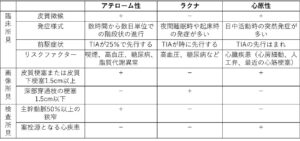
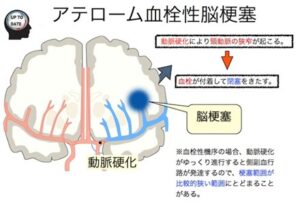
アテローム血栓性梗塞
脳動脈のアテローム硬化が原因。
好発部位:IC起始部、C2-C1-M1、V4-BA-P1
プラークによる狭窄、プラーク破綻からの血栓形成
緩徐進行、側副血行発達、急性発症するが段階的に増悪することが多い。
皮質はSpareされる傾向あり。皮質枝の末梢は脳表で軟膜髄膜吻合を形成しており、閉塞時には側血行路としてこの軟膜髄膜吻合が機能するため、しかし、塞栓性梗塞では皮質も梗塞に陥る。
白質有意の梗塞、境界やや不明瞭(皮質枝支配領域全体が梗塞になることはない。血管性浮腫も弱い)
アテローム血栓性脳梗塞は、血栓性、塞栓性、血行力学性(境界領域)の発症機序がある。
血栓性:アテローム血栓性(arthrothrombotic infarction:ATI)動脈硬化狭窄部位に血栓が形成され閉塞
境界領域:境界領域梗塞(watershed infarction)急激な灌流圧低下で側副路が代償できない部位で灌流不全が起こる
塞栓性:動脈原性梗塞(artery-to-artery infarction)アテロームに付着した血栓が遊離する。心原性塞栓よりは範囲が小さい傾向があるが、多発、繰り返すことがある
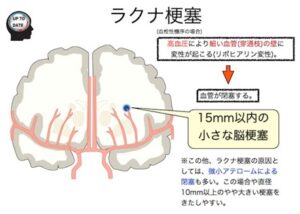
ラクナ梗塞
Lacuna=小さな窪み
穿通動脈(穿通枝)閉塞に起こる梗塞であり、5-15mm程度の小梗塞
穿通動脈の末梢部における脂肪硝子変性や血管壊死による閉塞
血管周囲腔と間違えない(ラクナ梗塞は3mm以上、非対称性分布)
細動脈硬化、高血圧、微小粥腫、微少塞栓などが原因となる
好発部位:外側線条体動脈(基底核領域)、視床への穿通動脈、前脈絡動脈(内方後脚)、脳幹
終末動脈故側副血行は認めない。
症状は比較的軽微であるが、前脈絡動脈閉塞では片麻痺をきたす。
出血性梗塞はないが、Microbleedsはありえる。
分岐粥腫型梗塞(BAD)はラクナ梗塞ではない。
高血圧性脳出血は、ラクナ梗塞と同様いずれも穿通動脈レベルの高血圧による動脈硬化性病変に基づく。症状は重篤であり、ラクナと脳出血は表裏いったである。
リポヒアリノーシス(lipohyalinosis):3-7mmの小さなラクナは、血管壊死・類線維素変性による血管閉塞で生じ、これは,
普通は直径200μm以下の脳動脈の高血圧性変化であり、一方では高血圧性脳出血の原因となる。
微少粥腫(microatheroma):10mm以上の比較的大きいラクナは、直径400-900μmの太い穿通動脈壁に見られる小さなアテロームによる。
分岐粥腫(branch atheromatous disease):主幹動脈のアテローム硬化による穿通動脈入口部の分岐粥腫による
微少塞栓:大血管からの塞栓(アテローム血栓性脳梗塞として治療)、心臓に由来する微少塞栓による(心原性脳塞栓症として治療)
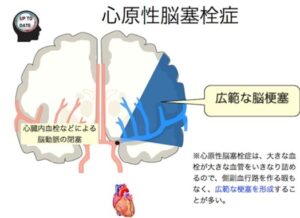
塞栓症(心原性塞栓症 Cardio embolism)
非弁膜性心房細動
大きな塞栓子が動脈分岐部に閉塞をきたす。
突然発症、側副血行発達不良、重篤な症状(意識障害、片麻痺)が起こる。
支配域に一致した境界明瞭な梗塞(皮質を含む)。
自然溶解、破砕により末梢を再閉塞することがある。この現象はspectacular shrinking deficit(SSD)と呼ばれている。
著明な血管性浮腫を伴い、再開通により重篤な出血性梗塞を起こすことがある。
https://xn--o1qq22cjlllou16giuj.jp/archives/106
TIA(Transient ischemic attack:一過性脳虚血性発作)
脳虚血による局所神経症状が短時間出現するが可逆的で神経症状を残さない。
一つの動脈領域に限局。
持続が24時間以内、多くは2-5分以内。時に反復する。
原因:アテローム血栓性が多い。動脈原性微少塞栓もしくは血行力学的機序。
診断には、数分間の片側の四肢の脱力といった典型的な病歴に加え、高血圧、糖尿病、喫煙などの心血管危険因子の有無を確認することが重要である。
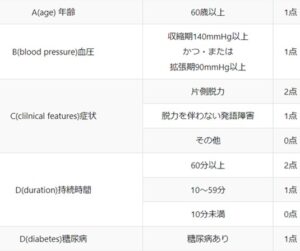
ABCD2スコア:TIA後の脳卒中発症のリスク予測
Age 年齢
BP 血圧
Clinical feature 片麻痺、麻痺のない言語障害
Duration 持続時間
Diabetes 糖尿病
この値が高値で、DWIで高信号、さらには心房細動や頭蓋内動脈病変がある場合はTIAの高リスクとなる。
スコア別の脳梗塞移行リスクは以下の通りである。
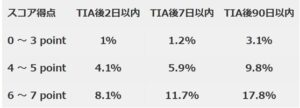
ABCD2スコアが3点以下の場合、48時間以内のうのう梗塞発症リスクは1%で、4点以上は4.1%以上と高くなることから、イギリスでは、ABCD2スコアが4点以上なら24時間以内に、3点以下なら7日以内にCtrl-MIやMRIを持つ高度医療センターの受診を設定する体制(TIAクリニックの新設)が作られた。
しかし、「ABCD2およびABCD3の単独使用によるTIAの低リスクと高リスクの判別脳が低いことが明らかになり、TIA後の脳梗塞のリスク判別脳の低いツールの結果を基に賢者の専門委に送ることを遅らせことは有害であり、すべてのTIA疑い例は脳卒中リスクを有すると考えるべきである年、2019年のガイドライン改定で廃止された。
Lancet 369 283-292 2007
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(07)60150-0/abstract
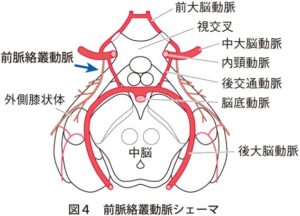
BAD(branch atheromatous disease)
主幹動脈からの穿通枝分岐部に、アテロームプラークができ、プラークが拡大、破綻して、穿通枝血管を根元から閉塞することが原因となる。
好発部位
レンズ核線条体動脈(放線冠を灌流する)
前脈絡叢動脈(内包後脚を灌流する)
傍正中橋動脈(橋底面を灌流する)
臨床症状:梗塞部位により異なる
前脈絡叢動脈の閉塞した場合の症状
対側運動麻痺、半身感覚鈍麻、同名半盲、麻痺側の運動失調、不随意運動、健忘、意識障害
https://kasotuukablog.com/badnoukousoku/
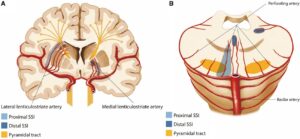
Stroke. 2021 Oct;52(10):3191-3198
https://www.ahajournals.org/doi/10.1161/STROKEAHA.120.032966
抗血小板薬と抗凝固薬
血液凝固機能のうち、一次止血で働く血小板の働きを抑制し、血小板血栓を作らせない薬が抗血小板薬で、二次止血に働く凝固因子に作用し、フィブリンの生成を阻害することでフィブリン血栓を作らせない薬が抗凝固薬である。
血小板は、血流が早いところで活性化されるので、血小板血栓は主に動脈で作られる。適応となる疾患は、狭心症、心筋梗塞、心原性脳梗塞以外の脳梗塞、TIA、冠動脈バイパス術(CABG)後、経皮経肝冠動脈形成術(PTCA)後、川崎病などである。
フィブリン血栓は血流の遅いところで活性化されやすいので主に静脈で作られる。心房細動時の心房内や長期が商事の下肢の静脈で生成されやすい。適応となる疾患は、血栓塞栓症(静脈血栓、心筋梗塞、肺塞栓、心原性脳梗塞など)、弁膜症の術後などである。
どの薬を使うかを決めるためには、どのタイプの脳卒中であるかの正確な診断が必要である。
MRI、カテーテルによる脳血管造影、ホルター心電図、経食道心エコー、心エコー検査、埋め込み型心電図(ICM:insertable cardiac monitor)等の検査が有用である。
貼るタイプでも長時間記録心電図レコーダが開発されている。
eMEMO WR-100
https://www.fukuda.co.jp/medical/new_recommend/wr_100.html
Lotus Heart
Heartnote
https://www.jsr.co.jp/products/ecg/heartnote.html
超急性期治療
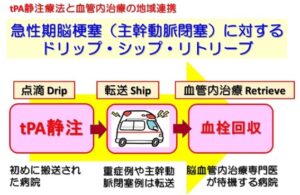
ドリップ・シップ・リトリーブ
2005年から急性期脳梗塞患者に対してtPAを用いた血栓溶解療法が可能となり、患者予後が改善してきた。しかし、発症後4.5時間を超えた場合や、頭蓋内出血や急性大動脈仮などを合併している場合は適応外であり、tPAがしようかのうとなっても脳梗塞患者全体の5%未満しかその恩恵にあずかれなかった。
そうした状況下で、2014年頃から注目され始めたのが血栓回収療法である。
脳動脈閉塞部位でステントなどを展開し、血栓を絡め取って回収することで血管を再開通させる血栓回収療法は、閉塞部位から血栓を直接回収するので、再開通すれば予後の劇的な改善が期待できる。
日本脳卒中学会の『脳卒中治療ガイドライン2015[追補2017]』では、発症から4.5時間以内にtPA静注療法を行った上で、内頸動脈または中大脳動脈の閉塞で発症6時間以内ならば血栓回収療法を開始することがグレードAで推奨された。tPA静注療法が無効または非適応の場合でも、発症から8時間以内の主幹脳動脈閉塞であれば、血栓回収療法を実施可能としている。
しかし、実施できる医師の数が少ないことが最大の課題であり、血栓回収療法を安全に実施するために、東邦大学医療センター大橋暴飲の岩渕氏らは、世田谷区、目黒区、渋谷区からなる東京都西南部医療圏で13病院による「トリップ・シップ・リトリーブ」と呼ばれる脳梗塞治療連携体制を稼働させた。
脳梗塞の可能性が高いと救急隊が判断した患者を、まずtPA静注療法が可能な近隣病院に搬送し、そこでtPAを点滴(drip)しつつ病院へ転送(ship)し、血栓をカテーテルで回収(retrieve)することで早期の血管再開通を目指すという体制である。
http://www.hyo-med.info/media/20181018_nikkeimedical.pdf
2010年Merci retriever(先端がらせん状になった柔らかいワイヤー)を使って血栓回収療法が認可された。
これを用いると、閉塞した血管は70-80%際開通すると報告されたが、血栓回収中に血管を損傷して、脳出血を生じることもあり、簡単な治療ではなかった。

最近では新しいデバイスが次々と認可され、最近では、メルシーはほとんど使われなくなってきた。
Penumbra system:専用の再灌流カテーテルに強力な吸引ポンプを用いて、血栓を砕きながら回収する機材で、2011年に認可された。
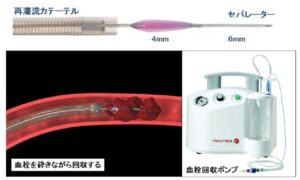
最近ではセパレーターを用いずに再灌流カテーテルを閉塞部位に誘導し、用手的または吸引ポンプを用いて直接血栓を1回として抜去する方法:MAX ACEシリーズが導入され、短時間で再開通が得られるようになり、再開通率は80-90%と報告されている。
2014年7月に、新たなステンと型の血栓回収デバイスが2種類同時に認可された。従来の器具と比べて血栓回収の効果は高く、再開通率は90%程度に向上し、安全性も高いことが報告された。
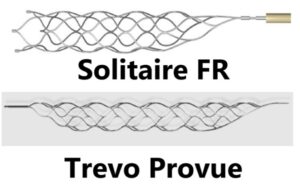
https://www.toyoko-stroke.com/treatment/merci.html
脳梗塞慢性期
抗血小板療法
アスピリン
2009年のATTによるメタ解析では、アスピリンはプラセボに比べ脳梗塞再発を22%有意に減少したが、一方で出血性脳卒中を1.67倍増化する傾向があったが、前脳卒中は19%有意に減少した。
50件の無作為化比較試験のネットワークメタ解析では、アスピリンはプラセボに比べて、脳卒中再発率を19%有意に減少し、また、前脂肪を14%減少した。
2次予防例においては、アスピリンの虚血イベント予防効果によるベネフィットは、頭蓋内外の出血性合併症のリスクを上回ると考えられている。
48時間以内の投与が進められている。
アスピリンとクロピドグレルの併用は、CHARISMA(NEJM2006 354 1706-1717)およびSPS3(NEJM 2012 367 817-825)試験ともに、併用期間を1ヶ月未満、1~3ヶ月、3ヶ月以上で分類したところ、1ヶ月未満、1-3ヶ月では単剤に比して併用で脳梗塞再発リスクは有意に低下したが、3ヶ月以上の併用によるベネフィットは示されなかった。
一方大出血のリスクは、1ヶ月未満の併用では、単剤と有意差はなかったが、1~3ヶ月および3ヶ月以上の併用で有意に上昇していた(Stroke 2019 50 947-953)。したがって、併用投与は、1ヶ月以内の投与が目安と考える。
https://www.jsts.gr.jp/img/guideline2021_kaitei2023.pdf
TIA急性期・慢性期
TIA後の脳梗塞は、TIA発症90日以内、24~48時間の比較的早期に発症する。
TIA発症後早期に治療を受けた場合、90日以内に大きな脳卒中発症が80%軽減された(Lancet 2007 370 1432-1442、 Lancer Neurol 2009 8 235-243、Lancet Neurol 2007 6 953-960)。
脳梗塞もしくはTIAの急性期再発防止には、アスピリン160~300mg/日が有効であった。
アスピリンに関するメタ解析では、TIAと軽症脳梗塞に対する早期再発抑制効果が高かった。CHANCE試験では、発症24時間以内でNational institute of Health Stroke Scale(MISS)スコアが3点以下の軽症脳梗塞か、4点以上のハイリスクTIS症例において、急性期21日間にアスピリンとクロピドグレルを併用した群と、アスピリン単独群の検討では、90日間の脳卒中発症は併用群で有意に少なかった。また、出血性脳卒中の発症は、両軍間で有意差を認めなかった。
POINT試験では、軽症脳梗塞(NIHSS≦3)およびハイリスクTIA(ABCD2スコア≧4)症例において、アスピリンおよびクロピドグレルの2剤投与は90日間の虚血性脳卒中を有意に抑制したが、出血性合併症を増加させた。
この二つの試験の統合解析から抗血小板2剤併用療法(dual antiplatelet therapy:DAPT)は21日以内の投与が進められ、21~90日間の検討では有効性が示されず、出血性合併症の増加が危惧された。
https://www.jsts.gr.jp/img/guideline2021_kaitei2023.pdf
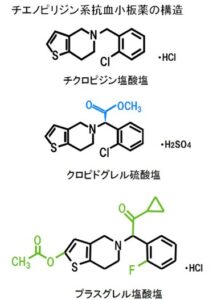
チクロピジン(パナルジン)はチエノピリジン系の抗血小板剤。プロドラッグであり、肝臓で代謝された後ADP受容体であるP2Y12受容体を阻害する。
副作用で肝機能障害、血栓性血小板減少性紫斑病、汎血球減少症などの重篤な副作用がまれに合併するため、有効性が同等で安全性に優れているといわれているクロピドグレルに置き換わる傾向にある。投与中止後でも4~10日間は作用が持続し、その作用が消失するまでには血小板の寿命と同じ期間である8~10日間かかると考えられている。
チクロピジンはP2Y12ADP受容体を選択的かつ不可逆的に阻害するように働く。
クロピドグレルはADP抑制作用の個人差が大きく抑制作用の弱い場合(一般的にADP凝集抑制率が40%以下、または全血凝集計VerifyNow-P2Y12では>230PRU)がありクロピドグレル例反応性と呼ばれている。
クロピドグレル低反応性の機序としては、服薬コンプライアンスの問題、腸管からの吸収効率、薬物代謝酵素CYP2Cの多型性(日本人に多い 約20%)などの関与が考えられている。
+グレルは、クロピドグレルより強力な第3世代知恵のピリジン系薬剤として我が国で開発された。効果発現が強く、日本人に多いCYP2C19の機能喪失型遺伝子多型の影響が少ない。
VerifyNow System PRU
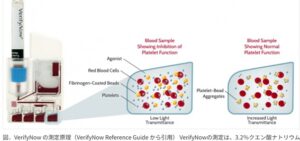
迅速に全血検体において血小板凝集を測定できる装置。
2022年6月アスピリンやクロピドグレルの簡易モニター検査として承認された。
VerifyNowの測定は、3.2%クエン酸ナトリウム0.2ml入りの採血管(Niproネオチューブ)に21ゲージ以上の採血針を使用して静脈血1.8mlを採取し、本体にテストデバイスをセットし、そこへ転倒混和した採血管を挿入するという操作のみで完了。本邦承認のテストデバイスはVerifyNow PRUテストとVerifyNowアスピリンデバイスで、ヒトフィブリノーゲンでコーティングされたビーズとともにアデノシン二リン酸(ADP)、プロスタグランジンE1(PGE1)やアラキドン酸が、4つのミキシングチャンバーに異なる組み合わせで入っている。採血管の挿入により自動的に全血が吸引され、血小板がアゴニストにより活性化されてビーズと凝集塊を形成すると濁度が変化するため、ミキシングチャンバーを通過した光の透過度から凝集を評価する。PRUテストでは約3分でP2Y12 reaction units(PRU)が、アスピリンでは約5分でaspirin reaction units(ARU)が表示される。測定は採決後10分(PRU)または30分(ARU)から4時間の間に行う。
https://jsth.medical-words.jp/words/word-425/

https://pbrainmd.wordpress.com/wp-content/uploads/2016/04/verifynow-reference-guide.pdf
≧550ARU:アスピリンによる血小板機能抑制が認められない。
<500ARU:アスピリンによる血小板機能抑制が認められる
https://www.info.pmda.go.jp/downfiles/ivd/PDF/100860_30400EZX00001000_A_01_03.pdf
シロスタゾール(プレタール)は血小板の行流抑制を行うcAMPの代謝酵素であるホスホジエステラーゼ3を阻害することにより、血小板の凝集抑制作用を強くする薬剤である。
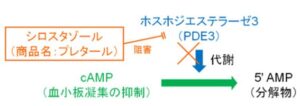
血小板の植生効果の他に、血管を拡張させる効果もあり、脳梗塞症例の脳血流量を増加させたり、四肢血流の低下を改善する効果も期待できる。
尊母他にeNOS(内皮型NO合成酵素)滑石かRhoキナーゼ抑制、循環EPCs増加による血管内皮機能正常化効果も有する。
副作用として、頭痛や下痢、頻脈、動機が見られる。また、CYP3AやCYP2C19による代謝を受けるので併用注意薬(イトラコナゾール、毛と子ナゾール、エリスロマイシン、ジルチアゼム、オメプラゾールなど)が少なくない。
参考文献:脳卒中治療ガイドライン2021(改訂2023)
























