その他
2022.12.04
新規神経ペプチドの探索から睡眠・冬眠へ 櫻井武先生
2022年11月24日
演題「新規神経ペプチドの探索から睡眠・冬眠へ」
演者:筑波大学医学医療系/国際統合睡眠医科学研究機構教授 櫻井武 先生
場所: ローズホテル横浜
内容及び補足「
1998年に新規神経ペプチドオレキシンを同定した。オレキシンは摂食行動の制御系と睡眠・覚醒の制御系の両者と深い関係を持っている。さらに、報酬系との関連も注目されており、情動や体内時計、エネルギー恒常性を統合した情報を基に、適切な睡眠・覚醒状態をサポートする機能を持っている。
摂食行動をはじめとする動機に伴う行動を制御するには覚醒の維持や報酬系の関与が必要であり、オレキシンは様々な行動をサポートするために覚醒を維持する機能を有していると考えられる。
オレキシンとオレキシン受容体
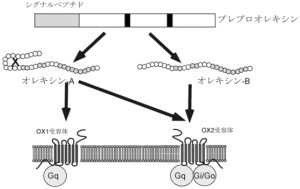
オレキシンはオレキシンAとオレキシンBの二つのアイソペプチドからなる。
オレキシンAは分子内に二対のジスルフィド結合を有する。これら二つのペプチドは共通の前駆体プレプロオレキシンから生成され、二つのGタンパク質共役型受容体オレキシン1受容体OX1R、およびオレキシン2受容体OX2Rによって受容され、オレキシンは興奮性に作用する。
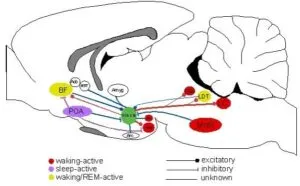
オレキシンを産生するニューロンは視床下部のみで見いだされている。特に「摂食中枢」とされる外側野(lateral hypothalamic area:LHA)及び近接する視床下部脳弓周囲野(perifornical area)、そして視床下部後部(posterior hypothalamus:PH)に散在している。
オレキシン免疫陽性線維は小脳を除く中枢神経系全域に観察され、視床下部に局在する比較的少数のオレキシンニューロン(マウスで数千個、ヒトで50000個ほど)から伸びる軸索は、数多く分枝しつつ、広範な領域に投射している。
視床下部内では、特に、弓状核や腹内側核、背内側核など、摂食行動に関連する部位に多くのオレキシン様免疫活性陽性線維がみられる。
視床下部の外では、脳幹の睡眠・覚醒制御に関わるモノアミン作動性神経の起始核、青班核(locus coeruleus:LC、ノルアドレナリン作動性)、背側縫線核(dorsal raphe nucleus:DR、セロトニン作動性)や視床下部の結節乳頭体核(tuberomamillary nucleus:TMN、ヒスタミン作動性)、脳幹のコリン作動性神経の起始核、外背側被蓋核laterodorsal tegmental nucleus:LTD)や脚橋被蓋核(pedunculopontine tegmental nucleus:PPT)に密な投射が見られる。大脳皮質の各層にも投射している。
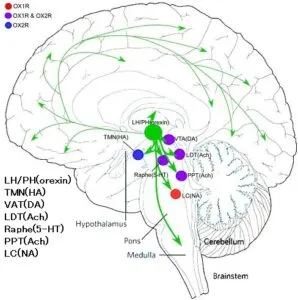
オレキシン作動性ニューロンの投射領域に一致してOX1RおよびOX2Rも分布するが、脳内の組織分布はサブタイプにより異なっている。たとえばLCではOX1R mRNAのみが発現しているのに対し、TMNではOX2R mRNAのみが発現している。また、DRやLTD、PPTには両方の受容体が発現している。このことは、2つのオレキシン受容体が明確な役割分担をしていることを示唆している。
https://spc.jst.go.jp/hottopics/1009neurosurgery/r1009_sakurai.html
ナルコレプシー
ナルコレプシーはイギリスの医師トーマス・ウィリスによって最初の報告がされ、19880年フランスの医師ジャン=バティスト=エドゥアール・ジェリノーによってナルコレプシー(Narco=眠り、Lepsie=発作)と名付けられた。
世界での有病率は約2000人に1人とされているが、日本人に多く約600人に1人と報告されている。
症状:主に5つの症状がある。
1.日中の強い眠気と急な居眠り(睡眠発作)・・・必発
睡眠発作は睡眠不足によるものではなく、耐えがたいほどの強い眠気で、通常では考えられないシーンでも眠りに落ちてしまい、20~30分程度で目覚めるが、またすぐに眠気が起こる。
2.情動脱力発作:カタプレキシー
笑ったり、喜んだり、泣いたり、怒ったりと強い感情が生じたときに体の力が急に抜ける発作である。脱力する場所は顎や舌などの局所的な場合もあるが、両膝がガクッと折れてしまったり、抗重力筋が脱力して転倒や転落につながってしまう場合もある。脱力の時間は数秒から長くても2分程度で回復し、意識を失うことはない。この症状は個人差が大きく、わずかな情動で脱力が起こる人もいれば、ほとんど確認できない人もいる。
3.睡眠麻痺(金縛り)
睡眠中目が覚めたときに体が動かない状態。レム睡眠で脳が活動し、体が脱力している状態のときに覚醒してしまう状態と考えられている。
4.入眠時幻覚
患者の8割にみられる。脳の覚醒を維持するオレキシンの活性不足で覚醒と睡眠のバランスが崩れ、入眠時に中途半端な覚醒状態になっていると推定されている。幻覚は生々しく、実態感を伴うのが特徴で、統合失調症などで見られる幻覚とは異なる。睡眠麻痺と入眠時幻覚が同時に起こることもあり、強い恐怖感を経験することもある。
5.熟眠障害
覚醒と睡眠のバランスが乱れるため、夜間の睡眠にも障害をきたし十分な疲労回復が困難となり、日中の眠気をさらに増悪させることになる。

https://www.md.tsukuba.ac.jp/basic-med/pharmacology/orexin.pdf
ナルコレプシーの症状は、覚醒・睡眠の各相(覚醒、non-REM睡眠、REM睡眠)が適切に維持できないことに起因しており、睡眠・覚醒の断片化(覚醒相と睡眠その間の相転移が頻繁に起こる)、覚醒相から直接REM睡眠に移行する現象(Sleep-onset REM現象)の出現、そして非常に短い睡眠潜時が特徴的である。オレキシンは睡眠・覚醒相の安定化に重要な働きをしている。
カタプレキシー、睡眠麻痺はREM睡眠時にみられる抗重力筋トーヌスの喪失、入眠時幻覚は睡眠時に夢を見ることと関連すると考えられ、後者3つの症状はREM睡眠関連の機構が異常なタイミングで出現したものと解釈されている。一方、睡眠発作時には覚醒からnon-REM睡眠に移行している。頻回の中途覚醒や睡眠構築の異常のため、熟睡感がえられていない。
オレキシンノックアウトマウス、OX2受容体ノックアウトマウス、オレキシン神経を変性させたトランスジェニックマウスは、ヒトのナルコレプシーと酷似した病態を示す。
遺伝性のナルコレプシー犬は、OX2受容体の遺伝子の突然変異が見出されている。ヒトのナルコレプシー患者の死後の検討で脳においてオレキシン神経の脱落は確認されている(Nat. Med. 2000 9 991-997)し、ナルコレプシー患者の約90%に髄液中のオレキシン濃度の著しい低下(Arch Neuraol. 2002 59 1553-62)も見られる。
ナルコレプシーは、思秋期前後に発症する症例が多く、強い眠気を主訴とすることが多く、情動(特に喜びや笑)によって抗重力金の緊張が低下する発作“カタプレキシー”を伴うことが多い。特に問題となるのは、日常生活において「覚醒しているべき時」に覚醒を維持できないということが問題になる。逆に、睡眠時にも頻回の覚醒によって睡眠が妨げられる(入眠時幻覚や入眠麻痺)など様々な症状を呈する。これらの病態はオレキシン欠損が関与しており、オレキシンは睡眠・覚醒状態の適切な維持・制御に重要な役割を担っていると考えられる。
オレキシン産生神経は、モノアミン・コリン作動性神経核に投射しており、これらの核にはオレキシン受容体の発現もみられる。LCのノルアドレナリン神経、DRのセロトニン神経、TMNのヒスタミン神経はどれも覚醒時に数Hzの発火頻度で活動し、non-REM睡眠に活動が低下し、さらにREM睡眠時にはほぼ活動を停止する。LDTとPPTにも覚醒にかかわるニューロンが存在する。これらは、かくせいじおよびREM睡眠時に活性の高まるタイプとREM睡眠時のみに活性化されるタイプに分けられ、覚醒の維持とREM睡眠の制御に関与し、視床を介して、あるいは直接大脳皮質に影響を与えている。これらのモノアミン及びコリン作動性ニューロンは、小さな核に集まっているが、その軸索は数多く分岐し、大脳皮質の広範な領域に投射し、覚醒の維持にかかわっていると考えられている。
睡眠時には、視索前野(preoptic area)、特に腹外側視索前野(ventrolateral preoptic area:VLPO)に存在する睡眠時のみに高い発火頻度を示す神経細胞(sleep-active neuron)が、GABA作動性の抑制性の影響をこれらの覚醒制御領域の神経細胞を抑制し、睡眠が惹起されると考えられている。
オレキシンによる覚醒状態の維持機構
オレキシンあるいはOX2Rの欠損動物では適切な覚醒が維持できず、睡眠に移行してからレム睡眠が見られるまでの時間であるレム潜時が極端に短縮する現象が観察され、時にはレム潜時はゼロとなるので、オレキシンは覚醒の維持とレム睡眠の制御に極めて重要な役割を果たしている。
我々のグループは、トランスジーンを用いてオレキシンを持続的に異所性に発現させたマウス(CAG/orexinマウス)とオレキシン神経欠損したナルコレプシーマウス(orexin/ataxin-3マウス)とを掛け合わせたダブルトランスジェニックマウスを解析した。
覚醒相におけるカタプレキシー様の脱力発作が消失し、長い覚醒時間が維持できるようになっており、ナルコレプシー症状の消失が確認できた。同様に脳室内へオレキシン投与によってもナルコレプシーの症状は消失するが、持続的にオレキシン遺伝子を発現させたマウスでは、休眠相である明期において、長期のnon-REM睡眠が維持できないという睡眠異常がみられる。このことから、オレキシン神経は覚醒時には活性化、睡眠時には抑制されるといった適切な活性調節により脳幹のモノアミン・アセチルコリン神経の活性を統合・制御し、睡眠・覚醒の各相を維持する機能を果たしていると考えられる。
モノアミン神経は、覚醒時に活性が高く、睡眠時に低下することが電気生理学的に示されており、また、大脳皮質に投射して覚醒を維持する働きを持っている。また、モノアミン系の神経細胞と視索前野の睡眠時に活性の高いGABA作動性神経は、相互に抑制する関係にあり、このような神経回路は睡眠と覚醒の相転移がスピーディーに起こるようないわゆる“flip-flop”のシステムを作っていると考えられる。
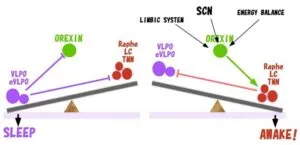
その反面、この機構だけでは、睡眠相と覚醒相の移り変わりが頻繁に起こってしまう性質を持つはずである。そこにオレキシンが介在することにより、覚醒相におけるモノアミン系の神経細胞の活性を強力かつ持続的に高め、覚醒相を優位に傾けて覚醒を維持する機能を発揮していると思われる。
https://www.md.tsukuba.ac.jp/basic-med/pharmacology/orexin.pdf
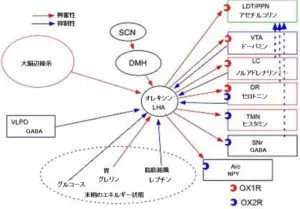
オレキシンニューロンの制御システム
セロトニン、ノルアドレナリンはオレキシン産生ニューロンを強力に抑制し、アセチルコリンは約3割のオレキシン産生ニューロンを活性化する。また、コレシストキニン、グレリン、バソプレッシン、ニューロテンシン、TRH、CRFといった神経ペプチドによっても影響受ける。れプリンによって抑制され、細胞外グルコース濃度が高くなった時にも抑制される。
また近年、オレキシン産生神経は、扁桃体、分界条床核などの大脳辺縁系や視索前野(POA)のGABA作動性神経、縫線核のセロトニン作動性神経からの入力を受けていることが明らかになった。こうした入力系によりオレキシン産生神経覚醒が必要な時に活性化され、脳幹のモノアミン神経やコリン作動性神経の適切な活性を制御していると思われる。
特に扁桃体や分界条床核は、情動の制御にかかわる部分であり、脳幹や視床下部などに出力し、情動に伴う運動系の制御、交感神経系の活性、HPA軸の活性化に関与しているが、オレキシン神経にもこれらの領域からの投射が見られる。情動が発動しているときには注意力が上がり、覚醒レベルも上昇するが、この現象に大脳辺縁系からオレキシン神経への入力がかかわっている可能性が高い。ナルコレプシー患者が、通常の人では眠気をきたさないような緊張を強いられている場面や興味をひかれている状況でも睡眠に陥ってしまうのは、情動がオレキシン神経を刺激することが覚醒を維持するうえで重要であることを示していると思われる。また、ナルコレプシー患者において、情動がカタプレキシーを引き起こすことも、情動がオレキシン神経を活性化していることを示唆している。つまり、情動が発動しているときには、本来オレキシン産生神経の活性化が筋緊張を維持しているのである。マウスに対して情動刺激を加えると、交感神経系の活性化を介して、血圧や心拍数が上昇するが、オレキシン欠損マウスでは、こうした反応が非常に減弱している。また、オレキシン欠損マウスでは、こうした反応が非常に減弱している。また、オレキシン欠損マウスでは扁桃体や分界条床核を直接刺激したことによって引き起こされる自律神経反応も非常に弱いことから、情動に伴う自律神経系の反応にはオレキシンの機能が不可欠である。このように、大脳辺縁系からの入力は、情動に伴う自律神経系の制御及び覚醒レベルの上昇にかかわっていると考えられる。
大脳辺縁系からオレキシン神経への入力系は、おそらく摂食行動の制御にも関与している。ナルコレプシーの犬はエサを認知することによってカタプレキシーが惹起される。このことは、エサを認知することによって食欲が惹起される際食欲が惹起される際、報酬制の情動の惹起を介してオレキシン系が活性化されていることを示唆している。
一方、POAには、睡眠時に活性化され、抑制性の神経伝達物質を持つ神経細胞群が局在している。これらの神経細胞は、モノアミン系の神経に抑制性のGABA作動性および、ガラニン作動性の抑制性の投射をすることによって、睡眠を惹起し、かつ維持していると考えられているが、オレキシンニューロンもsleep-active neuronによって制御される。この刑により、睡眠時はオレキシン産生ニューロンの活動は低く維持されていると考えられる。
その他、オレキシン産生ニュ-ロンは、セロトニン作動性神経やノルアドレナリン神経から抑制の入力を受けている。前述のようにオレキシンニューロンは、これらのモノアミン作動性ニューロンに興奮性の出力しているため、この経路はネガティブフィードバック・ループを形成しており、覚醒時には、緊張的にオレキシンニューロンに抑制性の入用をすることにより、オレキシンニューロンの活性を一定に保つ役割をしている示唆される。
マウスを絶食させると覚醒時間が延長し、睡眠時間が短縮することにより、食物を探索するための行動を支えるが、オレキシン神経欠損マウスでは絶食に伴う覚醒時間の延長と行動量の増加が見られない。つまりエネルギーバランスが府に傾いたときにみられる覚醒の増加・行動量の増加にはオレキシン産生ニューロンの機構が必要である。
https://spc.jst.go.jp/hottopics/1009neurosurgery/r1009_sakurai.html
https://www.md.tsukuba.ac.jp/basic-med/pharmacology/orexin.pdf
参:冬眠
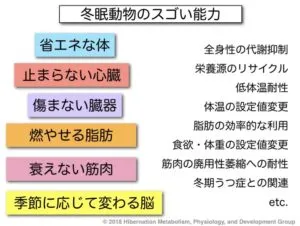
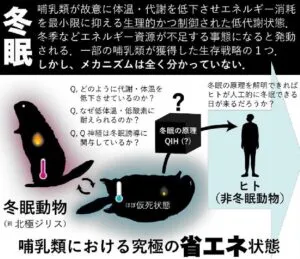
哺乳類の冬眠は、低体温・乾燥・飢餓等の極限状態を全身性の代謝抑制と低体温により乗り切る生存戦略である。ヒトをはじめ多くの哺乳類は冬眠できないが、クマやリスなど一部の哺乳類は冬眠を行うことができる。こうした「冬眠動物」は、ヒトなどの非冬眠動物とは異なり、長時間の低体温による傷害やそこからの復温過程で生じうる組織障害に対しても耐性を有している。また、冬眠に伴う長時間の不動状態で生じる筋廃用萎縮などにも、冬眠動物は冬眠しない人などの哺乳類に比べ耐性を有するとされている。さらに冬眠動物は、冬眠に伴う食欲・体重の季節性変動、貯蔵脂肪の効率的燃焼、季節の長さを感知する計時能力など、興味深い多くの形質を備えている。
シマリスは、秋から冬にかけて冬眠可能な状態に体を作り替えることが示唆されている。
http://www.lowtem.hokudai.ac.jp/hibernation/styled/
参:冬眠できる生物
変温動物ある蛇や亀、カエルなどの爬虫類や両生類は自分で体温の調節ができないため冬になると冬眠する。
自分で体温調節ができる哺乳類も18目約4070種のうち、7目183首が冬眠することが知られている。
例:ハリモグラ、フクロヤマネ、チロエオポッサム、テンレック、オオホオヒゲコウモリ、キクガシラコウモリ、カグラコウモリ、オヒキコウモリ、ハイイロショウネズミキツネザル、オジロプレーリードッグ、シベリアシマリス、ヒメポケットマウス、モリオナガネズミ、ヤマネ、アナグマ、ツキノワグマ、ホッキョクグマ、プレーリードック
鳥類は基本的に冬眠しないが、アフリカに生息するプアーウィルヨタカはできる。
人工冬眠技術
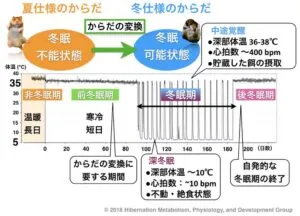
我々は、2020年6月に、マウスの脳神経の一部を刺激し、通常は冬眠しない動物を冬眠状態にできたのは今回が初めてで、実験に使ったマウスは体温と代謝が数日間にわたって低下しており、冬眠に似た状態を作り出すことに成功したと発表した。
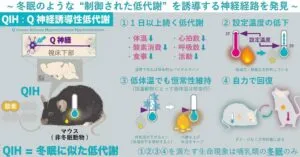
一般的に哺乳類は、体温の設定温度である37℃前後を保とうとする。体温が下がるとエネルギーを消費して発熱する。だが、陶器や飢餓などの危機的状況では意図的に代謝を下げることでエネルギー消費を抑えて生存するシマリスやヤマネなどの種が存在する。この低温代謝状態は休眠と呼ばれ、24時間以内の休眠は日内休眠、季節性かつ1日以上続く休眠は冬眠と呼ばれる。この冬眠に似た状態を作り出す神経細胞群を『Q神経:Quiescence-inducing neurons』と名付けた。
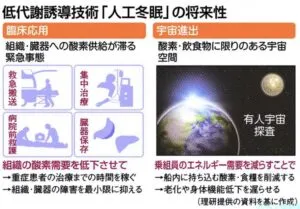
もしヒトにも人工的に冬眠に似た状態を作り出すことができれば、救急搬送や集中治療、全身麻酔、臓器保存、再生医療といった臨床の現場での応用が広がる。
冬眠中の動物は正常時と比べて数%まで酸素消費量が低下し、外気温よりも数度高い程度の低体温を呈するが、何ら組織障害を伴うことなく自発的に元の状態に戻る。
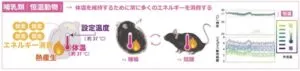
視床下部の一部の小領域に存在するQRFP(Pyroglutamylated RFamide peptide)という神経ペプチドを発現する神経細胞群(Q神経)を興奮させると、マウスの体温・代謝が数日間にわたって著しく低下することを発見した。このQ神経を刺激することにより生じる低代謝をQIH(Q neuron-induced hypometabolism)と名付けた。
QIH中のマウスは動き・接触がほぼなくなり、体温セットポイントが低下した。行動解析・組織学的解析では、QIHの前後で異常が見られず、極めて冬眠に似た状態であった。さらに休眠しない齧歯類の一種であるラットのQ神経を興奮させたところ、マウスと同様に長期的可逆的な低代謝が確認された。
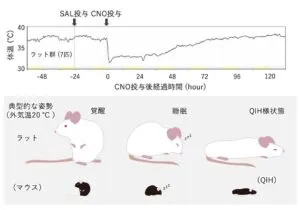
Q神経を特異的に興奮させると体表温度を23度に固定した時に、この温度近くまで低下する。下の図の上段に示されているように刺激開始後30分で、尾から発熱をして、体表温度が31まで低下する。これは体温のセットポイントが低下していることを示唆している。下段のグラフは、Q神経を得意的に興奮させQIHを誘導した時の体温及び酸素消費の刑事的変化である。対照群、QIH群ともに複数個体の平均値を示している。グラフの通り、通常時では体温は非常に狭い範囲かつ37℃の高い温度で常に一定に保たれている(恒温性)。QIH群マウスはCNOという薬物に応答する受容体をQ神経に発現させており、CNO投与によりQ神経が興奮するが、対照群では興奮しない。QIH群ではCNOを投与してから数日間にわたって体温のみならず酸素消費の著しい低下が認められる。SAL(生理食塩水)投与では両群とも特に変化はみられなかった。

動物における体温制御は、体温のセットポイントよりも低くなると酸素を消費して発熱し、セットポイントの温度に戻すようになっている。様々な外気温で体温と酸素消費量を計測することで、動物の体温セットポイントを推定することができる。QIHでは体温セットポイントが正常時と比較して約9℃低下し、37℃よりも低い状態に保とうとする。マウスやラットのような非冬眠動物でもセットポイントを下げることができるということは、体温を37℃よりも低く保つ機構が哺乳類に広く見られる可能性が示されたことになる。
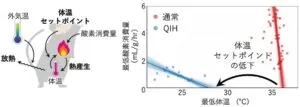
参:セットポイントいかに外気温が低下すると体を動かし熱を産生して、低く設定された低体温を維持しようとする。(https://www.riken.jp/press/2020/20200612_1/index.html)
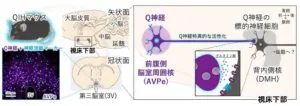
Q神経はマウス脳内の視床下部の前方腹側第3脳室の周り(AVPe)に分布しており、QIH状態にマウスにおいては約90%のQ神経が活性化している。マウス視床下部・矢状面において、Q神経は視床下部背内側核(DMH:体温制御、特に熱産生に重要だと知られている能部位)に軸索を送り、DMHの標的神経細胞にグルタミン酸などの神経伝達物質を放出し、QIHを誘導する。
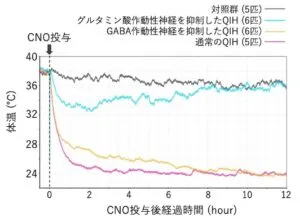
Q神経を興奮させるとQIHが生じて数日間に及ぶ低体温状態となる。Q神経におけるグルタミン酸あるいはGABAの放出を抑制すると異なる結果が生じる。水色のグルタミン酸が抑制されたマウス群の体温は約4℃低下するものの、約12時間後には黒の対照群と同程度まで戻る。一方、オレンジ色のGABAが抑制された群では、ピンク色の通常のQIH群と同様に急速な体温低下を示すが、QIH群よりも数度体状態が数時間維持される。しかし、Q神経活性化後約半日経過すると通常のQIH群と同程度の体温となる。
これらの結果は、QIH誘導・維持においてQ神経由来のグルタミン酸放出が不可欠であること、グルタミン酸、GABAの両方がQIH誘導にかかわっていることを示唆している。
なおQRFPペプチド自体はQIH誘導にかかわらないことは判明している。
ラット脳視床下部AVPeのQ神経を含む神経を特異的に興奮させたときのラット体温の経時変化は、低体温・低代謝状態が数時間に及んで維持されるので、この状態をQIH様状態と名付けた。QIHと同様に約3日後には正常状態にまで体温が回復する。
QIH誘導時、マウスは体を伸ばし不動状態を示すが、ラットも同様な姿勢を示す。マウス、ラットなど齧歯類は、外気温が高いときに、放熱を促すためにこの姿勢をとると一般的に考えられている。外気温が20℃台に固定されているにもかかわらず進展姿勢をとることは、通常よりも体温セットポイントが低下したことを示唆する。ラットは休眠動物ではないことに加え、マウスよりも10倍程度大きい身体を持つもののQIHに酷似した代謝的・身体的特徴をしめした。この結果は、Q神経は哺乳類において広く保存されている神経であり、冬眠・休眠できない哺乳類でも冬眠様状態に入ることができる可能性を示唆している。
哺乳類は高温性を維持するためのエネルギー・コストを常に死はなわなければ生存できない。冬眠できる哺乳類は自らの体温と代謝を下げ、生理的な低代謝となり恒温動物であるが故の多大なエネルギー消費を最小限に抑えることができる。この“省エネ”機構により冬眠動物は、冬や飢餓といった自然界における過酷な環境を生き延びることができる。非冬眠動物におけるQ神経・冬眠用低代謝状態QIHの発見は、これまで全く不明であった冬眠誘導メカニズムの解明に向けて重要なカギとなりえる。今後ヒトにおいてQ神経の存在が証明され、ヒトQ神経を人為的に活性化させる技術が開発された場合、ヒトの人工冬眠が現実味を帯びてくる。人工冬眠という低代謝誘導技術は、人体の臓器・組織が低栄養に陥る緊急事態や酸素・飲食物が限られる地球外環境において、多大な恩恵を人類にもたらす可能性がある。重傷を負った患者を搬送する際、治療開始までの時間を稼がなければならない危機的状況において、人体の酸素・エネルギー需要を安全に低下させ、臓器・組織が受けるダメージを最小限に食い止めることで、今までは救えなかった命を救える可能性がある。

https://wpi-iiis.tsukuba.ac.jp/uploads/sites/2/2020/06/202006110000-2.pdf
マウスを冬眠状態にする神経回路の発見:砂川玄志郎研究員作成動画
https://www.riken.jp/press/2020/20200612_1/index.html
























