川村所長の勉強会参加記録
2022.11.16
イメグリミンのグルコース濃度依存性インスリン分泌促進作用について 吉田昌史先生
2022年10月28日
演題「イメグリミンのグルコース濃度依存性インスリン分泌促進作用について~他剤との併用効果を考える~」
演者: 自治医科大学付属埼玉医療センター内分泌代謝科講師 吉田 昌史 先生
場所: TKPガーデンシティPREMIUM 横浜ランドマークタワー バンケットルームA
内容及び補足「
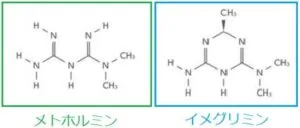
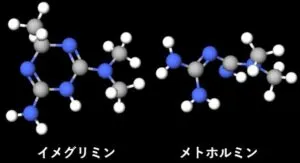
参:ツイミーグ構造:下図のようにイメグリミンの構造はメトホルミンとよく似ている。
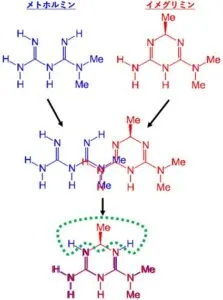
実際に両者を重ねてみると緑の点線内の違い以外は全く一緒である。
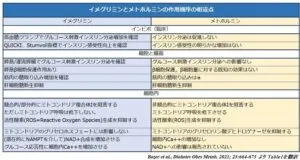
しかし、両者では異なる部分も少なくなく、その違いが下記の論文にまとめられている。
https://shiranenozorba.com/2021_10_09_imeglimin-launched7/
Diabetes Obes Metab. 2021; 23:664-673
https://dom-pubs.onlinelibrary.wiley.com/doi/pdfdirect/10.1111/dom.14277
しかし三次元構造を見ると、両者はかなり異なっていることがわかる。
https://shiranenozorba.com/2021_10_09_imeglimin-launched7/
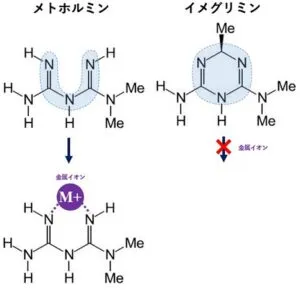
メトホルミンは3つの窒素原子と二つの炭素原子からなる分子の中心部が、馬蹄形に開いており、ここに金属イオンがすっぽりと収まって錯体化合物を作ることが可能であるが、イメグリミンは、そこが環状に閉じているので金属イオンが入り込めない。
メトホルミンはこの馬蹄形のポケット部分に、金属イオンを取り込んでいろいろな金属錯体を作ることが可能である。マンガン、鉄、銅、亜鉛、マグネシウムなどと結合できる。亜鉛との錯体化合物は強い抗菌性・抗真菌性が認められる。(Journal of Thermal Analysis and Calorimetry volume 111, pages2079–2096 2013)
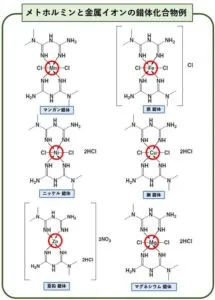
J Therm Anal Calorim (2013) 111:2079–2096
https://link.springer.com/article/10.1007/s10973-012-2459-3
しかし、イメグリミンには、こういった形態で金属イオンを取り込めないので、当然生体内においての働きが異なってくる。
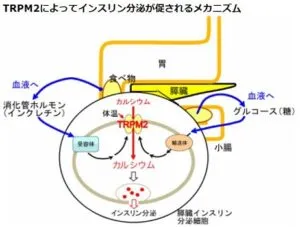
グルコース依存性インスリン分泌とは?
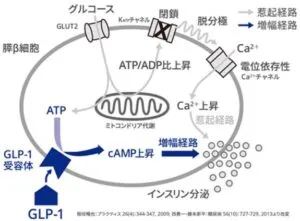
グルコースは脂質二重膜を通過するためグルコース輸送担体(GLUT:Glucose transporter)を介して、膵ベータ細胞に取り込まれ、解糖系、ミトコンドリアでの代謝を受け、細胞内ATP濃度が上昇する。細胞内ATP/ADP比の上昇は、ATP感受性K+チャンネルの閉鎖をもたらし、細胞膜電位が上昇し、脱分極する。その結果、電位依存性Ca2+チャンネル(VDCC)が開口し、細胞外からCa2+が細胞内に流入する。細胞内Ca2+濃度の上昇はインスリン分泌顆粒の開口放出をもたらし、血中にインスリンが分泌される。
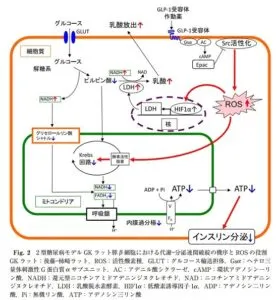
非肥満型2型糖尿病モデルのGK(後藤-柿崎)ラットでは、膵ベータ細胞からのインスリン分泌が、高濃度グルコース刺激に対して低下しているものの、グルコース以外の脱分極刺激(アルギニンや高濃度K+など)に対してはむしろ亢進していて、2型糖尿病にみられるインスリン分泌動態と酷似していることが知られている。GKラット膵ベータ細胞からのグルコースに対する選択的なインスリン分泌不全は、KATPチャンネル自体の異常ではなく、細胞内のグルコース代謝障害に基づくATP産生障害が原因であり、この代謝障害によりKATPチャンネルの閉鎖不全、細胞膜脱分極効果の減弱、VDCCの開口不全、Ca2+流入の減少、ひいてはインスリン分泌不全が起こる。2型糖尿病患者の膵島においても高濃度グルコースに対する細胞内ATP濃度上昇の減弱が見られることが報告されており、膵ベータ細胞における代謝―分泌関連の破綻が、2型糖尿病におけるグルコースによる選択的なインスリン分泌障害の機序と考えられる(imoto S, Mukai E, Inagaki N (2011) Role of endogenous ROS production in impaired metabolism-secretion coupling of diabetic pancreatic β cells. Prog Biophys Mol Biol 107: 304-310)。
膵ベータ細胞には抗酸化酵素の発現がなく、酸化ストレスに対して脆弱である。2型糖尿病患者やGKラットの膵島を組織学的に検討すると酸化ストレスマーカーが染色されインスリン分泌障害への関与が示唆される。
膵ベータ細胞には、非受容体型チロシンキナーゼであるSrc活性化に起因する活性酸素種(ROS)産生機構が存在する。GKラット膵島では内因性Srcは活性化しており、Src活性化はROS過剰産生をきたし、Krebs回路での代謝を抑制することでグルコースによるATP産生を阻害し、インスリン分泌障害をきたす。GLP-1受容体作動薬はcAMP上昇をきたし、Epacを介してSrc活性化及びROS過剰産生を抑制し、代謝―分泌関連を改善する(imoto S, Mukai E, Inagaki N (2011) Role of endogenous ROS production in impaired metabolism-secretion coupling of diabetic pancreatic βcells. Prog Biophys Mol Biol 107: 304-310)。GKラット膵島における乳酸脱水素酵素(LDH)活性亢進は、通常低酸素化で安定化し活性が亢進する転写因子である低酸素誘導因子1アルファ(HIF-1アルファ)がROS過剰によって安定化し、LDHの発現を増強させることが一因と感がられる。LDH活性の亢進は乳酸産生亢進をきたし、ATP産生抑制の一因となる。
https://www.jstage.jst.go.jp/article/tonyobyo/59/5/59_322/_pdf/-char/ja
グルコース代謝によるATP産生増加(ATP/ADP比上昇)の結果、KATPチャンネル閉口による膜脱分極がCa2+チャンネル活性化によるCa2+流入を刺激し、インスリン開口放出を刺激する。TRPM2は生理的濃度のGLP-1(<100pM)により受容体刺激とcAMP、EPAC2刺激を介して開口し、膜をより強力に脱分極する。高濃度のGLP-1(10nM)はcAMPを介してインスリンの開口放出に作用し、PKAの作用も関与すると思われるが、低濃度のGLP-1によるTRPM2刺激作用にはPKAは関与しない。
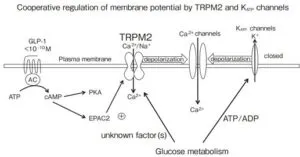
https://www.jstage.jst.go.jp/article/jse/38/2/38_142/_pdf/-char/ja
グルコース依存性インスリン分泌とは『血糖値の上昇に伴ってインスリン分泌が増加すること』と定義される。血統の上昇を感知し、早期にインスリンが分泌すれば血糖値の上昇はさほどきたさない状況においてインスリンの効果が見られる。インスリンの効きが悪かったり、スバやインスリンの分泌が障害されていたりすると、血糖値は上昇し続け、その結果インスリンの分泌量は多くなる。従って、グルコースを負荷した際に、インスリンの総追加分泌量は正常の場合場が一番少ないことになる。
講演で提示された『J Clin Endocrinol Metab. 1976 Feb;42(2):222-9.』の血糖とインスリンの変化の図が入手できないので下図を参考に提示する。
参:正常型、境界型、糖尿病型の血統変化及びインスリンの変化を図示したグラフである。
正常型の血糖の上昇も少なく耐糖能の以上の程度に応じで血糖値は高値となる。
インスリンの上昇は、当代謝の異常が少ないほど立ち上がりが急で、高値になる前に低下する傾向があり、インスリンの効きが良く、早期に血糖の上昇を抑えコメ、分泌量が少なくて済んでいると言える。
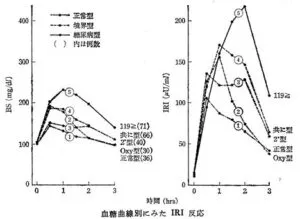
https://www.jstage.jst.go.jp/article/tonyobyo1958/13/3/13_3_264/_pdf/-char/ja
参:
糖代謝に問題がない症例においては、糖負荷による(下図の場合はグルカゴン負荷による)血糖の上昇を感知して膵ベータ細胞からインスリンが急激に分泌されて、血糖の上昇を抑え込む。糖尿病症例においては、血糖値の上昇に対応する急峻なインスリン分泌が障害しており、血糖値が時間とともに上昇することになる。ツイミーグの一つの効果は、この急峻なインスリンの分泌量が低下している症例において、この部分のインスリンの分泌量を増価させる。
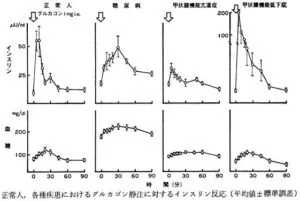
https://www.jstage.jst.go.jp/article/tonyobyo1958/19/1/19_1_125/_pdf
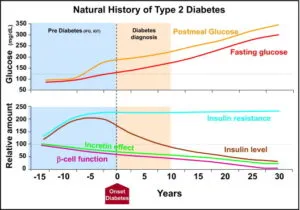
糖尿病は、発病する10年以上前から膵β細胞機能が低下し、発病の数年前からインスリンの過剰分泌においても血糖の上昇に対応しきれなくなり、食後血糖値の上昇がみられ、ついに空腹時血糖値も上昇して、糖尿病発病となり、その後も徐々にインスリンの分泌脳が低下してくる進行性の疾患である。
膵臓ベータ細胞の インスリン分泌については1984年以来、グルコースがベータ細胞で代謝され、ATPが産生されATP感受性K+チャンネルが閉鎖し、膜の脱分極が起こり、Ca2+チャンネルが開き、細胞外から流入するCa2+が引き金になりインスリンが分泌されると考えられてきた(Nature 312, 446-448 1984)。岡本らは、下図の赤で示したようにATPがCD38 に作用し、細胞内にcADPRが蓄積し、これが細胞内Ca2+プール、小胞体に作用して、小胞体からCa2+が放出されインスリンが分泌されると考えられた(Diabetologia 40, 1485-1491 1997) 。
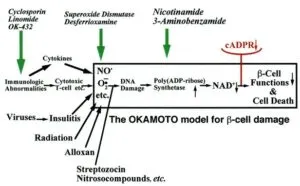
CD38は300アミノ酸からなり、リンパ球の表面光源として認識されていたが、下図のようにNAD+からcADPRを合成し、さらにcADPRをADP-リボースに水解する2つの酵素活性を有していることが明らかとなった(J Biol Chem 268, 26052-26054 1993) 。
ATPはcADPR hydrolase活性を気質であるcADPRと競合的に阻害する。CD38 によってNAD+からcADPRが作られ、CD38 の129番目のLysを中心とする部位をATPが占拠すると、cADPRはCD38に結合でキス、蓄積することになる。
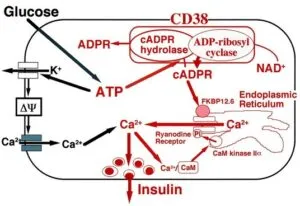
グルコース刺激により作られたcADPRが小胞体のリアノジン受容体にassociateしているFK506 binding protein 12.6 (FKBP12.6)と結合すると受容体が活性化されCa2+が放出される。
Folia Pharmacol Jpn 114, 131-139 1999
https://www.jstage.jst.go.jp/article/fpj1944/114/3/114_3_131/_pdf/-char/ja
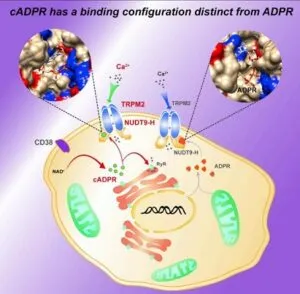
Cell Report 2019 27 3684-3695
https://www.sciencedirect.com/science/article/pii/S2211124719306965
参:メタボ食により肥満したマウスは、遊離脂肪酸のベータ酸化が亢進し、ミトコンドリアの複合体1が活性化され、活性酸素の発生が多くなり、これがインスリン抵抗性の増大/耐糖能の悪化を招いている。
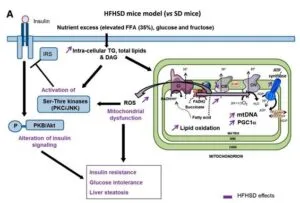
イメグリミンを投与すると、ミトコンドリアの複合体1の活性は抑制され、その代わりに複合体2がその役割を肩代わりして、結果として活性酸素増大を防いで耐糖能を改善する。
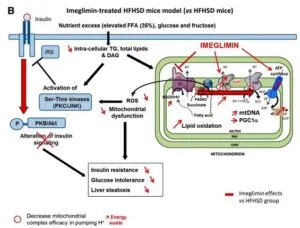
Diabetes 2015 64 2254-2264
参:ミトコンドリアは直径0.5~1㎛の細胞小器官で、細胞全体の10~20%を占めている。きわめて運動性の高い細胞小器官で、細胞質内を微小管に沿うように移動したり、エネルギー(ATP) 消費量が多い部位に局在していたり、ミトコンドリア同士で融合や分裂をし常に柔軟に変形していることが報告されている。生体内の主な活性酸素種発生源はミトコンドリアであると考えられており、生体内の約95%を消費し、そのうち1~3%が活性酸素種に変換されると推測され、また、生体内で生じるスーパーオキシドの約90%はミトコンドリアで発生していると推測されている。
ミトコンドリア内膜上にある呼吸鎖複合体において、酸化還元反応を利用したエネルギー代謝により、ATPを産生している。複合体1ではNADH、複合体2ではコハク酸をそれぞれ酸化することで、ユビキノンを還元してユビキノールにし、複合体3でユビキノールを酸化することでシトクロムCを還元する。複合体4でシトクロムCが酸化され、酸素分子に電子を伝達することで水に還元する。この過程でミトコンドリア内膜を隔ててH+勾配が生じ、このH+勾配を駆動力としてATPを合成する。電子伝達の際に、複合体1や複合体3から漏れ出した電子によって、酸素分子が一電子還元され、スーパーオキシドが発生する。ミトコンドリア膜間腔側に発生したスーパーオキシドはSOD1、マトリックス側に発生したスーパーオキシドはSOD2が酸素と過酸化水素に不均化し、過酸化水素はグルタチオンペルオキシダーゼやペルオキシレドキシンによって水へと還元される。
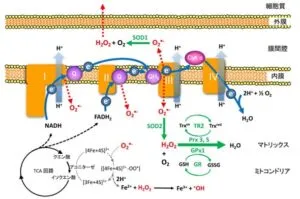
ミトコンドリアにおける活性酸素種の発生と消去:活性酸素種は赤、抗酸化酵素は緑、NADHやFADH2からの電子の流れは青で示す。
SOD:スーパーオキシドジムスターゼ、TrxOx:酸化型チオレドキシン、TrxRed:還元型リオレドキシン、Prx:ペルオキシドレキシン、TR:チオレドキシンリダクターゼ、GPx:グルタチオンペルオキシダーゼ、GSH:還元型グルタチオン、GR:グルタチオンリダクターゼ、O2・-:スーパーオキシド、H2O2:過酸化水素、・OH:ヒドロキシラジカル、神経変性疾患におけるミトコンドリア異常と凝集体形成 臨床病理64(10)2016
https://www.toho-u.ac.jp/sci/bio/column/0790.html
参:
NAD:ニコチンアミド、アデニンジヌクレオチド
CD38 :NADを分解する酵素
TRPM2(Transient Receptor Potential Melastatin 2)は細胞内にADP-ribose(ADPR)を導入することにより活性化される。
活性酸素種の一つであるH2O2を細胞外から添加することによりTRPM2が活性化される。また、細胞内で産生されるヒドロキシラジカルを消去すると、H2O2によるTRPM2活性が焼失することから、H2O2によるTRPM2活性は細胞内で生じたヒドロキシラジカルを介していると考えられる。細胞内においてADPRは、H2O2刺激によって核及びミトコンドリアから産生されること示されている。ミトコンドリアにおけるADPR産生は、NAD+をnicotinamideとADPRに代謝するpoly ADPR polymerase-1(PARP-1)やNAD+ glycohydrolaseを介しているようであるが、詳細は明らかでない。
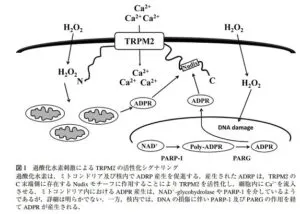
https://www.jbsoc.or.jp/seika/wp-content/uploads/2013/05/83-12-04.pdf
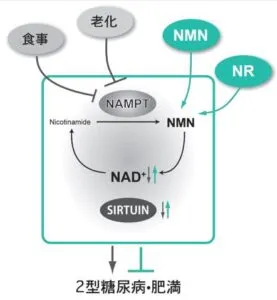
参:NADは全身の様々な臓器・組織において加齢とともに低下してしまうことが最近の老化・寿命研究によって青木らかになってきた(Cell Metab., 2018; Imai & Guarente, npjAMD, 2016)。
NAD低下の原因は、NAD合成の低下とNAD消費の増大のいずれかあるいはその組み合わせによっている。
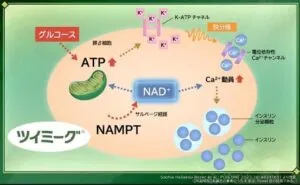
哺乳類においてNAD合成の主な経路は、NAMPT(nicotinamide phosphoribosyltransferase)によって制御される。NAMPTはニコチナミドをNMN(nicotinamide mononucleotide)に変換し、別の酵素によってNADに変換される。
NAMPTはNAD合成の中間体であるNMNを作り出すことによりNAD産生の制御を行う重要な酵素である。従ってNAMPTは、NAD合成を促進することによりNAD依存存性蛋白脱アセチル化酵素であり哺乳類サーチュインの主要な一員であるSIRT1の活性を増大させる(Revollo et al. JBC, 2004)。また、NMNには非常に顕著な功労化作用があることが明らかになっている(Mills et al. Cell Metab. 2016)。
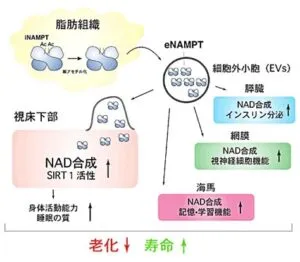
https://www.amed.go.jp/news/release_20190614.html
NAD+の合成
哺乳類におけるNAD+合成の基質としてはtryptophanおよび水溶性ビタミンB3として総称されるnicotinamideとnicotinic acid、そしてnicotinamide siboside(NR)が知られている。このうち、哺乳類はnicotinamideを主要な基質として、そこから二段階の酵素反応を経てNAD+を合成する。
第一段階では、nicotinamide phosphoribosyltransferase(NAMPT)と呼ばれる酵素が、nicotimaideと5’-phosphoribosyl-1’-pyrophosphate(PRPP)からNAD+合成系の重要な中間代謝産物であるnicotinamide mono-nucleotide(NMN)を合成する。
次いでNMNとATPは、第二の酵素であるnicotinamide/nicotinic acid mononucleotide adenylyltansferase(NMNAT)によって、NAD+へと合成される。また、NRはnicotinamide siboside kinase(NRK)によりNMNへと変換された後、NMNATによりNAD+へと合成される。
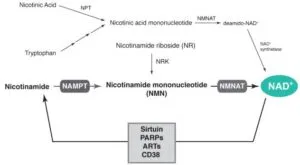
NAMPT:哺乳類における主要AND+合成経路の第一酵素であるNAMPTは、二量体を形成する2型ホスホリボシルトランスフェラーゼに属し、nicotinamideへの基質特異性が極めて高く、nicotinamideに始まるNAD+合成系における律速酵素として機能している。このNAMPTには細胞内型NAMPT(intracellular NAMPT:iNAMPT)と細胞外型NAMPT(extracellular NAMPT:eNAMPT)の二つの方が存在する。eNAMPTは成熟した脂肪細胞、肝細胞、白血球細胞から分泌され、サイトカイン、ホルモン用に血中をめぐることが報告されている。特に脂肪細胞から分泌されるeNAMPTはいNAMPTn位比して高い酵素活性を有している 。
高脂肪食負荷による2型糖尿病モデルマウスにおいて、通常食負荷マウスに比して、肝臓、白色脂肪組織中のiNAMPTのたんぱく質、NAD+量が有意に低下し、二型糖尿病発症の一因となっている(Cell Metab. 14, 528 2011)。
NMNAT:第二の酵素であるNMNATには、細胞内局在の違いによりNMNAT1(核)、NMNAT2(細胞質)、NMNAT3(ミトコンドリア)の3つの方が存在する。
CD38:多機能性タンパク質である膜貫通型酵素CD38は、細胞内Ca“+動員メッセンジャーであるcyclic ADP riboseを合成し、かつ加水分解する酵素として知られている。そして同時にNAD+を加水分解し、nicotinamideとADPriboseを産生する酵素活性を有する。そのため、Cd38 ノックアウトマウス(CD38KO)では、主要臓器で著名な組織NAD+量の増加、SIRT1活性の亢進が認められる。CD38KOは、エネルギー消費を亢進し、高脂肪食負荷に伴う体重増加、耐糖能障害に対して耐性を示す(: FASEB J. 21, 3629 2007)。この効果は、SIRT1-PGClaの活性上昇によるミトコンドリア機能の亢進を介していることが示されている。また興味深いのは、CD38KOは、一日を通した恒常的なNAD+量の増加に伴い、時計遺伝子や代謝関連分子の遺伝子発現パターン、行動様式や種々の血清アミノ酸地の日内変動にも変調をきたすことが報告されている(:Aging(Albany, NY), 3, 794 2011)。
NMN:高脂肪食負荷により、主要代謝臓器においてiNAMPT/NAD+合成系が低下するという結果から、吉野らはNAMPTの酵素反応産物であるNMNを利用して糖尿病マウスのNAD+合成系の回復を試みた。NMNの腹腔内投与(500㎎/㎏マウス体重/日)により、高脂肪食負荷糖尿病マウスの肝臓、脂肪組織においてNAD+量の回復が認められ、耐糖能の有意な改善も認められた(Cell Metab.14, 528 2011)。さらに興味深いのは、糖尿病雄マウスにおいて。グルコース依存性インスリン分泌をを促進するのに対し、雌マウスではインスリン感受性を改善し耐糖能を回復させたことである。このことはNMNの主要作用部位が雌雄で異なることを示している。
NR:NRは2004年にBrennerらによって同定された比較的新しいNAD+代謝産物である。公募から哺乳類にかけて広範な種でその存在が確認されており、特に公募においてのその成果顎堤性質が解析されている。NRもNMN同様に、哺乳類において細胞内NAD+量を上昇させる。NRの投与によりエネルギー消費が亢進、し高脂肪食に伴う肥満を予防し、耐糖能、インスリン感受性、血中コレステロール値が改善される。このNRの効果は、筋肉、褐色脂肪細胞でのミトコンドリア機能あるいは参加能力の促進がその作用機序として考えられている(Cell Metab. 15, 838 2012)。
https://www.jstage.jst.go.jp/article/kagakutoseibutsu/51/3/51_147/_pdf
イメグリミン(ツイミーグ)の作用機序
NAD+は、生体の酸化還元反応において中心的な役割を果たす補酵素。
糖尿病においては、膵ベータ細胞のNAD+の量の減少が、インスリン分泌の低下につながると考えられている。
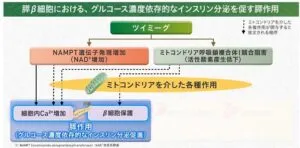
ツイミーグは膵ベータ細胞においてグルコース濃度依存性にインスリン分泌を促す。
NAMPT遺伝子発現増加とミトコンドリア呼吸鎖複合体1競合阻害の二つの作用を介していると推定されている。
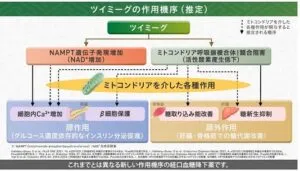
ツイミーグにより膵ベータ細胞内のNAMPT遺伝子発現が増加し、それに伴いNAD+濃度が増加し、細胞内Ca2+が増加する。また、NAMPT遺伝子発現の増加は、ミトコンドリアを介した各種作用により細胞内のCa2+を増加させることも推定されている。
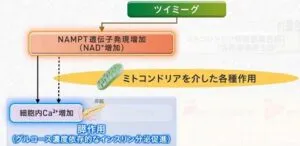
また、ミトコンドリア呼吸鎖複合体1の競合阻害により、活性酸素の産生が低下し、カルシウムイオンの細胞質への流入が増加すると推定されている。そのほかにミトコンドリアを介した膵ベータ細胞の保護作用も認められている。
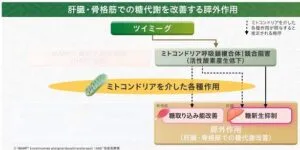
肝臓においてツイミーグは、ミトコンドリア呼吸鎖複合体1の競合阻害にと、ミトコンドリアを介したインスリンシグナル障害の改善などにより、糖新生抑制作用を示す。
また、骨格筋において、ツイミーグによるミトコンドリアを介したインスリンシグナル障害の改善によると考えられる糖の取り込み能の改善作用も認められている。
https://sumitomo-pharma.jp/information/twymeeg/useful/about/about03.html
インスリンは、膵ベータ細胞において血糖依存性にインスリン分泌顆粒を開口放出するジャッキ経路と、その放出を増強する増幅経路が相まって分泌される。GLP-1は増幅経路に働き、血糖依存性のインスリン分泌を増強する。
TRPM2欠損マウスを用いた実験では、インスリン分泌低下を伴う血糖調節異状が示された。
TRPM2欠損マウスでは、普通のマウスと比べ、グルコースを与えたときの血糖値の上昇が1.5倍程度に上昇した。また、TRPM2欠損マウスではインスリン分泌は普通のマウスの半分以下だった。TRPM2欠損マウスでは、普通のマウスと比べて、グルコースやインクレチンを与えても、インスリン分泌はそれほど増えなかった。
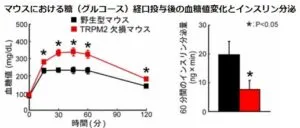
TRPM2分子センサーは、糖の刺激やインクレチンの刺激によるインスリン分泌の両方にかかわっていると考えられる。
Diabetes 2011;60(1):119–126
小胞体からのCa2+の放出はインスリン顆粒を膜直下に移動させる働きを担い、膜電位依存性Ca2+チャンネルからのCa2+の流入は移動したインスリン顆粒を押し出す働きをしていると感がえられる。
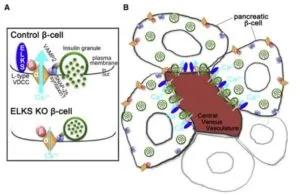
https://mrp.carenet.com/d/mrpview/7429?linkfrom=rmenu_recommenda
膵臓のベータ細胞は血管内宮に向けてインスリンを放出している。下図の青い細長い害構造ELKSは電位依存性Ca2+チャンネルにくっついている。
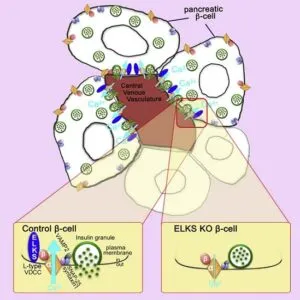
Cell Reports 29 January 2019, 26 1213-1226
https://www.sciencedirect.com/science/article/pii/S2211124718320813
日本人二型糖尿病患者299例を対象としたツイミーグの500㎎、1000㎎、1500㎎の三用量を経口投与した時の24週間後のHbA1cの変化量は、プラセボ軍で0.43%、ツイミーグ500㎎(1日2回)群で‐0.09%、1000㎎ (1日2回)群で‐0.51%、1500㎎(1日2回)群で‐0.57%であり、プラセボに比較して、いずれの容量群においても有意に低下した。
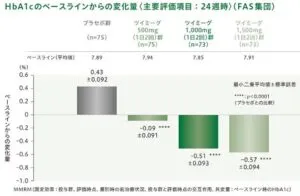
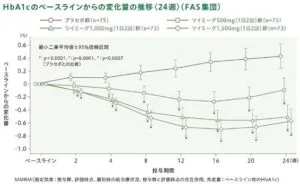
HbA1cのベースラインからの変化量の推移は下図ようなの経過であった。1回1000㎎以上の一日二回投与では、二週間後から有意差が認められている。
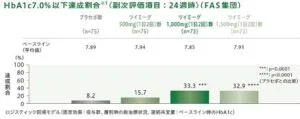
24週間後のHbA1c7%未満の達成割合は、1日1000㎎一日二回以上で33.3%、32.9%であり、プラセボ群と比較して有意差を認めた。
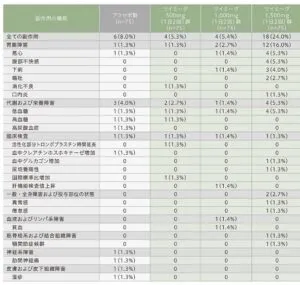
安全性解析対象299例において、プラセボ群8.0%(6/75)、500㎎群5.3%(4/75)、1000㎎群5.4%(4・74)、1500㎎群24.0%(18/75)であり、1500㎎でおしん、腹部不快感、低血糖で有意差を認めた。
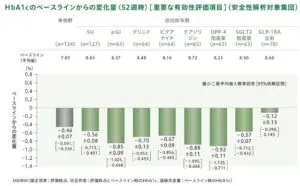
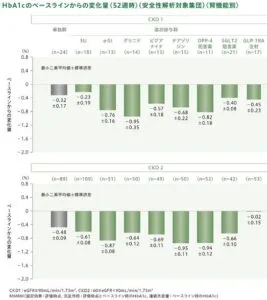
日本人2型糖尿病患者を対象としたツイミーグ1000㎎を一日二回単独投与、または他の血糖降下薬との併用(長期併用投与)で52週間経口投与したTIMS2試験の結果は、下図の通りであった。GLP-1RA以外の薬剤で併用による効果の増強が見られた。構造が似ているSU薬においても、併用による増強効果が見られた。
しかし、機序的に血糖低下作用が似ているDPP-4阻害薬とGLP-1RAの効果において顕著な差が見られている。
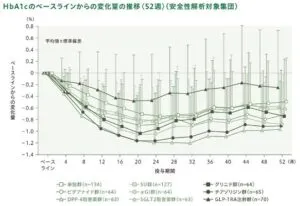
参:HbA1cのベースラインからの変化量の推移は下図の通りであった。
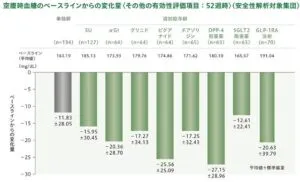
投与52週時に時における空腹時血糖のベースライン化の変化量は下図の通りである。
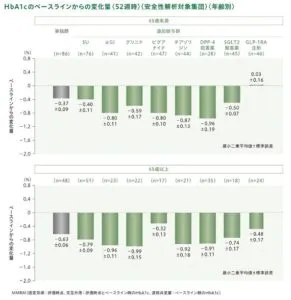
投与52習字における年齢別・腎機能別のHbA1cのベースライン化の変化量は以下のとおりである。
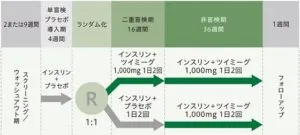
インスリン治療による血糖コントロールが不十分な日本人二型糖尿病患者を対象として、ツイミーグ1000㎎を一日二回経口投与とインスリンを併用投与した時、投与16週後のHbA1cの改善をインスリン単独投与と比較したTIMES3試験は下図のように行われた。
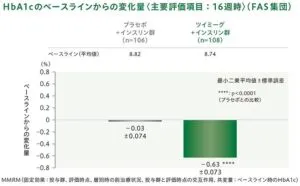
投与16週時におけるHbA1cのベースラインからの変化量は‐0.03%vs-0.60%と有意に改善していた。つまり、インスリンを追加投与することにより、糖代謝は有意に改善している。
https://sumitomo-pharma.jp/information/twymeeg/useful/clinical/clinical04.html?imid1=history
トルブタマイド存在下において
GLP-1作動性薬剤を使うとTRPM2を介した効果が最大限におきるため、ツイミーグとの併用においては、相加・相乗効果はほとんど認められないが、DPP-4阻害薬においては、 TRPM2を介した効果は限定的なため、ツイミーグの併用においては相加・相乗効果が認められたと考えられる。
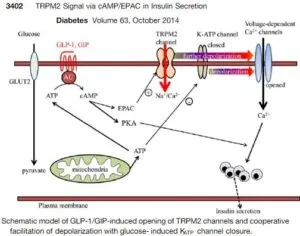
diabetes 2014 63 3394-3403
理想的なツイミーグの使用方法
ツイミーグが存在しないと、膵ベータ細胞においてATP上昇し、インスリン分泌が起こるまで6分以上かかる。スイミー具が存在するとすでにKAPTaseが不完全閉口しており、血糖が上昇するまでにすでにインスリン分泌が準備されている状態にあり、血糖上昇時のインスリン分泌反応が良好になる。空腹時血糖が高値だと、ツイミーグのこの効果は減弱する。従って空腹時血糖値が上昇する以前の糖尿病早期の投与導入が理想的といえる。
初診患者、HbA1cが7%超えてきた無償乗車、長期通院患者、他剤治療がうまくいかない難治の患者の場合は、空腹時血糖値がある程度下がってきた後に投与るほうが良い。また、心不全患者においてはメトホルミンが投与できないが、ツイミーグの投与は問題ないのでそういった患者の投与も考慮すべきである。