川村所長の勉強会参加記録
2023.05.28
バイオ医薬の経口薬という夢を叶えたセマグルチド 武田真莉子教授
2023年5月18日
演題「バイオ医薬の経口薬という夢を叶えたGLP-1 アナログ製剤セマグルチド」
演者:神戸学院大学薬剤部 薬物送達システム学研究室教授 武田真莉子 先生
場所: ホテルアソシア新横浜
内容及び補足「
参:(本講演で使用された図表がなかなか探せなかったので、それに近いと思われるものをさがして使用しているところがあります。)
DDS:Drug Delivery System 薬物送達システム。薬物投与経路の最適化を目的とする医薬品の効果をよりよく発揮させるために設計された投与形態の総称。
吸収の過程の制御:吸収促進、放出家庭の制御:持続価、分布過程の制御:標的志向化に分けられる。
歴史としては下図のようにまとめられる。

https://www.yakuji.co.jp/entry8822.html
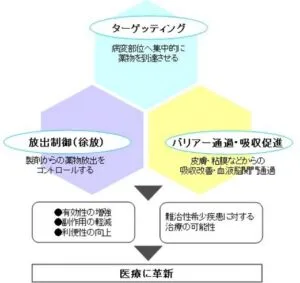
DDSの3大テクノロジー
- ターゲッティング(標的志向型)
受動的ターゲティング:薬物運搬体(キャリア―)の粒子径や親水性などの物理化学的性質を利用して薬物の体内動態を制御する方法
能動的ターゲティング:薬物運搬体に、特殊な仕組み(例えば抗体や踏査などを結合したキャリアーを利用)を付け加えて標的組織への嗜好性を制御する方法(ミサイルドラッグ)
- 放出制御:徐放(放出制御型DDS)
製剤からの薬物放出をコントロールする技術。薬物が病変部位に到達した時点で、薬物を放出する必要があり、薬物が溶け出すタイミングを投与してから経過時間によってコントロールすることを「放出制御」といい、目標とする病変部位で薬効が現れる濃度以上、毒性が現れる濃度以下の必要十分量の薬物を取り込めることが薬効を高めるうえで重要な要素となる。
リザーバー(拡散制御膜)型:薬物を包む高分子膜の薬物透過性により薬物透過量を制御する方法。
モノリシック型:薬物を高分子あるいは無機物マトリックス中に分散させることにより薬物の放出を制御する方法
- バリアー(障壁)の通貨・吸収促進(吸収制御型DDS)
皮膚・粘膜などからの薬物の吸収改善や血液脳関門通貨の技術。
https://www.yakuji.co.jp/entry8918.html
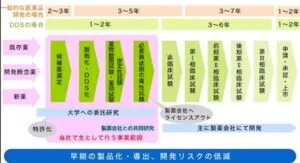
DDS製剤の開発は下記のような流れと期間を要する。
https://www.yakuji.co.jp/entry9089.html
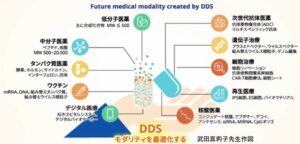
DDS戦略を考える際に、経口剤の場合には、消化管内に分泌されている酵素バリア、粘液菌バリア、細胞膜バリアが存在する。
経口セマグルチドであるリベルサスは吸収促進剤であるSNAC300㎎を製剤に含有するk10により経口投与が実現した。経口セマグルチド(リベルサス)は、1日1回投与により定常状態での血中濃度の変動を抑えることができる。本剤の崩壊は、セマグルチドが主に吸収される胃内で起こる。経口投与されたセマグルチドの吸収は、SNACにより促進され、SNACは胃内の㏗を局所的に上昇させ、たんぱく質分解酵素による分解からセマグルチドをほぼしている。
セマグルチドは、膵ベータ細胞上のGLP-1受容体に結合し、ATPからcAMPの産生を促進させることにより、グルコース濃度依存的にインスリンを分泌させる。さらに血糖値が高い場合にはグルカゴンの分泌を抑制する。
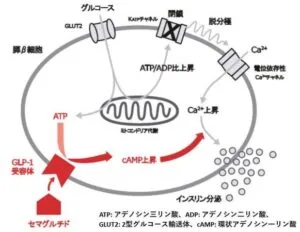
https://www.jstage.jst.go.jp/article/fpj/157/2/157_21052/_pdf
参:GIP(glucose-dependent insulinotropic polypeptide)は十二指腸に多く存在するK細胞から、GLP-1(glucagon-like peptide-1)は主に下部小腸や結腸に存在するL細胞から分泌されるが、両者とも、タンパク分解酵素であるDPP-4(dipeptidyl peptidase-4)により速やかに分解される。活性型GIPおよび滑石型GLP-1の血中半減期はそれぞれ約2分、約5分と短い。
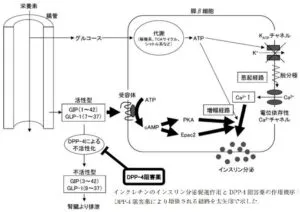
日薬理誌Folia Pharmacol Jpn 157 146-154 2022
https://www.yakuji.co.jp/entry9089.html
GLP-1は食事摂取後に主に小腸から分泌され、膵ベータ細胞膜の膵イクレチン受容体に結合し、膵ベータ細胞内cAMP濃度を上昇され、インスリン分泌を促進する。この作用は血糖依存的であり、低血糖時にはインスリン分泌を促進しない。
セマグルチドは、低血糖リスクが低く、良好な血糖改善が認められるGLP-1アナログ製剤である。DPP-4に対する安定性を向上させるために、アシル化技術により脂肪酸を付加し、またペプチド骨格のDPP-4切断部位を置換した構造となっている。
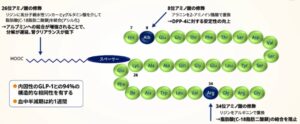
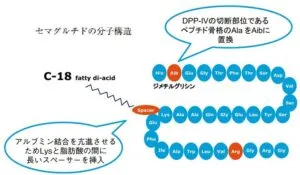
経口GLP1製剤と経口インスリン製剤の実用化への展望 糖尿病61 818-821、2018
https://www.jstage.jst.go.jp/article/tonyobyo/61/12/61_818/_pdf/-char/ja
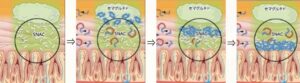
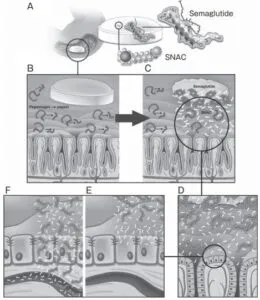
リベルサス錠が胃に到達すると、SNAC錠剤周囲の㏗を局所的に上昇させる。㏗が上昇すると胃での主要なたんぱく質分解酵素であるぺプシンの活性が抑制され、セマグルチドの分解が抑制される。そしてSNACはセマグルチドのモノマー化を促進する。さらに胃上皮の細胞膜に作用し、脂質膜の流動化を図ることで胃粘膜細胞へのセマグルチドの吸収を促進する。有効成分であるセマグリチドとともにSNACを含有するというDDS技術こそが、世界初、唯一の経口GLP-1受容体作動薬の誕生を可能にした。
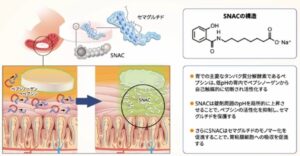
Novo Nordisk A/Sが、Emisphere Technologies Inc.が開発したDelivery agent:SNAC(sodium N-[8-(2-hydeoxybenzoyl) amino] caprylic acid)を吸収促進剤として用いたElingen Technologyを導入して開発を行った。SNACは、薬物と弱く結合し、たんぱく質の三次元構造を部分的に伸ばす(unfolding)ために、疎水性のside chainが現れて薬物が脂質二重膜を通りやすくなると考えられている。SNACの薬物への結合力が弱いために循環血液中に入った後は、たんぱく質は再び元の三次元構造に戻り活性を発揮する。
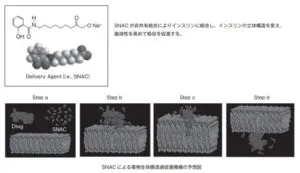
この技術は、従来検討されてきたような方法であるたんぱく質に科学的修飾を施すことや生体膜の構造変化を伴う吸収促進技術などを用いることなく、高分子の薬物を吸収させることができるという利点がある。
Drug Delivery System 31-5,2016
https://www.jstage.jst.go.jp/article/dds/31/5/31_440/_pdf
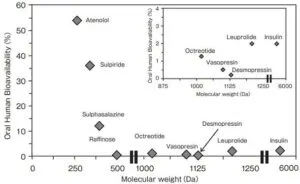
バイオ薬物は低分子薬とは異なり、親水性かつ高分子量であるため消化管粘膜からの急性が著しく低く、経口投与によって十分はバイオアベイラビィリティ(BA)を得ることは難しい。
これまでに、経口投与で前進への送達を可能にしたバイオ薬物としては、中分子量の感情ペプチドであるデスモプレシン錠剤(ミニリンメルト錠)とシクロスポリンのマイクロエマルション製剤(ネオーラルカプセル)のみであり、上市されているバイオ医薬の90%以上は注射剤として利用されている。これらの低吸収性薬物を粘膜的に送達するためには、薬物を消化管酵素による分解から回避させるとともに、消化管上皮細胞を通過させて全身循環に到達させることが可能なDDS技術の利用が必須である。その中でも、製剤への添加剤として利用することで訳稿を損ねることなく生体膜透過性を改善できる『吸収促進剤』への期待は高い。
吸収促進剤は粘膜に直接作用することでその構造に変化を生じさせ、薬物の吸収を促進する化合物である。吸収促進剤を利用した戦略は1980年代から活発に報告されてきた。これまでに、界面活性剤、胆汁酸塩、細菌毒素、キレート材、あるいは中鎖脂肪酸などを含む多数の化合物について、in vitroおよびin vivo試験で、生体膜透過性の低い分子の吸収改善における有効性が検討された。また、臨床試験において、粘膜吸収促進剤としての有効性を証明した例も50件以上が報告されている。
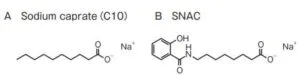
SNAC(sodium N-[8-(2-hydeoxybenzoyl) amino] caprylate)はサリチル酸の合成N-アセチル化アミノさん誘導体であり、C10に類似した両親媒性と海面活性を示す弱酸性物質である。粘膜透過性の低い薬物を腸内で「シャベロン化」できる物質を見出すスクリーニングの過程で見いだされた。
胃幽門部と十二指腸の間を結紮した犬を用いた実験で、錠剤のいない投与によるセマグルチドの全身送達が日結紮時と同等に起こることがわかり、SANC杯兄でセマグルチドと複合体を形成し、胃内㏗を中性まで上昇させることが明らかとなっている。このSNACによる㏗の緩衝作用が、胃内でのセマグルチドの分解抑制、溶解性の増大、セマグルチドのモノマー化の促進などを引き起こし、それらが複合的に働くことで胃粘膜を径細胞的に透過するセマグルチド量が増大すると考えられている。
Drug Delivery System 35-1 2020
https://www.jstage.jst.go.jp/article/dds/35/1/35_10/_pdf/-char/ja
セマグルチドは、胃から吸収される。これは今までのDDS戦略の考え方からは想像もしないことであった。
一般的には、消化管の粘膜の表面積を比較してみると、円柱形の粘膜の表面積を1とすると輪状ひだは3倍、絨毛になると30倍、微絨毛になると600倍になるとされており、薬剤の吸収から考えると、粘膜面性が広く、酵素が少ない小腸が有利であると考えられていた。
胃に到達してリベルサス錠は崩壊を始める。錠剤に含まれているSANCが放出され、局所的に胃液の㏗を上昇させペプシンなどのたんぱく質分解酵素の活性を抑制する。
胃の中の㏗2.6のペプシン溶液中では、セマグルチドは、速やかに分解される。そこにSNACを投与すると㏗は6になるのでペプシン活性は大幅に低下し、タンパク分解酵素による分解が抑制される。
このようにして胃の粘膜に接触する部位から吸収されると考えられている。
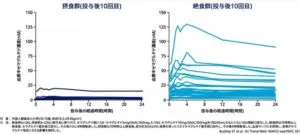
食事がセマグルチドの吸収に及ぼす影響をみてみると、摂食群ではほとんどセマグルチドの暴露は観察されなかったが、絶食群においてはほとんどの症例においてセマグルチドの暴露が測定され、空腹時に服用する必要がある。
https://www.msdconnect.jp/videos/rybelsus-mechanism-movie-lp/
飲食や他の薬剤の服用によりセマグルチドの血中濃度は著しく変化する。
薬を飲んで30分後の食事を摂取してもらう時の、薬を飲む前の絶食時間により吸収後の血中濃度に差が出てくる。一晩の絶食した際の血中濃度が400であっても、薬を飲む6時間前に夜食をとると150に低下し、2時間の絶食であれば50とかなり薬剤のピークの血中濃度は低下する。

セマグルチドの完全崩壊には、約1時間かかる。
この際飲むものにより崩壊する量が異なってくる。
常水で飲むと、60分でほぼ完全に溶解するが、ジェルだと半分以下になり、リンゴジュースやポカリスエットだと半分ぐらいになる。
SNACは緑茶では浄水以上に溶けるが、ポカリやリンゴジュースなどではほとんど解けない。
多くの飲料水は酸性に傾いているので、リベルサスを飲む際に使用することは推奨できない。
薬物を食後に服用する場合や、水以外の飲料で服用する場合、あるいは消火器作用や毒性を示す医薬品を併用する場合は、消化管内環境が変化し、薬物濃度変動(濃縮や希釈)が生じる可能性もある。
医薬品を経口投与する際には、通常、水あるいは白湯で服用することが推奨される。しかし、実際には、水以外の飲料、例えばジュースやお茶などで服用している場合も少なくない。ラット消化管内水分量に及ぼす投与溶液の影響を見てみると、水分吸収性は、精製水>生理食塩水>マンニトール等張液>アップルジュースの順で高くなり、特にアップルジュースでは水分分泌傾向が示されている。これは高張性に起因している可能性が示されている。
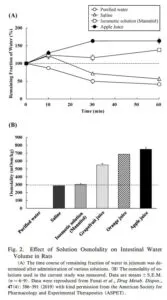
YAKUGAKU ZASSHI 140, 599-608 2020
https://www.jstage.jst.go.jp/article/yakushi/140/5/140_19-00246/_pdf
絶食後15分よりは30分、60分で内服したほうがセマグルチドの血中濃度は上昇した。
水分量は絶食後30分、60分であれば50mlのほうが120mlで内服した場合より血中濃度は高い傾向にあったが30分のほうで差が少なかった。
理想的には50mlの水分で30分可能であれば60分絶食後に食事を開始するのが良いといえる。
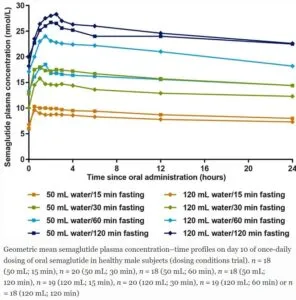
Diabetes Ther. 2021 Jul;12 (7):1915-1927
https://link.springer.com/article/10.1007/s13300-021-01078-y
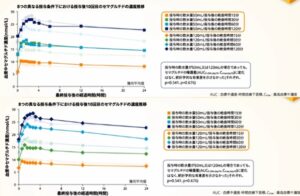
日本人2型糖尿病患者243例を対象にリベルサス3㎎、7㎎、14㎎、プラセボの1日1回経口投与とリラグルチド0.9㎎の1日1回皮下投与を52週間実施した結果は以下の図のようになった。
プラセボ軍と比較して、3㎎、7㎎、14㎎群ではそれぞれ-1.1%、-1.5%、-1.7%と有意に低下しており、リラグルチドとの比較では14㎎群で有意な差を認めた。

Drug Delivery System 37-2 2022
https://www.jstage.jst.go.jp/article/dds/37/2/37_169/_pdf
リベルサスの効きが良い状態は、空腹時の服用で、服用後30分は絶食をすること、制酸剤を服用している状態が考えられる。
逆に効きが悪い場合には、水分量が適量か、何で飲んでいるか、夜食などを食べていないかなどをチェックする必要がある。
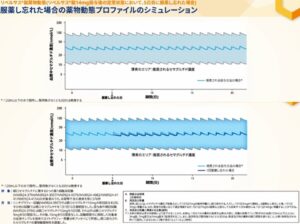
一回飲み忘れたことによりセマグルチドの血中濃度の変化は、下図のように、飲み忘れがない場合とほとんど差がないので、その日は飲まないで、翌日定時に服用するようにすれば問題ない。