川村所長の勉強会参加記録
2023.06.21
ミトコンドリア品質管理を考えた糖尿病治療 野村政壽教授
2023年6月4日
演題「ミトコンドリア品質管理を考えた糖尿病治療 ~メトホルミンの作用機構アップデート~」
演者:久留米大学医学部内科学講座内分泌代謝内科部門主任教授 野村政壽 先生
場所:
内容及び補足「
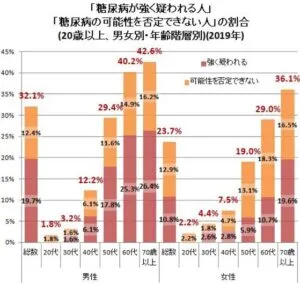
厚生労働省は2020年12月、「令和元年国民健康・栄養調査」の報告書で2019年時点での推計で20歳以上のうち糖尿病が強く疑われる人は1196万人、可能性を否定できない人は1055万人、合わせて糖尿病リスク社は2251万人いる計算になると発表した。60歳以上の男性で約40%、女性で約30%が該当する計算となっている。
CKD患者の性別・年齢別分布は下図に示すように、加齢とともに有病率が上昇する。
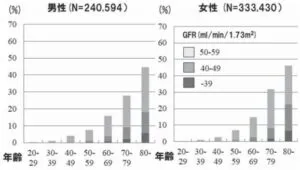
Clin Exp Nephrol 2009;13, 621-630
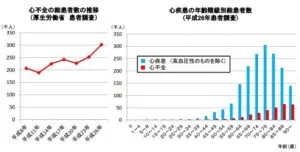
糖尿病合併心不全
心不全患者も同様である。(講演で提示されたのは海外データでしたが、ここでは日本のデータを表示します。)
高齢者糖尿病患者においては、認知症、サルコぺニア・フレイル、ADL低下、骨粗鬆症・骨折、心不全、悪性腫瘍、感染症、歯周病などの併存症があり、Multimorbidityの状態であり、それらの状態が悪化することにより糖尿病が増悪し、健康寿命の短縮に直結する可能性が高く注意が必要である。

高齢者糖尿病治療ガイド2021、P91
加齢に伴う脂肪細胞の機能低下により種々の生活習慣病が発症することが知られていた。脂肪細胞では他の多くの臓器とは逆にオートファジー抑制因子であるRubiconが加齢に伴い減少することで、オートファジーが過剰になり、脂肪細胞機能が低下し生活習慣病を引き起こすことが明らかになった。
脂肪細胞でRubiconを抑制しオートファジーを過剰にしたマウスは、糖尿病や脂肪肝などの生活習慣病を発症した。過剰なオートファジーは、脂肪細胞で重要な働きをしているSRC-1とTIF2という二種類のたんぱく質を分解・減少させ、PPARγの働きが減少し、生活習慣病が引き起こされると考えられる。
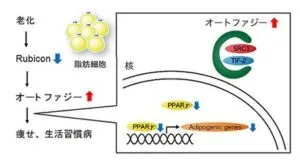
オートファジー:細胞内の不要な構造物を分解し、新陳代謝を担っている機構。まず、隔離膜と呼ばれる扁平な膜が細胞質内に出現し、分解基質を取り込みながらオートファゴソームを形成する。このオートファゴソームが分解酵素を多量に含むリソソームと融合し、内容物を分解する。不要物の蓄積を防ぐことで、オートファジーは様々な疾患の発症を抑制していると考えられている。2016年に大隅良典博士がオートファジー機構を発見してノーベル医学・生理学賞を受賞された。
Rubicon(Run domain Beclin-1 interacting and cysteine-rich containing protein)数少ないオートファジーの抑制因子の一つ。オートファジーの後期過程であるオートファゴソームとリソソームの融合を負に制御している。肝臓や腎臓、神経系でRubiconを抑制するとオートファジー活性が増加し、加齢や肥満による疾患が改善することがこれまでに明らかになっている。
PPARγ(Peroxisome Proliferator-Activated Receptor γ):脂肪細胞の分化や機能に重要な働きをしている蛋白質。栄養素の取り込みや貯蔵にかかわる蛋白質など、脂肪細胞の働きに必要な多数の蛋白質の発現を誘導・維持している。この蛋白質の働きが低下すると、脂肪細胞の働きは低下し、生活習慣病の症状をきたすことが知られている。また、PPARγ活性化剤は糖尿病の治療薬として用いられている。
https://www.amed.go.jp/news/release_20200820-02.html
生活習慣病といわれる肥満症、高血圧症、耐糖能障害、脂質異常症などの危険因子が集積するメタボリック症候群は虚血性心疾患や脳血管障害などの動脈硬化性疾患粗引き起こす。そのメタボシック症候群の病態は内臓脂肪の蓄積であり、遺伝的背景(体質)に環境因子が加わり、各危険因子が経時的に連鎖することで動脈硬化性疾患を発症する。この書く危険因子の経時的な連鎖をドミノ倒しに見立て図示すると下図のようなメタボリックドミノとして表現できる。
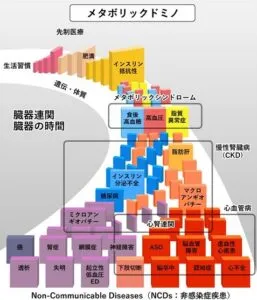
https://kompas.hosp.keio.ac.jp/contents/000062.html#%E6%A6%82%E8%A6%81
こういった観点から糖尿病の発症を考えると、代謝の異常、炎症、免疫の関与として捉えることができ、その背景にミトコンドリアの機能異常が想定できる。
ミトコンドリアの機能を見てみよう
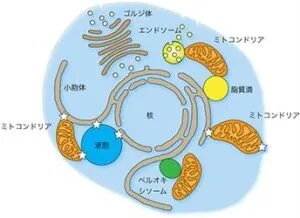
生命活動に必要なエネルギーを産生するなど、ヒトの健康に重要とされてるミトコンドリヒトをはじめとする真核生物の細胞内は、ミトコンドリア、核、小胞体などの細胞小器官(オルガネラ)と呼ばれる膜構造によって仕切られ、各オルガネラが独自の生化学反応を行うことで細胞の様々な機能を担っている。
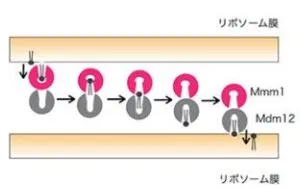
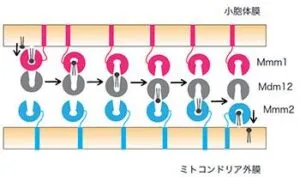
小胞体に局在するMmm1、ミトコンドリアに局在するMmm2とMdm10、両者をつなぐMdm12という四つの蛋白質で構成されるERMES複合体(小胞体―ミトコンドリア間コンタクト部位を作る複合体)がある。
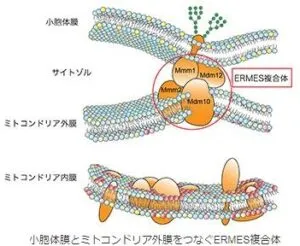
Mmm1、Mdm10、Mmm2にはSMPドメインという疎水性物質が結合しうるポケット構造があり、そこにリン脂質が疎水性の脚の部分をポケットの底に向けて突っ込んで結合する。
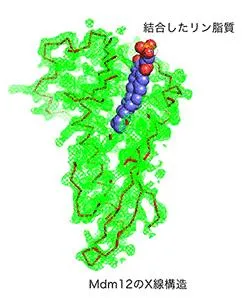
人工膜小胞(リポソーム)を用いて、試験管内でMdm12やMmm1単独では脂質は輸送できず、これらの複合体を用いると高い脂質輸送活性が観察された。ERMESでは脂質がMmm1の脂質結合ポケットからMdm12脂質結合ポケットへ、Mdm12の脂質結合ポケットからMmm2の脂質結合ポケットへと効率よく受け渡され、水に触れることなく小胞体膜からミトコンドリア外膜へと輸送されると考えられている。この輸送活性にはMmm1-Mdm12というコア複合体が重要である。
ミトコンドリア:酵母からヒトまで広く真核生物内にみられる必須のオルガネラ。生命活動に必要なエネルギーATPを酸素呼吸によって産生するほか、さまざまな物質の代謝やアポトーシスにもかかわる。ミトコンドリアの機能低下や機能異常と老化やガン、糖尿病、さまざまなミトコンドリア病との関連がわかってきている。ミトコンドリアの機能を健全に保つことがヒトの健康に重要であることから、健全なミトコンドリアを増やす方法が注目されている。
小胞体:真核生物の細胞内にみられるオルガネラ。細胞から外に出ていく蛋白質の合成、機能獲得、修飾、配送の場であるとともに、脂質をはじめ様々な物質の合成代謝、カルシウム貯蔵などにかかわる。
ミトコンドリア脂質と生体機能:細胞内の各オルガネラ膜の固有の脂質組成がオルガネラ機能・細胞機能に必須である。ミトコンドリア内膜にはカルジオリピンとホスファチジルエタノールアミンが多く、このことがミトコンドリア機能に必須である。マウスにおいては、カルジオリピンは胚発生に必須であり、その欠損や異常はヒトの老化、心不全、心筋症、バース症候群に関係している。パーキンソン病との関連を指摘する報告もある。ホスファチジルエタノールアミンはカフジオリピンの機能の一部を代替えできると考えられている。
小胞体―ミトコンドリア間脂質輸送:細胞が必要とするリン脂質の大部分は小胞体膜とミトコンドリア内膜で作られる。したがってリン脂質の合成中間体は小胞体とミトコンドリアの間を行き来する必要がある。また小胞体とミトコンドリアで合成された脂質は、細胞内の各オルガネラ膜や細胞膜に必要に応じて配送されねばならない。角膜系の脂質組成がどのように監視され、水に溶けない脂質が、何によってどのように、水溶性区画を通って特定の膜に運ばれるかはまだよくわかっていない。
オルガネラ間コンタクト部位:以前は細胞内の各オルガネラは物理的に分離し、固有の機能を担うと考えられていたが、近年、異なるオルガネラどうしが一部で物理的に結合していることが分かってきた。この結合部位をオルガネラ間コンタクト部位と呼び、ミトコンドリアと小胞体や液胞、液胞と小胞体や核の間などのコンタクト部位が見つかっている。これらのコンタクト部位の機能はまだよくわかっていないが、脂質をはじめとする様々な代謝物質のオルガネラ間輸送、小胞体やミトコンドリアにおけるカルシウムイオンの貯蔵の制御、オルガネラの分裂の制御にかかわることが考えられている。
リポソーム:人工的に作ったリン脂質に分子膜の小胞。背板膜のモデル系として利用されている。
https://www.kyoto-su.ac.jp/news/20171227_345_release_ka01.html
ヒトのミトコンドリアDNA(mtDNA)は、16569の塩基からなり、13の酸化的リン酸化システムの蛋白質、2つのリボソームRNA(rRNA)、および22のTransfer RNA(tRNA)からなっている。
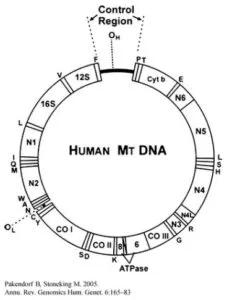
https://www.annualreviews.org/doi/10.1146/annurev.genom.6.080604.162249
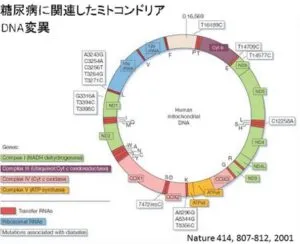
参:
ミトコンドリアは酸素を使ってATPを作るオルガネラであるため、mtDNAは酸化ストレスを受けやすい。
塩基置換速度が一般に核DNAよりも大きく、分類や系統関係の推定によく使われる。
mtDNAにはヒストンが無く、DNA修復機構もあまり働かない。
mtDNAは一般的には環状構造を示すが、直鎖上のものもある。
mtDNAは細胞質遺伝するので、通常母系のmtDNAが次世代に受け継がれる。
mtDNAは、ミトコンドリアあたり2-10コピー存在する。細胞には、数百~数千のミトコンドリアが有るのでmtDNA量は核DNA量よりも非常に多い。
mtDNAの変異、特に電子伝達系関係の遺伝子変異は、さまざまな遺伝病の原因となっている。
mtDNAは変異速度が大きいため、分子時計としても有用である。脊椎動物では、100万年あたり1-2%変化すると考えられている。
https://ultrabem.com/cell/mitochondria/mtdna
1918年フランスの科学者ポール・ジュール・ポティエが、著書『共生者』でミトコンドリアの起源は強制の過程から生まれたと主張。1920年には、イワン・ワリンがミトコンドリアの起源は内共生であるという考えを唱えた。ロシアの植物学者ボリス・コゾポリアンスキーは1924年に出版した『生物学の新原理』の中で「共生説は共生現象に依拠した淘汰説である」とダーウィン進化論の観点から説明した。
1967年にリン・マーグリスは論文「分裂細胞の起源について」の中で、微生物学的証拠を用いこの説を展開し、立証している。
Journal of Theoretical Biology Volume 14, Issue 3, March 1967, Pages 225-274
https://www.sciencedirect.com/science/article/abs/pii/0022519367900793
ミトコンドリアのマトリックス膜に以下の1~5の複合体が埋め込まれている。
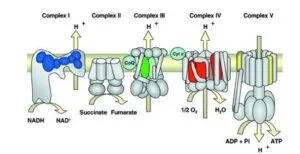
Brain, Volume 127, Issue 10, October 2004, Pages 2153–2172
https://academic.oup.com/brain/article/127/10/2153/404539
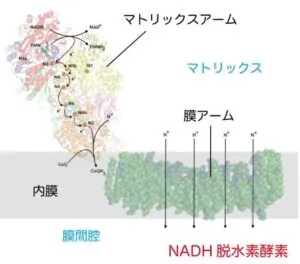
参:ミトコンドリアのマトリックス膜には三つの酵素複合体が埋め込まれていて、この複合体内を電子が移動するとH+がマトリックス内から膜空間へと汲みだされる。根電子伝達複合体群を総称して電子伝達鎖、あるいは呼吸鎖と呼んでいる。
これらの3つの複合体は、複合体1、複合体3、複合体4と呼ばれ、それぞれNADH脱水素酵素複合体、シトクロムc還元酵素(シトクロムb-c1複合体)、シトクロム酸化酵素複合体とも呼ばれている。
呼吸鎖で、まず複合体1内のフラビンモノヌクレオチド(FMN:酸化還元酵素の補欠分子族)がNADHの参加によって生じた電子を受け取り、鉄-硫黄クラスターを介してユビキノンに伝達される。ユビキノンは電子を受け取りユビキノールに変化する。
NADH→NAD++H++2e-
ユビキノンは1個電子を受け取るとユビセミキノンQH・になり、もう1個受け取るとユビキノールQH2になる。
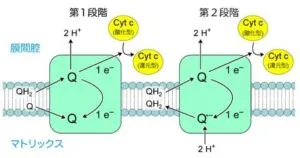
ユビキノールが電子2個を複合体3に渡し、同時にH+を2つ膜間腔に放出する。渡された電子のうち1個はシトクロムcに伝達され、もう1個は別のユビキノン(Q)に戻されてユビセミキノンになる。再び別のユビキノールが電子2個を複合体3に渡してH+を2つ膜間腔に放出する。渡された電子のうち1個はシトクロムcに伝達され、もう1個はユビセミキノンに渡されてユビキノールになる。
ユビキノールが渡す2個の電子のうち、1個はシトクロムcに伝達され、もう一つはキノンに戻されプールされる。結果的にシトクロムcに電子が2個渡されることでH+が4個膜間腔に放出される。
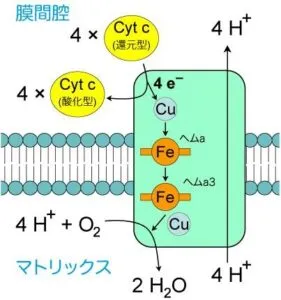
最後にシトクロムcから複合体4(シトクロムc酸化酵素)に電子が渡され、酵素複合体内の銅イオン、ヘムaを経てヘムa3へと渡る。ヘムa3には、銅イオンとの間にO2分子が捉えられていて、電子が4個たまると下式の酸化反応が起こり、酸化反応が1回起こるごとにH+が4個マトリックスから膜間腔へと汲みだされ、電子が酸素と反応して水になることで電子伝達が終了する。
O2+4H+++4e-→2H2O
このようにして、NADHから放出された電子が呼吸鎖内を移動することでH+がマトリックスから膜間腔へと汲みだされることでATP合成の準備が整う。
この間、電子が通る際に3つの複合体はH+をマトリックスから膜間腔へ汲み出し、H+の濃度勾配を形成する。この濃度勾配を解消しようとATP合成酵素(F1F0-ATPase)の分子内をH+が通り抜け、マトリックスに流入する。
ATP合成酵素は回転子と呼ばれる回転部分と、それを固定する固定子からなる。H+はまず膜間腔側からATP合成酵素のaサブユニット内に入ってcサブユニットに結合し、最終的にaサブユニットからマトリックス側に流入する。H+がcサブユニットに結合するとc・ε・γサブユニットが回転する。γサブユニットが回転するとα3β3サブユニットの立体構造が変化し、それに伴って、ADPからATPが合成される(酸化的リン酸化)。
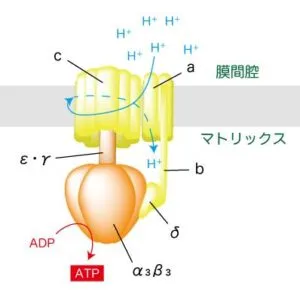
複合体2は、1と3の間に位置していて、FADH2から電子を受け取ってユビキノンに渡すが、H+をマトリックスから膜管腔へは汲みださない。
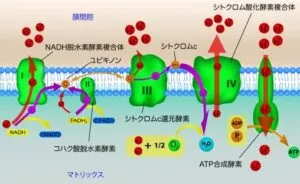
https://rikei-jouhou.com/electron-transport-chain/
食事のとりすぎや運動不足により肥満やインスリン抵抗性、メタボリックシンドロームとなってくるとミトコンドリア機能異常が誘発される。またミトコンドリア機能異常が存在するとインスリン抵抗性が誘発される。これらの過程で活性酸素の増加がみられると老化が促進されると考えられる。
参:
インスリンがインスリン受容体に結合すると、インスリン受容体基質(IRS-1)のチロシンリン酸化を介してphosphatidyl inositol 3-kinase(PI3Kinase)を活性化し、Aktを活性化させて糖輸送担体(GLUT4)を形質膜に移行させてブドウ糖取り込みを促進する。インスリン抵抗性状態では、過食などによる血管からのFFA流入増加やミトコンドリア機能異常によるβ酸化の低下により骨格筋内に脂肪代謝産物が蓄積し、セリン・スレオニンキナーゼを活性化させてIRS-1のセリンリン酸化を亢進させる。インスリンによるPI3kinaseの活性化はIRS-1のセリンリン酸化によって抑制され、引き続きいてAKTの活性化が妨げられ、結果としてGLUTの形質膜への移行が妨げられてブドウ糖の取り込みが減弱する。つまり、ミトコンドリア機能異常によって、ブドウ糖や脂肪酸の参加が低下することによってインスリン抵抗性を起こしていると考えられる。
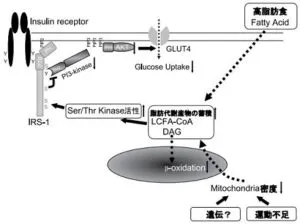
糖尿病 49[11]:837-840.2006
https://www.jstage.jst.go.jp/article/tonyobyo/49/11/49_11_837/_pdf/-char/ja
老化は多くの疾患の危険因子である。老化障害は相互に関連している。DNA修復経路効率の低下、ゲノム完全性の喪失、ヘテロクロマチンの全体的な喪失、代謝シグナル伝達の変化、ミトコンドリアによる活性酸素種(ROS)の形成の増加、プロテオスタシス促進蛋白質分解経路の活性の低下、老化経路の活性化がみられる。亜鉛メタロプロテイナーゼZMPSTE24による野生型プレラミンAの翻訳語処理は、核膜に取り込まれた成熟野生型ラミンAを放出する。早期老化疾患ハッチンソン・ギルフォード早老症症候群(HGPS)ではLMNA(G608G)突然変異は、ZMPSTE50切断部位を含む24個のアミノ酸を欠くプレラミンAアイソフォームの形成をもたらすスプライス部位を活性化する(プロジェリン)。この変異アイソフォームを核薄板に組み込むと、核の形状が歪み、図に示す他の老化欠陥をさらに進行させる。
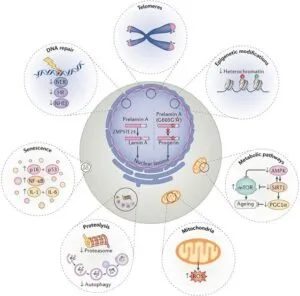
老化および老化関連疾患(AAD)におけるミトコンドリアの参加的リン酸化は、インスリン用成長因子1(IGF-1)シグナル伝達の減少、またはIGF-1経路の慢性的な活性化に起因するIGF-1とmTORシグナル伝達の脱共役(矢印の中断で表示)、およびAMP活性化プロテインキナーゼ(AMPK)およびサーチュイン1(SIRT-1)シグナル伝達障害に起因するmTOR活性の増加によって引き起こされる。
ミトコンドリア活性の増加、抗酸化物質レベルの低下、PGC1α活性低下による活性酸素種(ROS)の形成増加は、ミトコンドリアの生合成と代謝回転の障害をもたらし、DNA、蛋白汁、その他の高分子に損傷を与える。オートファージおよびユビキチン-プロテアソーム系(UPS)を介した損傷蛋白質の分解を含むDNA修復経路およびプロテオスタシス経論機能低下は、ミトコンド理機能低下、ROSの上昇という悪影響をきたす。
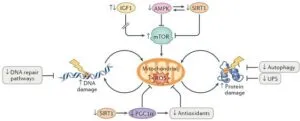
Nat Rev Mol Cell Biol. 2017 Oct;18(10):595-609
https://pubmed.ncbi.nlm.nih.gov/28792007/
運命を制御するミトコンドリア
ミトコンドリアの機能として以下のものがある。
ATP産生:ミトコンドリアの主たる機能で、これにかかわる多く蛋白質が内膜やマトリクスに存在している。細胞質で解糖系が行われ、主にグルコースを代謝してわずかなATPをお合成しながら、ピルビン酸とNADHに分解する。酸素が充分に存在しない場合には嫌気呼吸により代謝されるが、酸素が充分に存在していれば好機呼吸が行われ、効率よくATPが得られる。嫌気性分解では1分子のグルコースから2分子のATPしか得られないが、好気性分解では、1分子のグルコースから約38分子のATPが合成できる。
ミトコンドリアでは、ピルビン酸だけでなく、脂肪酸も利用でき、β酸化が行われる。
細胞内カルシウム濃度制御:細胞内のカルシウム濃度は様々な気候によって厳密に制御されており、細胞中の情報伝達に重要な役割を果たしている。細胞内カルシウム濃度の上昇により、セカンドメッセンジャー系が起動されたり、筋肉の収縮が起きたり、さまざまな反応が起きる。細胞内におけるカルシウムの貯蔵場所としては小胞体が最も顕著だが、カルシウムの貯蔵に関して小胞体とミトコンドリアは協調している。ミトコンドリアは迅速にカルシウムを取り込むことが可能で、カルシムは、ミトコンドリア膜電位に依存して内膜のカルシウム輸送体によりマトリクスへと取り込まれる。こうして取り込んだカルシウムを、ナトリウム・カルシウム対向輸送もしくはカルシウム依存性カルシウム放出系によって、ミトコンドリアから放出することで、カルシウム濃度の緩衝作用を果たしている。
脂肪酸輸送:
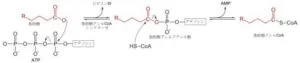
細胞内に取り込まれた脂肪酸は、ミトコンドリア外膜の細胞質側に存在する酵素アシルCoAシンテターゼにより触媒され、次の反応により活性化される。
![]()
この反応は、まず脂肪酸のカルボン酸イオンがATPのリン酸と置換することで脂肪酸アシルアデニル酸とピロリン酸が生成する。次に補酵素Aのチオール基がアシル基の炭素を求核攻撃し、脂肪酸アシルCoAとAMPを生成する。脂肪酸アシルCoAは高エネルギー化合物の一種であり、脂肪酸と補酵素Aに加水分解したときに標準自由エネルギー変化は-31KJ/molである。生成した脂肪酸アシルCoAはミトコンドリア内膜に運搬され、β酸化を受けるかもしくは細胞質ゾルでの巻く脂質の合成に利用される。
ミトコンドリア内膜はアシルCoAを直接透過しないため、カルニチンが脂肪酸アシル運搬帯の役割を果たす。脂肪酸アシルCoAはカルニチンと一時的に結合し、脂肪酸アシルカルニチンを生成する。この反応はミトコンドリア外膜に埋め込まれたカルニチンアシルトランスフェラーゼ1により触媒される。脂肪酸アシルカルニチンは膜間スペースで生成される場合と外膜の細胞質ゾル側で生成する場合が考えられるが、今のところはよくわかっていない。脂肪酸アシルカルニチンはアシルカルニチン/カルニチントランスポーターを介する促進拡散により内膜を通過し、マトリックス内に移行する。そして脂肪酸アシル基が内面に局在する酵素カルニチンアシルトランスフェラーゼ2の触媒によりカルニチンからミトコンドリア内に存在する補酵素Aに転移されることで、脂肪酸アシルCoAが再生する。遊離のカルニチンはアシルカルニチン/カルニチントランスポーターを介して再び膜間スペースへと移動する(カルニチンシャトル)。
脂肪酸ベータ酸化:
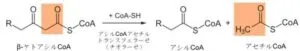
β酸化反応は以下の4段階の反応の繰り返しで、一巡する毎に脂肪酸アシル鎖のカルボキシル末端から2炭素がアセチルCoAとして分離していく。炭素数が偶数の脂肪酸であるパルミチン酸(C16)はパルミトイルCoAとしてミトコンドリア内で酸化を受け、これらの反応を7巡し、アセチルCoAを7+1=8分子生産する。炭素数が奇数の脂肪酸も同じように反応が進み、アセチルCoAのほかに、炭素数3個のプロピオにるCoAを生じる。
1.FDAによる酸化
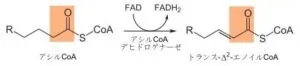
2.水和
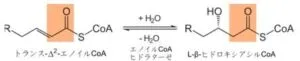
3. NAD+による酸化
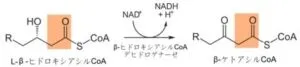
4.チオール開裂
自然免疫:
RNAウイルス感染応答時に、ミトコンドリア上のMffタンパク質が感染したRNAウイルスを検知するシステム(MAVSタンパク質)を調節し、ウイルス感染を制御することに重要な役割を果たしていることが2020年に報告された。Nature 2020 Nov 11;11(1):5711. doi: 10.1038/s41467-020-19287-7.
https://www.nature.com/articles/s41467-020-19287-7
ミトコンドリア分裂の際に機能することが知られている、ミトコンドリア上のMff蛋白質の遺伝子を欠損した細胞では、RNAウイルス感染に対する応答が大きく低下する。
Mff蛋白質はMAVS蛋白質をミトコンドリア上の一部に局所的に集めて活性化する。
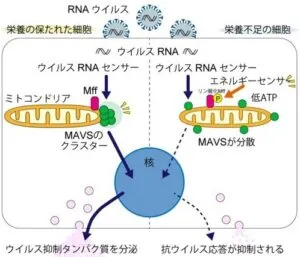
Mff蛋白質(Mitochondrial fission factor):ミトコンドリア外膜上に存在する膜蛋白質。ミトコンドリア分裂を実行する蛋白質であるDrp1を細胞質からミトコンドリア表面に運ぶ受容体で、細胞内エネルギーセンサーであるAMPKによってリン酸化されミトコンドリア分裂を促進する。ウイルス感染時の細胞応答にもかかわることが示された。
https://www.amed.go.jp/news/release_20201111-02.html
アポトーシス:
細胞に発生したDNA損傷などのストレスは、アポトーシス誘導分子p53やアポトーシスを調節するBcl-2ファミリー蛋白質を介して、ミトコンドリアの膜電位を変化させ、外膜の電位依存性陰イオンチャンネルが閉鎖され、ミトコンドリアの機能が低下する。さらに、ミトコンドリアの膜電位変化は、ミトコンドリアからシトクロムcの漏出も発生させ、アポトーシスへとつながる。シトクロムcは、細胞質に存在するApaf-1やカスパーゼ-9と結合して、アポトソームと呼ばれる集合体を形成し、これによって活性化されたカスパーゼ-9が、下流のエフェクターを活性化し、DNAが切断せれて、細胞死が起こる。
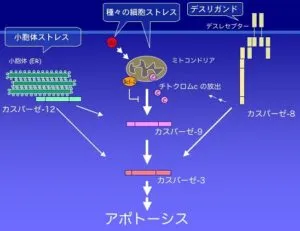
https://ja.wikipedia.org/wiki/%E3%83%9F%E3%83%88%E3%82%B3%E3%83%B3%E3%83%89%E3%83%AA%E3%82%A2
参:老化との関係
ROSの生成:ミトコンドリアは、活性酸素種 (ROS) 生成の主な供給源であり、産生した ROSによるDNAの損傷がおこり、老化プロセスに関与。
呼吸能力の低下:加齢に伴い、ミトコンドリアの呼吸活動の低下により細胞代謝の変化が、老化の進行に寄与。
マイトファジー:マイトファジーはオートファジーのミトコンドリア版。マイとファジーにより、欠陥のあるミトコンドリアの量を制御するが、年齢とともにこの機能は低下し、欠陥のあるミトコンドリア数が増加。
ミトコンドリアの突然変異:ミトコンドリア DNA は、核 DNA ほど効率的な DNA 修復機構を持たないため、より突然変異を受けやすい。時間の経過とともに変異したミトコンドリアの蓄積により、ミトコンドリア機能が低下。
幹細胞の数の減少:ミトコンド理機能低下が幹細胞の減少に影響を与える。
細胞老化:ミトコンドリアは、細胞の代謝プロファイルを変化させることで細胞の老化を制御。 細胞メタボロームの重大な変化は、細胞の老化と生物学的に関連しています。
ミトコンドリアの折り畳まれていないタンパク質応答 (UPRmt) – UPRmt は、ミトコンドリアタンパク質のミスフォールディングを引き起こすミトコンドリアストレスによって活性化される細胞ストレス反応です。 核はこれを検出し、ミスフォールドタンパク質を除去するプロテアーゼとシャペロンの発現を増加させます。 老化や、心血管疾患や糖尿病などの加齢に伴う病気は、プロテアーゼレベルの低下と関係しています。
DAMP (損傷関連分子パターン):ストレス時に放出されるDAMP(ダメージ関連分子パターン)は、 ミトコンドリアストレスにより、DAMP の XNUMX つであるミトコンドリア DNA が放出されます。 血中のミトコンドリア DNA の量は年齢とともに増加し、加齢に伴う軽度の慢性炎症状態と関連しています。
ミトコンドリア由来ペプチド – ヒューマニンやMOTS-cなどのミトコンドリアペプチドは、それぞれアルツハイマー病と加齢に伴うインスリン抵抗性の保護に役立ちます。 それらは寿命の長さとも関係しています。
ミトコンドリアの代謝:ミトコンドリアの産生したNADを、サーチュインはそれを基質として利用します。 サーチュインは寿命に関係するタンパク質です。 NADの細胞濃度は、年齢が進むにつれて減少し続けます。
https://microbiologynote.com/ja/%E3%83%9F%E3%83%88%E3%82%B3%E3%83%B3%E3%83%89%E3%83%AA%E3%82%A2/
Diabetes Obesity and Metabolism 12 12-19 2010
https://doi.org/10.1111/j.1463-1326.2009.01098.x
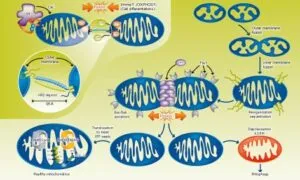
ミトコンドリアダイナミクス
ミトコンドリアを標識して観察すると細胞内で活発に動き、融合と分裂を繰り返している。このサイクルの中でミトコンドリアは新生・劣化・再生を繰り返しており、再生不可能な場合はミトファジーによって排除される。このようなミトコンドリア自身の品質管理の機能をミトコンドリアダイナミクスと呼んでいる。

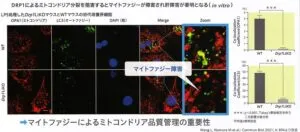
劣化したミトコンドリアが蓄積することがミトコンドリア機能障害や細胞死に関連すると考えられている。
ヒト肝癌由来細胞株HepG2を用いて脂肪酸を基質とするβ酸化および好気呼吸のプロセスを誘導した際のミトコンドリアの形態変化を検討してみた。ATP産生の亢進とともにミトコンドリアは分裂した形態をとる。この時小胞体ストレスを反映する転写因子ATF3やCHOPの発現が増加し、マイトファジー亢進を反映するLC311も増加する。すなわち、脂肪酸を添加された細胞はATP産生を行うとともに劣化したミトコンドリアを自ら処理して代謝を継続しようとしている。
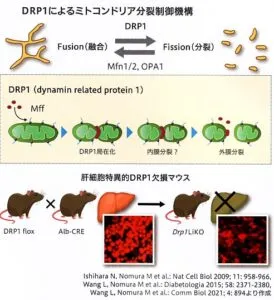
ミトコンドリアの分裂に関与するDRP1を甘草のみでノックアウトしたマウスを用いた実験で、高脂肪食によって著明な肝障害が生じる。つまり、ミトコンドリアの分裂が阻害されると、核の膨化や、炎症細胞の浸潤、線維化などが出現し、NASH(非アルコール性脂肪肝炎)に近い状況が出現する。これはミトコンドリアの分裂阻害によりマイトファジーが障害されたためと考えられる。
参:肝細胞特異的Drp1欠損マウスにおいて、高脂肪食負荷によりインスリン抵抗性が惹起され耐糖能障害を認めたが、Drp1欠損マウスでは耐糖能障害は認めなかった。
肝細胞特異的Drp1欠損マウスでは高脂肪食負荷により小胞体ストレスが惹起され、線維芽細胞増殖因子FGF21(エネルギー代謝を活性化し、肝臓で中性脂肪の蓄積を抑制し、骨格筋においてインスリン抵抗性を改善)発現が亢進したことにより、耐糖能悪化がみられなかったと考えられる。
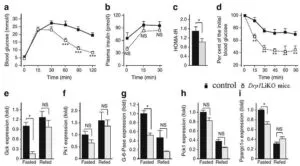
コントロールマウスのミトコンドリアは細胞質に図ン参されているが、Drp1 LiKOマウスのミトコンドリアは、腫大していた。

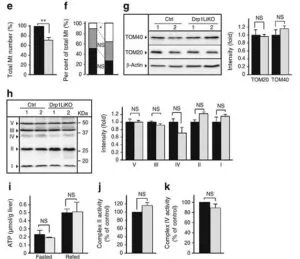
肝臓特異的Drp1 LiKOマウスでは、eIF2αのリン酸化が増加し、その下流の標的であるATF4やCHOPの増加をきたし、インスリン抵抗性を伴う耐糖能異常を呈することが示された。
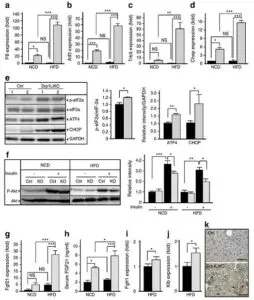
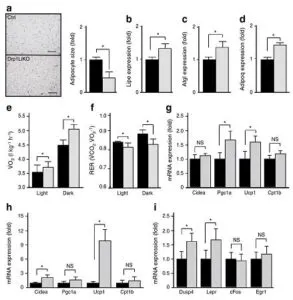
ホルモン感受性リパーゼ(Lipe)や脂肪トリアシルグリセロールをコードする遺伝子など脂肪分解に関与する遺伝子の発現はDrp1 LiKOマウスで有意に増加していた。アディポネクチンの血清レベルに有意な差は無く、食物摂取量の顕著な減少が観察されていないので、FGF21がエネルギー消費を増加させている可能性がある。Drp1 LiKOマウスの酸素消費量は、対象マウスと比較して有意に増加していた。
呼吸交換比(RER)は、明サイクルと暗サイクルの両方でDrp1 LiKOマウスで著しく低く、脂肪使用の増加を示唆している。FGF21の鼓かは褐色脂肪組織におけるネル産生遺伝子の調節に起因すると考えられ、脂肪組織におけるCidea、Pgc1a、Ucp1oyobiCpt1bの遺伝子発現を調べた。
脂肪細胞におけるPgc1aおよびUcp1の発現は、Drp1 LiKOマウスで有意に誘導されていた。
Diabetologia 58 2371-2380 2015
file:///C:/Users/PCUser/Downloads/s00125-015-3704-7.pdf
参:ミトコンドリア特異的蛍光色素やミトコンドリア局在化型蛍光蛋白質を用いてミトコンドリアの培養細胞内での生細胞観察を行うと、細胞内でミトコンドリアが動的にその構造を変化させている様子が観察できる。
融合の促進または分裂の抑制によってミトコンドリアは長く連携し細胞内でネットワーク構造を形成するようになる。逆に分裂の促進、または融合の抑制によってミトコンドリアは小さく分断化され、細胞内でのミトコンドリアの数が増加することになる。
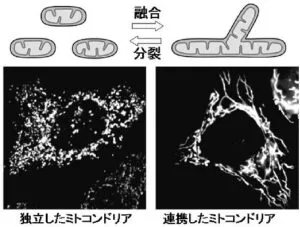
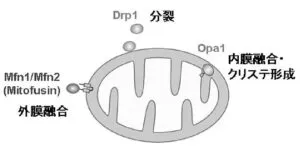
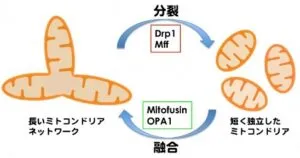
Mitofusin(Mfn)/fuzzy onion(Fzo)はミトコンドリア外膜の融合に、Opa1/Mgm1はミトコンドリア内膜の融合に、Drp1/Dnm1はミトコンドリアの分裂に機能している。これらの三つのGTPaseは種を超えて保存されている。
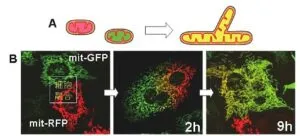
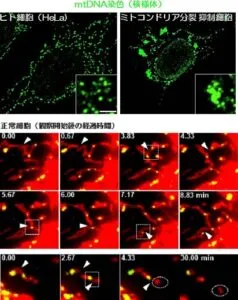
ミトコンドリアのマトリックスに二色の異なる蛍光蛋白質を発現するHeLa細胞をそれぞれ構築してミトコンドリアを可視化した(B左)。さらにセンダイウイルスを用いてこれらの細胞同士を細胞融合させ、2色に標識されたミトコンドリアを持つ細胞の生細胞観察を行った。するとこの2色の蛍光は時間経過に伴って一致した分布を示すようになり(B中)、6~9時間後にほぼすべてのミトコンドリアが療法の蛍光を持つようになった(3右)。哺乳類のミトコンドリアは融合してそのマトリックスの内容物を交換できる。
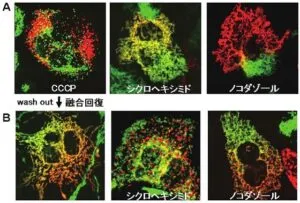
細胞融合と同時に薬剤を添加し細胞融合を観察すると、脱共役剤(CCCP)の添加によってミトコンドリアの融合は完全に停止する。CCCpを洗い流すと融合活性は回復するのでCCCPによるミトコンドリア融合阻害は可逆的である。
融合反応時に微小管形成阻害剤(ノコダゾール)を添加すると2色のミトコンドリア蛍光の混合は強く阻害された。しかし、CCCP処理後のwash out時にノコダゾールを添加しても融合は観察された(B右)ことから微小管はミトコンドリアの融合自身には必須でないことがわかる。通常の融合反応におけるノコダゾールによる融合阻害は、ミトコンドリアの細胞内移動が阻害されることでミトコンドリアの均質化が阻害されたためと考えられる。
タンパク質合成阻害剤(シクロヘキシミド)、を添加しても融合反応自体は阻害されないが、CCCP処理後のwash outに伴う融合活性回復時にシクロヘキシミドを添加した場合には、融合の回復はみられない。
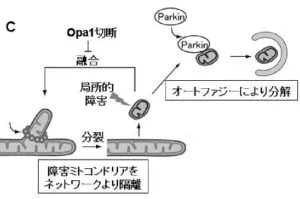
膜電位消失時には、ミトコンドリア内のL-Opa1のN末端部分が蛋白質切断を受け、S-Opa1に変換される。この切断により、ミトコンドリアは融合活性能を失う。膜電位回復時には、L-Opa1が新規合成され、ミトコンドリア内に輸送され、融合活性が回復する。
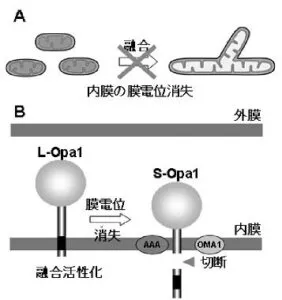
障害を受け、膜電位を消失したミトコンドリアは、Opa1の切断を介して融合活性を失うことでミトコンドリアネットワークから隔離される。また同時に膜電位を消失したミトコンドリアはParkinの局在化を引き金としてオートファージ分解される。
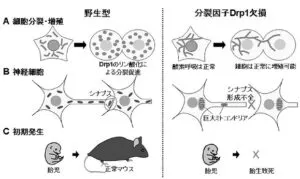
細胞増殖時にミトコンドリアは断片化される。RNAiによりDrp1の発現抑制を行うと細胞分裂期にもミトコンドリアが長い構造を維持している。細胞分裂期にCdk1/サイクリンB複合体により、Drp1の特定のセリン残基がリン酸化を受けて断片化し、このセリン残基を改変するとミトコンドリアの断片化が抑制される。
Drp1遺伝子を欠損した胎児神経芽細胞では、きわめて長い連結したミトコンドリアのネットワークが形成されているが、この細胞は野生型細胞とほぼ遜色ない速度で増殖することは可能であるが、神経突起内でのミトコンドリア分布不全およびシナプス形成不全が起こる。そして、Drp1を全身で欠損させたマウスは胎生期12.5日頃までに致死的となる。
生化学 Vol. 83 N5 P365-373;2011
https://www.jbsoc.or.jp/seika/wp-content/uploads/2013/05/83-05-02.pdf
参:ミトコンドリアDNAダイナミクス
ミトコンドリアは細菌の共生を起源とする細胞小器官であり、内部にmtDNAを持っており、細胞内で活発に動きながら増殖する。
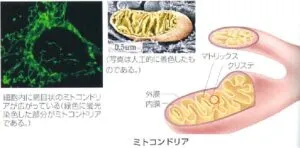
細胞内でミトコンドリアは、融合と分裂を頻繁に繰り返しながらダイナミックにその形態を変化させている。分裂にはDrp1、Mffが関与し、融合にはOPA1が関与している。
mtDNAはTFAMなどのDNA結合蛋白質とともに「核様体」と呼ばれる構造体を形成している。細胞内に百個以上の核様体が観察され、これらが動的に変化している。
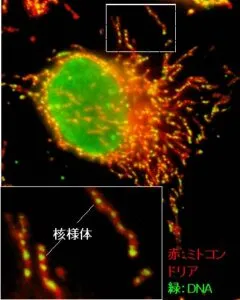
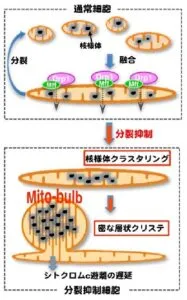
ミトコンドリアの分裂を抑制すると、ミトコンドリアの融合に伴い多数の核様体が集合・合体し巨大化する。さらに、通常細胞のライブイメージングや免疫染色観察から、核様体の近傍で頻繁にミトコンドリア分裂が起きることが観察される。
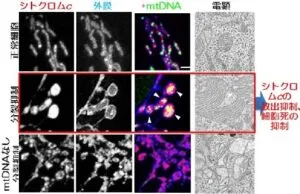
分裂要請を行うと核様体の合体に伴い膨らんだミトコンドリア(ミトバルブ)が多数出現する。細胞死であるアポトーシスの進行時にミトコンドリアから細胞質へシトクロムcが放出されるが、ミトバルブ内には層状の内膜クリステが極めて密に配置され、その内部にシトクロムcが封入されることで細胞質への放出が抑制される。
ミトコンドリア分裂は核様体の集合を紡ぎ、分散した状態を維持させること、またミトコンドリア分裂抑制に伴う核様体の分布変化は、内膜クリステ構造やアポトーシスの進行抑制に重要な役割を果たしていると考えられる。
大阪大学理化学研究生物化学専攻石原研究室 ミトコンドリアDNAダイナミクス
https://mitochondria.jp/introduction/mtdna
参:
ミトコンドリアの融合と分裂
ミトコンドリアの融合は、3種類のGTPase:Mfn1、Mfn2、Opa1の働きにより引き起こされる。Mitofusion蛋白質であるMfn1およびMfn2はミトコンドリア外膜の膜融合に、Opa1はミトコンドリア内膜の膜融合にかかわっているとされている。一方、ミトコンドリアの分裂は、ミトコンドリア外膜蛋白質Fis1とGTPaseであるDrp1の働きにより引き起こされる。
マイトファジー
ミトコンドリアが損傷を受けると、活性酸素種やチトクロムcを産生・放出し、アポトーシスを誘導し、細胞にとって危険な存在になりえるので、損傷を受けたミトコンドリアを選択的に除去するマイトファジーという機構が存在する。
ミトコンドリアが損傷を受けた際に生じる膜電位の脱分極が起こると、細胞質内のPINK1(PTEN induced putative kinase 1)がミトコンドリア外膜に集積する。PINK1はミトコンドリア内膜に輸送された後、内膜に局在するRhomboid様蛋白質PARLによって52kDaのフォームに断片化される。この断片はプロテアソーム依存性のパスウェイで迅速に分解される。一方脱分極が起きたミトコンドリアでは、PINK1のミトコンドリア内膜への輸送及びPARLによる分解が阻害され、断片化されなかった全長PINK1がミトコンドリア外膜の再度ゾル面に集積する。さらにそこに集積した蛋白質Parkinによってマイトファジーが引き起こされる。
Parkinはユビキチン・リガーゼ活性を有し、MARF(mitofusion mitochondrial assembly regulatory factor)、VDAC1(voltage dependent anion-selective channel protein 1)、Mfn1、Mfn2などミトコンドリア内の様々な蛋白質をユビキチン化する。またParkinは、ユビキチン結合型アダプターp62(Sequestosome 1)を集積さる。P62は他のp62分子およびParkinによってユビキチン化された蛋白質結合して凝集し、オートファゴソーム内へと誘導して代謝させる。
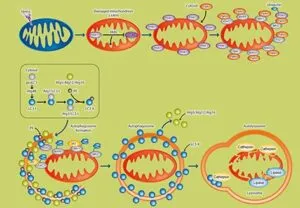
https://www.abcam.co.jp/neuroscience/mitochondrial-dynamics-mitophagy-and-autophagy-1
糖尿病と心不全
60歳以上で2型糖尿病患者における年齢及び性別で層別化したHFrEFおよびEFpEFの有病率を下表に示す。
オランダ南西部の60歳以上の2型糖尿病患者605例のうち心不全と診断されていなかった581例に精密検査を行い161例で心不全と診断された。28例で駆出率の低下、133例で駆出率は保たれていた。心不全の有病率は年齢とともに急増し、HFpEFは女性で多く見られた。
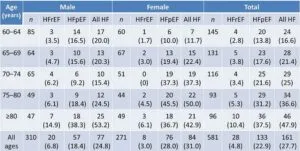
Diabetologia. 2012 Aug;55(8):2154-62.
https://link.springer.com/article/10.1007/s00125-012-2579-0
電子伝達系は盛んに酸化還元反応が起きる系で、この反応によりATPが産生されるが、同時に酸素分子が電子を受け取り還元されることでROSが産生される。体内におけるROS産生の多くがミトコンドリアによると考えられている。加増に産生されたROSを処理する機構もミトコンドリア内にあるが、高血糖などのストレス化においてはROS産生が過剰となり、ミトコンドリア機能異常が引き起される。
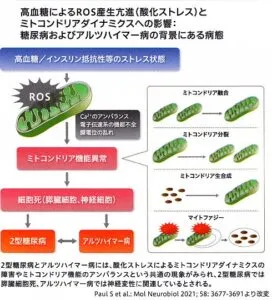
参:
酸化ストレスによって引き起こされるミトコンドリア動態の障害と機能障害は二型糖尿病の膵臓細胞死とアルツハイマー病の神経変性は共通した現象である。

ミトコンドリア動態・整合性・オートファジーの関連しているたんぱく質の調節不全は、アルツハイマー病の脳と、二型糖尿病の膵臓の両方にみられ、疾患発症の一因を担っている。
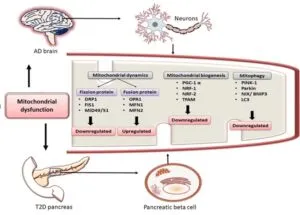
アルツハイマー病と二型糖尿病は疫学、組織学、分子的および生化学的特性の観点から相関しており、アルツハイマー病につながる2型糖尿病の有病率は50~70%にのぼり、3型糖尿病といっている人もいる。
Mol Neurobiol 2021 58 3677-3691
マウスに横行大動脈狭窄術(TAC)を施し、最大30日間の複数時点で観察した。TAC施行後5日後に心肥大が発生し、14日後に駆出率が低下し、30日後に心不全が認められた。
一般的なオートファジーは、TAC後1~12時間でアップレギュレーションされたが、TAC後5日後に、生理学的レベル以下にダウンレギュレーションされた。電子顕微鏡でミトコンドリア含有量及びミトコンドリア局在シグナルで評価するミトコンドリアオートファジーは、TAC後約3~7日で一過性に活性化され、Drp1のミトコンドリア転座と一致した。その後それはダウンレギュレーションされ、ミトコンドリア機能不全が継続した。Dro1のハプロ不全は、ミトコンドリアのオートファジーを消失させ、TAC後のミトコンドリア機能不全と心不全の両方の発症を悪化させた。TAC後7日目にオートファジーの強力な誘導剤であるTat-Beclin 1を注射すると、ミトコンドリアのオートファジーが部分的に回復し、過負荷によって誘導されるミトコンドリアの機能不全と心不全が軽減された。
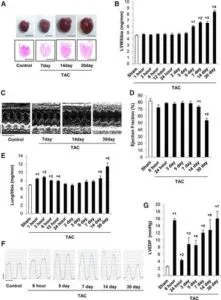
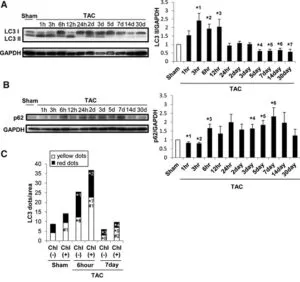
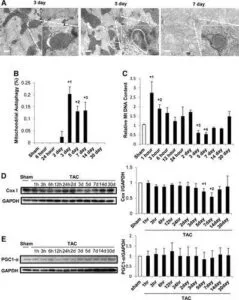
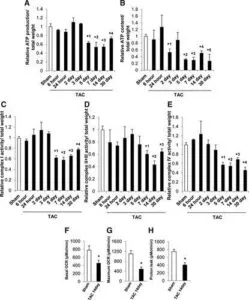
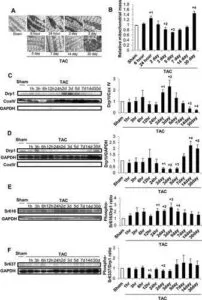
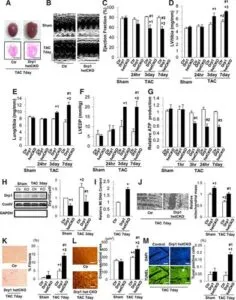
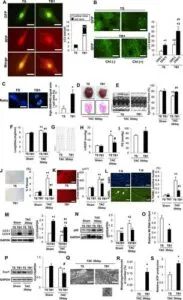
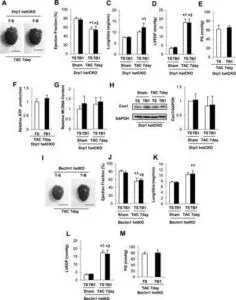
Circulation. 2016;133:1249–1263
https://www.ahajournals.org/doi/full/10.1161/CIRCULATIONAHA.115.020502
糖尿病患者の心筋症は、心筋肥大、拡張機能障害及び脂肪毒性といわれる細胞内脂肪蓄積により進展する。糖尿病患者の心臓は脂肪酸を主要なエネルギー源として利用し、酸化ストレスを上昇させ、ミトコンドリア機能障害を誘発する。
HFD摂食はATG7cKOマウスにおいて心筋障害を誘発した。
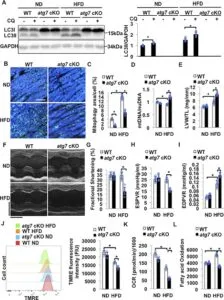
Circ Res. 2019 Apr 26;124(9):1360-1371.
https://pubmed.ncbi.nlm.nih.gov/30786833/
参:
糖尿病合併心不全の病態:
米国で65歳以上の1000人当たり10人に新規心不全が発症しており、日本でも65歳以上の新規心不全患者が35万人に増加するという試算がある。心不全と糖代謝異常には双方向性の増悪関係が報告されており、60歳以上で糖尿病が強く疑われる人の20.5%に心疾患があり、糖尿病でない人の心疾患有病率12.3%に比べ約2倍高い。CHARM試験などを含む慢性心不全の代表的大規模研究のメタ解析では、慢性心不全を呈する患者における糖尿病有病率は約30%(一般検診患者の有病率5%)、冠動脈疾患患者では約6割に耐糖能異常を含む糖尿病状態が併存する。
心臓の基本機能は、末梢主要臓器の酸素需要量に応じて血液を拍出するポンプであり、そのポンプ機能に障害が起こり、循環障害が生じ、うっ血をきたし、日常生活に障害を生じた状態が心不全である。心臓の収縮機能障害をきたすタイプをHErEF(Heart failure with reduced left-ventricular function)、見た目の収縮脳は保たれているにもかかわらず、拡張機能に障害をきたす結果有効な心拍出量を得られないタイプ:拡張不全HFpEF(Heart failure with preserved left-ventricular function)に分類される。
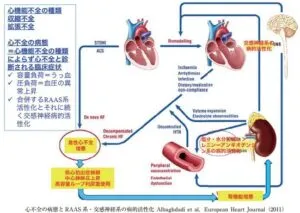
HFpEFの代表的危険因子は、高血圧、加齢、女性である。糖尿病も多くの文献がHFpEFの危険因子であることを指摘しているが、相反するデータも散見される。
血管造影上、冠動脈には明らかな虚血性心疾患の原因となる有意狭窄は認められないにもかかわらず、原因不明の心収縮能低下をきたす糖尿病合併心不全例が存在することが臨床的には古くから知られており、糖尿病心筋症と呼ばれてきた。

糖尿病患者心筋を病理組織学的に解析すると、心筋細胞肥大、心筋内線維化亢進、心筋脂質付着増大、心筋間の毛細血管密度減少が認められる。さらに電子顕微鏡による詳細な観察では、心筋において障害ミトコンドリアの増加を認める。すなわち、糖尿病による糖毒性・脂肪毒性、並びに合併するレニンアンギオテンシン系やインスリンなど複合的な神経液体調節因子異状の結果、心筋のみならず、心臓線維芽細胞や心臓毛細血管細胞など、心臓を構成する細胞群のすべてに基質的および機能的障害が生じた結果、糖尿病における心機能低下が惹起されることが病理組織所見から示唆される。
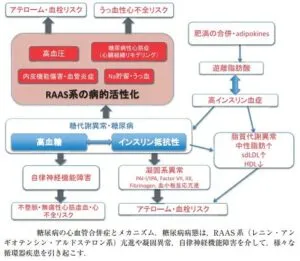
糖尿病59,554-557;2016
https://www.jstage.jst.go.jp/article/tonyobyo/59/8/59_554/_pdf/-char/ja
休しストレス、気が、G1/S期など、エネルギー需要の増加と供給の減少に関連する生理学的プロセスは、ミトコンドリアの伸長とATP合成に結合した呼吸によって特徴づけられる。
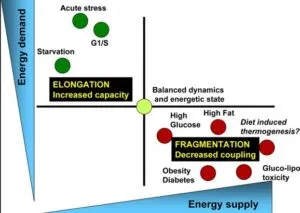
Cell Metab. 2013 Apr 2;17(4):491-506
https://pubmed.ncbi.nlm.nih.gov/23562075/
SGLT2阻害剤増強絶食が関代謝に及ぼす影響:
グルカゴンレベルは増加し、インスリンレベルは、最初はグリコーゲン分解により、最終的には糖新生によって、脳のグルコースレベルを維持するために減少する。FFAレベルはインスリンレベルが下がると上昇し、糖新生と細胞機能をサポートするために必要なエネルギーを提供する。活性化されると、肝臓の糖新生は利用可能なオキサロ酢酸を消費し、呉無州回路を遅くして、アセチルCoAが細胞質ゾルに蓄積してケトン体を生成し、肝臓外に出される。インスリンレベルが低下し、燃料がグルコースからFFAに切り替わると、糖新生基質(乳酸/ピルビン酸)が律速になり、グルコース合成をサポートする炭素源として糖原性アミノ酸への切り替えが起こる。オートファじジ―/マイトファジーおよびリソソーム分解は、循環しているアミノ酸の低下によって急速に活性化され、アミノ酸は再供給される。
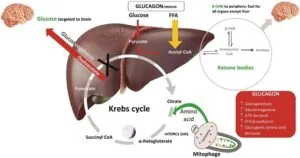
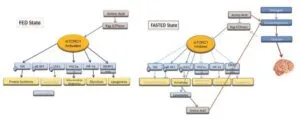
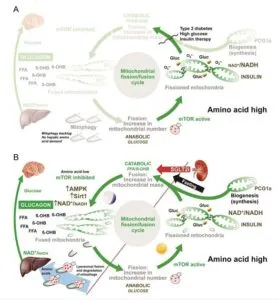
ミトコンドリア機能に対するSGLT2阻害薬治療の影響
インスリンのレベル上昇と燃料としての糖の利用、過剰な糖から細胞機関で合成されるたんぱく質の貯蔵を特徴とする日々にの同化周期が見られる。夜間などの空腹時にはグルカゴンが放出され、グリコーゲンや糖原性アミノ酸を使って糖新生を行う。
アミノ酸は、mTOR阻害により生じた全身の損傷した蛋白質(オートファジー/マイトファジー/ユビキチン・プロテアソーム系)のリソソーム分解によって供給される。糖新生がクレブス回路を阻害した際に肝臓以外の燃料源として、ケトン体が生成される。
インスリンで治療を受けている2型糖尿病患者は、インスリンレベルが上昇し、ブドウ糖を細胞内に取り込ませ、絶食状態を短時間にし、同化状態にする。インスリンレベルの上昇は、また、グルカゴンの上昇を妨げ、その有益な以下作用を妨げる。
SGLT2阻害薬を使用すると、一定量のグルコースを腎臓から排出するため、絶食状態を回復させ、異化状態に戻し、健康な状態の代謝サイクルが回復する。
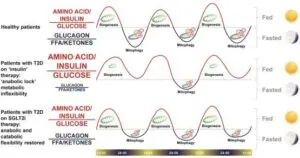
European Journal of Endocrinology (2018) 178, R113–R125
https://eje.bioscientifica.com/view/journals/eje/178/4/EJE-17-0832.xml
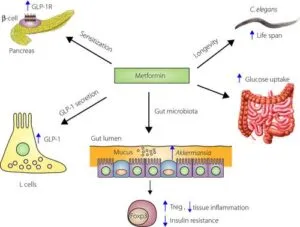
肝グルコース放出抑制、筋肉及び脂肪でのグルコース取り込みの増加、腸内でのグルコース利用の増加に加えて、メトホルミンはL細胞からのGLP-1の血漿レベルを増加させることによって院クレチンシグナル伝達を増強する可能性がある。
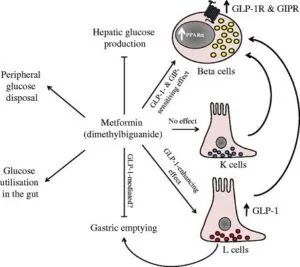
Diabetologia volume 54, pages219–222 (2011)
https://link.springer.com/article/10.1007/s00125-010-1986-3
メトホルミンは、ミトコンドリア複合体活性を低下させ、ATPの減少、AMPの増加をきたし、アデノシンリン酸化プロテインキナーゼ(AMPK)活性を上昇させる。その結果ミトコンドリア活性酸素種(ROS)産生は、ミトコンドリアとER94の間のミトコンドリア関連膜部位における二本鎖リボ核酸活性化プロテインキナーゼ様小胞体(ER)キナーゼの活性化によるISRをもたらす。続いて、真核生物の翻訳因子2α(elF2α)リン酸化および活性化転写因子4(ATF4)が誘導される。ATF4は線維芽細胞増殖因子21(FGF21)を誘導する。メトホルミンはミトコンドリアグリセロリン酸デヒドロゲナーゼ(mGPD)を阻害するが、細胞質グリセロリン酸デヒドロゲナーゼ(cGPD)は阻害しない。ミトコンドリアシャトルおよびグルカゴンシグナル伝達を阻害する。mGPDの阻害は、グリセロール-3-リン酸(G3P)からジヒドロキシアセトンリン酸(DHAP)への変換を妨げ、糖新生のためにG3Pに変換してからDHAPに変換する必要があるグリセロールからの糖新生をブロックする。ニコチンアミドアデニンジヌクレオチド(NAD)の細胞質酸化型の減少は、メトホルミン治療中に頻繁に観察される乳酸塩の蓄積を招く。メトホルミン処理後のAMPの増加は、アデニルさんシクラーゼ活性を阻害し、プロテインキナーゼA(PKA)によって媒介されるグルカドン誘発性糖新生遺伝子発現を弱める3’-5’-サイクリックアデノシン―リン酸(cAMP)含量を減少させる。
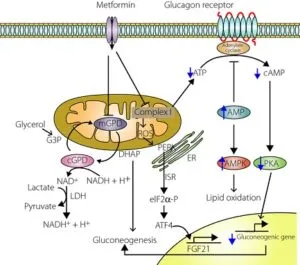
腸に対するメトホルミンの効果:
メトホルミンは腸L細胞からのグルカゴン様ペプチド1(GLP-1)放出、および膵β細胞でのGLP-1受容体発言を誘導する。メトホルミンは、腸内の粘液分解グラム陰性菌であるアッカーマンシアの存在量を増加させ、肥満動物の脂肪組織における制御性T(Treg)細胞の減少の回復及び低悪性度組織炎症の改善に関連する。メトホルミンによるカエノラプディティス・エレガンスの寿命の延長は、腸内細菌叢の変化にも起因している。
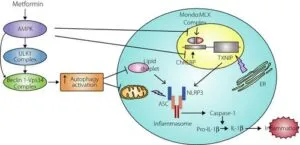
オートファジー、インフラマソームおよび小胞体(ER)ストレスに対するメトホルミンの効果
メトホルミンは、アデノシン一リン酸活性化プロテインキナーゼ(AMPK)活性化とそれに続くunc-51様キナーゼ1(ULK1)およびベクリン1のリン酸化を介してオートファジーを活性化する。オートファジーは、リポファジーを増加させることにより、脂肪滴のクリアランスを促進する。AMPK活性化はインフラマソーム活性化を弱める可能性があり、機能不全のミトコンドリアがインフラマソーム活性化を加速するため、マイトファジーを介した「ストレスを受けた」ミトコンドリアの若返りを伴う可能性がある。脂質は、インフラマソームを活性化するリガンドとして作用することができる。したがって、オートファジー活性化は、脂質含量およびミトコンドリアの両方に対する効果を通じてインフラマソーム活性化をダウンレグレーションする。AMPKは、モンド・マックス様プロテインX(MLX)複合体および糖鎖応答要素結合タンパク質(ChREBP)のTXNIPプロモーターへの動員を阻害することにより、チオレドキシン相互作用タンパク質(TXNIP)誘導を減弱する。TXNIPは、ヌクレオチド結合オリゴマー化ドメイン-ピリンドメイン3(NLRP3)を含むロイシンリッチリピートに結合し、インフラマソーム活性化に寄与する。TXNIP発現は小胞体ストレスによって増加し、インフラマソーム活性化を介してβ細胞傷害をきたす。
J Diabetes Investig. 2015 Nov;6(6):600-9.
https://onlinelibrary.wiley.com/doi/10.1111/jdi.12328
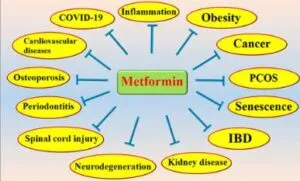
糖尿病患者では、ガン、心血管疾患、慢性腎臓病、肥満、骨粗鬆症、および神経変性疾患の有病率が高い。臨床試験や観察研究により、メトホルミンが、心血管疾患、肥満、多嚢胞性卵巣症候群(PCOS)、骨粗鬆症、ガン、歯周炎、神経損傷および神経変性疾患、炎症、炎症性腸疾患(IBD)、結核、およびCOVID-19を予防、または緩和できることが明らかになっている。またメトホルミンは老化防止薬としても期待されている。
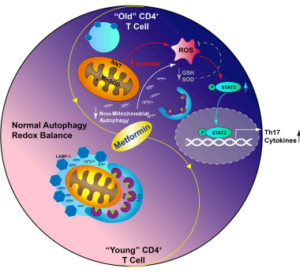
メトホルミンはLKB1/AMPK経路を活性化し、、いくつかの細胞内シグナル伝達系および分子機構(NF-κB、PI3K/AKT/mTOR、SIRT1/PGC-1α、NLRP3、ERK、P38MAPK、Wnt/β-カテニン、Nrf2、JNKなど)と相互作用する。
ACS Pharmacol. Transl. Sci. 2021, 4, 6, 1747–1770
https://pubs.acs.org/doi/full/10.1021/acsptsci.1c00167
Cell Metabolism 32 44-55 2020
2型糖尿病の治療のアルゴリズムを下図に示す。
まず、インスリンの絶対的及び相対的適応があるかどうかを判断することとしている。次に血糖コントロールの目標の設定について、「熊本宣言2013」及び「高齢者糖尿病の血糖コントロール目標」を基に決定することとした。合併症の観点からは、HbA1c 7%未満が妥当であるが、年齢や併存賞を考慮して目標を設定する。

糖尿病治療薬に求められる最重要事項は「安全に血糖を下げること」であるため、本アルゴリズムでは、有効性と安全性への配慮から血糖降下作用の強さ、低血糖リスク、各臓器障害(腎機能障害、肝障害、心血管障害、および心不全)を有する症例における各糖尿病治療薬の注意すべき点を下表のようにまとめている。
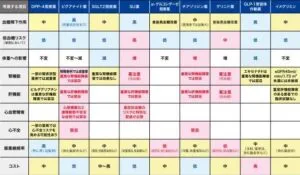
糖尿病 65 418-434 2022
http://www.fa.kyorin.co.jp/jds/uploads/65_419.pdf
Mystery of metformin
1959年2型糖尿病患者の血糖値を下げる薬剤としてdimethylbiguanideが発見された。
日本では1961年にメルビンが発売された。
1994年にFDAが糖尿病治療薬として認可
UKPDS(United Kingdom Prospective Diabteres Study)34試験:新たに糖尿病と診断された平均53歳の患者にメトホルミン投与群とSU薬投与群、インスリン投与群で比較した際にHbA1cのコントロール状況に有意さは認めなかったが、心筋梗塞をはじめ全死亡や糖尿病関連死、糖尿病関連エンドポイントでメトホルミン群で有意に抑制されていた。(Lancet 1998; 352: 854-65)
DPP(Diabetes Prevention Program):耐糖能異常患者において積極的なライフスタイル介入群、メトホルミン投与群とプラセボ群の比較で、新規糖尿病発症は4.8%、7.8%、11.0%であり、ライフスタイル介入群で58%、メトホルミン投与群で31%の糖尿病発症率低下が認められた。(Diabetes Care. 2009; 32: 726-32.)
More Study(Melbin Observational Research Study):新たにメトホルミン投与開始した日本人2型糖尿病1197例の観察対象研究で、HbA1cは3、6、12か月後に8.2から7.3に低下しその値が継続され、空腹時血糖値は168.9→146.6→150.4→145.2md/dLと有意に低下し、体重も有意に減少した。(糖尿病 49, 325-331, 2006)
UKPDS80:UKPDSに参加した患者を10年後に再調査したもの。強化療法群では、従来療法群に比べて、試験終了後血糖管理の差がなくなっていたにもかかわらず、細小血管障害に加え心筋梗塞の発症、糖尿病関連死亡及び全死亡が有意に減少していた。(N Engl J Med 359 : 1577-1589, 2008)
2010年5月10日にメトグルコが発売され、1日500㎎から開始し、1日2~3回食前または食後に経口投与され、最高投与量が2250㎎まで認可されている。
65歳以上の高齢者においてもメトホルミンの投与は問題なく投与可能で、血糖降下作用も問題ない。
Progress in Medicine 28 1969-1973 2008
参:65未満59例、65以上39例の産業医科大学のデータをいかに掲示する。
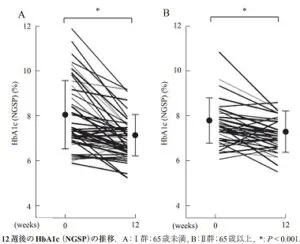
J UOEH 35:207-212, 2013
https://www.jstage.jst.go.jp/article/juoeh/35/3/35_207/_pdf/-char/en
メトホルミン増量群226例、メトホルミンにDPP-4阻害薬追加群240例、薬品切り替え群28例で検討した。HbA1cは増量群で7.76%、追加群で7.94%、切り替え群で7.56%であった。低用量のメトホルミンを増加する群で、切り替え群より、DPP-4阻害薬追加群よりも血糖コントロールがより良い可能性が示された。
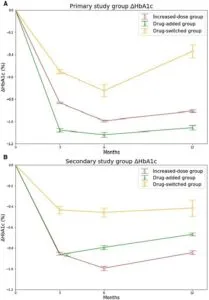
Diabetes Therapy volume 12, pages897–911 (2021)
https://link.springer.com/article/10.1007/s13300-021-01017-x
定期健康診断データを解析した報告で、メトホルミンはDPP-4阻害薬とは異なりBMIの増加にもかかわらずHbA1cは低下した。以前言われていたよな肥満の患者にはメトホルミンは有効であるが、やせている人には効きが良くないということはなく、太っていてもやせていても有効な糖尿病治療であるといえる。

Diabetes Ther. 2021 Aug;12(8):2165-2177
https://link.springer.com/article/10.1007/s13300-021-01101-2
























